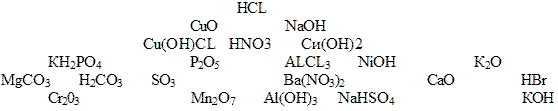|
Задание.
1. В 300 г морской воды содержится 9 г солей. Вычислите массовую долю солей в этом образце морской воды.
2. В 240 г воды растворили 60 г сахара. Какова массовая доля сахара в полученном растворе?
3. В 1 л раствора серной кислоты содержится 228 г H2SO4. Рассчитайте массовую долю растворенного вещества, учитывая, что плотность раствора равна 1,14 г/мл.
4. Какова массовая доля сахара в растворе, полученном при упаривании 100 г 20 %-ного раствора до 80 г?
5. К 100 г 30 %-ного раствора сахара добавили 10 г сахара. Какова массовая доля сахара в полученном растворе?
6. В медицине часто применяется физиологический раствор – 0,9 %-ный раствор хлорида натрия. Какая масса соли водится в организм при вливании 500 г такого раствора?
7. Сколько граммов соли и миллилитров воды нужно взять, чтобы приготовить 250 г 20 %-ного раствора этой соли?
8. Смешали 200 г 40 %-ного и 100 г 30 %-ного раствора азотной кислоты. Определите массовую долю кислоты в полученном растворе.
9. Какую массу фосфата калия и воды надо взять для приготовления раствора с массовой долей К3РО4 8% массой 250 г?
10. Какую массу соли и воды надо взять для приготовления раствора с массовой долей сульфата натрия 0,12 массой 40 кг?
Практическая работа №1
РЕШЕНИЕ

Ответ: Для приготовления 20% раствора сахара, необходимо взять 160 г воды и 40 г соли.
Последовательность выполнения работы:
1. Задание. Необходимо приготовить 50 г 2% раствора соли:
- выполните расчеты
- взвесьте необходимую массу соли и поместите ее в колбу.
- отмерьте нужное количество воды и добавьте ее в колбу с солью, перемешайте раствор.
Сформулируйте вывод.
3. Выберите 3 задания по своему желанию из общего списка и выполните расчеты:
№ 1. Для полоскания горла используется 2 % раствор соды. Вычислите массу соды и объём воды, которые необходимо взять для приготовления 150 г такого раствора. Приготовьте раствор.
№ 2. Для засолки огурцов применяется 10 % раствор поваренной соли. Вычислите массу соли и объём воды, которые необходимо взять для приготовления 200 г такого раствора. Приготовьте раствор.
№ 3. Перед посадкой семена томатов дезинфицируют (протравливают) 1% раствором перманганат калия. Вычислите массу перманганата калия и объём воды, которые необходимо взять для приготовления 100 г такого раствора. Приготовьте раствор.
№ 4. Для удаления с побелки ржавых пятен используют 2 % раствор сульфата меди(II). Вычислите массу сульфата меди(II) и объём воды, которые необходимо взять для приготовления 300 г такого раствора. Приготовьте раствор.
№ 5. Для приготовления компотов из яблок, груш и т.д. используется 40 % раствор сахара. Вычислите массу сахара и объём воды, которые необходимо взять для приготовления 50 г такого раствора. Приготовьте раствор.
№ 6. Для подкормки растений используется 2 % раствор кальциевой селитры. Вычислите массу соли и объём воды, которые необходимо взять для приготовления 150 г такого раствора. Приготовьте раствор.
Контрольные вопросы:
1. Какие растворы используются в быту и на предприятиях вашего профиля?
Электролиты и неэлектролиты
Кислоты и их свойства
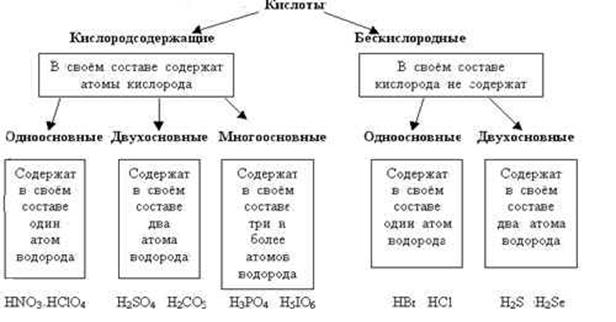
По силе электролитической диссоциации кислоты подразделяют на сильные и слабые электролиты.
Ряд активности кислот выглядит следующим образом:
сильные – HI, HBr, HСlO4, HCl, H2SO4, HMnO4, HNO3, H2Cr2O7;
средние – H2CrO4, H2SO3, H3PO4, HF, HNO2;
слабые – CH3COOH, H2CO3, H2S, H3BO3;
очень слабые – HCN, H2SiO3.
|
Кислота
|
Кислотный остаток.
| | название
| формула
| название
| формула
| | Соляная (хлороводородная)
| HCl
| Хлорид
| Cl –
| | Плавиковая (фтороводородная)
| HF
| Фторид
| F –
| | Бромоводородная
| HBr
| Бромид
| Br –
| | Иодоводородная
| HI
| Иодид
| I –
| | Хлорноватистая
| HClO
| Гипохлорит
| ClO –
| | Хлорноватая
| HClO3
| Хлорат
| ClO3 –
| | Хлорная
| HClO4
| Перхлорат
| ClO4 –
| | Азотистая
| HNO2
| Нитрит
| NO2 –
| | Азотная
| HNO3
| Нитрат
| NO3 –
| | Сероводородная
| H2S
| Сульфид
Гидросульфид
| S2 –
HS –
| | Сернистая
| H2SO3
| Сульфит
Гидросульфит
| SO3 2 –
HSO3 –
| | Серная
| H2SO4
| Сульфат
Гидросульфат
| SO4 2 –
HSO4 –
| | Угольная
| H2CO3
| Карбонат
Гидрокарбонат
| СО3 2 –
НСО3 –
| | Кремниевая
| H2SiO3
| Силикат
| SiO3 2 –
| | Ортофосфорная
| H3PO4
| Ортофосфат
Гидроортофосфат
Дигидроортофосфат
| РО4 3 –
НРО4 2 –
Н2РО4 –
|
Лабораторная работа № 3
Теоретические основы
Кислоты – электролиты диссоциирующие в воде на ионы водорода и ионы кислотного остатка.
H2SO4 ↔ 2H+ + SO42-
Химические свойства.
- разбавленные кислоты взаимодействуют с металлами, стоящими в ряду активности металлов до водорода, или имеющие меньший электродный потенциал, чем водород:
2HCl + Zn = ZnCl2 + H2;
- взаимодействуют с оксидами металлов: 2HCl + ZnО = ZnCl2 + H2О;
- взаимодействуют с основаниями и щелочами:
2HCl + Cu(OH)2 ↓ = CuCl2 + 2H2О HCl + NaOH = NaCl + H2О
- взаимодействуют с солями слабых кислот FeS + 2HCl = H2S + FeCl2
Выполнение работы
Академик
1. В приведённых ниже схемах уравнений реакций замените буквы и слова формулами соответствующих веществ. Напишите молекулярные, полные и сокращённые ионные уравнения реакций между этими веществами.
1) С + кислота → соль + кислота;
2) Д + кислота → соль + вода;
3) А + кислота → соль + вода + газ;
2. Используя дополнительную литературу, соберите сведения о распространённости в природе кислот и областях их применения.
Основания и их свойства
Классификация оснований
Делятся на гидроксиды, которые растворяются в воде (растворимые), и гидроксиды, которые не растворяются в воде (нерастворимые). Растворимые гидроксиды называют щелочами. Щелочи образуются щелочными и щелочноземельными металлами.
Гидроксиды щелочноземельных металлов слабее, чем гидроксиды щелочных металлов, их основный характер усиливается вниз по группе: Ве(ОН)2 - амфотерное основание Мg(ОН)2 - слабое основание Са(ОН)2 – сильное основание Ва(ОН)2 - очень сильное основание
Металлические свойства элементов главной подгруппы IIIгруппы выражены слабее, чем у элементов главных подгрупп I и IIгрупп, т.к. тенденция к отдаче электронов у них меньше
Увеличение радиуса от Аl к Тl менее значительно, чем у щелочных, щелочноземельных металлов, поэтому усиление основного характера соединений происходит медленнее.
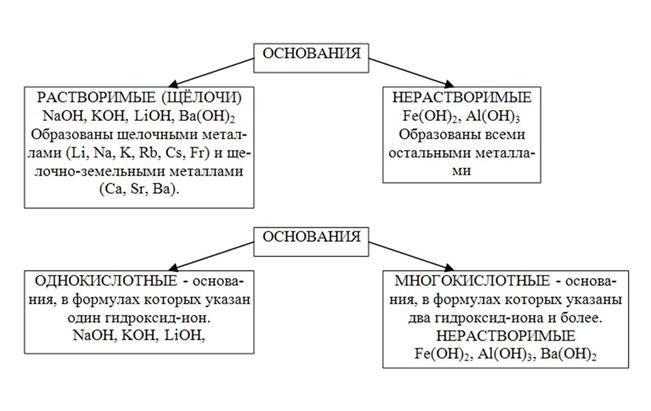
Задание. Распределить основания по группам и привести примеры их диссоциации: KOH, Zn(OH)2, Cu(OH)2, Al(OH)3, NaOH, Mg(OH)2. Какие из этих оснований будут электролитами?
|
| Растворимые/щелочи/
| Амфотерные
| Нерастворимые
| | Однокислотные
|
|
|
| | Двухкислотные
|
|
|
| | Трехкислотные
|
|
|
|
Получение оснований:
1. Щелочной металл + вода.
2Na + 2H2O → 2NaOH + H2↑
2. Основной оксид (щелочной металл) + вода.
Na2O + H2O → 2NaOH
3. Основание + соль.
NaOH + AlCl3 → NaCl + Al(OH)3
Лабораторная работа № 4
Теоретические основы
Основания – электролиты, диссоциирующие в воде на ионы металлов и гидроксогрупп:
Ca (OH)2 ↔ Ca2+ + 2OH-
Основания бывают растворимые в воде (щелочи) и нерастворимые в воде. Ca (OH) 2 ↔ Ca2+ + 2OH-
Называются основания гидроксидами: Ca (OH)2 – гидроксид кальция; Fe (OH)2 – гидроксид железа (II); Fe (OH)3 – гидроксид железа (III)
Химические свойства оснований.
1. Щелочи взаимодействуют:
- с кислотными оксидами 2NaOH + CO2 = Na2CO3 + H2O
- с кислотами NaOH + HCl = NaCl + H2O
- с солями, если образуется нерастворимое основание 2NaOH + ZnCl2 = 2NaCl +Zn(OH)2↓
2. Нерастворимые основания разлагаются при нагревании: Zn (OH)2↓ → ZnO + H2O
Нерастворимые основания взаимодействуют с кислотами: Zn (OH)2↓ + 2HCl = ZnCl2 + 2H2O
Выполнение работы
Уровень
1. Запишите реакции диссоциации оснований: Fe (OH)3; Cu(OH)2
2. Какие индикаторы указывают на щелочную среду раствора щелочей
3. Осуществить превращение: Fe → FeO → FeCl2 → Fe (OH)2 → FeSO4
Способы получения оснований
1. Щелочи получают взаимодействием активных металлов с водой, а также их оксидов с водой:
2Na + 2Н2O = 2NaОН + H2↑
ВаО + Н2O = Ва(OH)2
2. Нерастворимые в воде основания получают в результате реакции обмена между солью и щелочью:
Сu(NO3)2 + KOH = KNO3 + Сu(OH)2
Задание:
1. Однажды на складе при побелке потолка гашеной известью были испорчены алюминиевые детали, т. к. они не были надёжно защищены от попадания брызг извести. Порча изделия объясняется тем, что:
а) детали были загрязнены побелочным раствором;
б) произошло химическое взаимодействие изделий с раствором гашёной извести;
в) произошло химическое взаимодействие изделий с водой.
2. Металлы А и Б принадлежат одному и тому периоду и одной и той же группе. Металл А активно взаимодействует с водой, а металл Б не вытесняет водород из кислот. Металл А образует только один оксид, а Б – два, в одном из которых его валентность численно больше, чем номер группы. Назовите эти элементы.
Задание для самостоятельного выполнения.
Закончить уравнения реакций в молекулярном и ионном виде:
1. NaOH + H2SO4 =
2. Al(OH)3 + HCl =
3. Al(OH)3 + NaOH =
4. KOH + CuSO4 =
Соли и их свойства
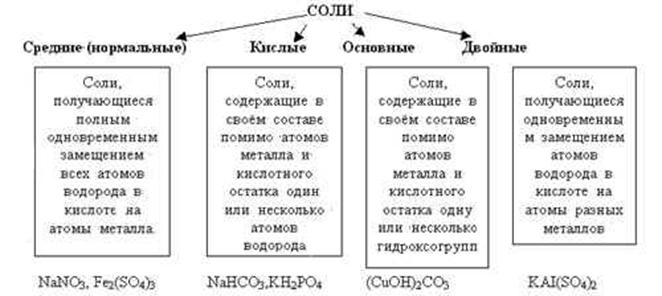
Названия кислых солей. Например, KHCO3 – гидрокарбонат калия
КH2PO4 – дигидроортофосфат калия
Нужно помнить, что кислые соли могут образовывать двух и более основные кислоты, как кислородсодержащие, так и бескислородные кислоты.
Чтобы назвать основную соль необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН - групп, входящих в состав соли.
Например, (CuOH)2CO3 - гидроксокарбонат меди (II)
Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Однако, следует понимать, что многие из кислых и основных солей могут существовать лишь только теоретически, реально же в растворах такие соли, как правило, нестабильны.
Лабораторная работа № 5
Теоретические основы
Соли – электролиты диссоциирующие на ионы металла и кислотного остатка.
Ca (NO3)2 ↔ Ca2+ + 2NO-
Соли взаимодействуют:
- с солями, если образуется нерастворимая соль:
3Na2S + 2FeCl3 = 6NaCl + Fe2S3↓
- с металлами, более активный металл вытесняет из раствора соли менее активный
CuCl2 + Zn = ZnCl2 + Cu
- со щелочами 2NaOH + ZnCl2 = 2NaCl +Zn(OH)2↓
- с более сильными кислотами, чем кислота, образующая соль FeS + 2HCl = H2S + FeCl2
Гидролиз соли – это реакция взаимодействия соли с водой, в результате которой образуется ион слабого основания и меняется реакция среды раствора.
Гидролизу подвергаются соли, в состав которых входит ион слабого электролита. Если соль образована слабой кислотой и сильным основанием, то в результате гидролиза среда раствора соли станет щелочной и наоборот.
Выполнение работы
Оксиды и их свойства
Оксиды – это сложные вещества, состоящие из 2-х химических элементов, один из которых кислород со степенью окисления -2 (ЭmOn). 
Основными оксидами называются такие оксиды, которым в качестве гидратов (продуктов присоединения воды) соответствуют основания.
Например: Основные оксиды Соответствующая гидратная форма (основание)
Na2O → NaOH
BaO→ BaOH
СaO→ СaOH
Основные оксиды образуют металлы при проявлении ими невысокой валентности (обычно I или II). Оксиды таких металлов, как Li,Na, K, Rb, Cs, Fr, Ca, Sr, Ba взаимодействуют с водой с образованием растворимых в воде оснований - щелочей. Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получают из солей (косвенным путем).
Кислотными оксидами называются такие оксиды, которым в качестве гидратов соответствуют кислоты. Кислотные оксиды называют также ангидридами кислот.
Например: кислотные оксиды и соответствующая гидратная форма (кислота)
SO3 → H2SO4
Р2О3 → H3РO4
СrО3 → H2CrO4
Кислотные оксиды образуют неметаллы и металлы при проявлении ими высшей валентности. Например, оксид марганца (VII) - кислотный оксид, так как в качестве гидрата ему соответствует кислота HMnO4 и это оксид металла с высшей валентностью.
Большинство кислотных оксидов могут взаимодействовать с водой непосредственно и при этом образовывать кислоты.
Например: СrО3 + H2O → H2CrO4
Р2О5 + 3H2O → 2H3РO4
SO3 + H2O → H2SO4
Некоторые оксиды непосредственно с водой не взаимодействуют. Такого типа оксиды сами могут быть получены из кислот. Например: H2SiO3→ SiO2 + H2O (температура)
Это подтверждает названия кислотных оксидов - ангидриды, то есть "не содержащие воду". Оксиды SO2 и CO2 реагирую с водой обратимо:
СО2 + H2O ↔ H2CO3; SО2 + H2O ↔ H2SO3
Это подтверждает названия кислотных оксидов - ангидриды, то есть "не содержащие воду".
Амфотерные оксиды представляют собой оксиды, которые в зависимости от условий проявляют свойства как основных (в кислой среде), так и кислотных (в щелочной среде) оксидов.
К амфотерным оксидам относятся только оксиды некоторых металлов.
Например: BeO, Al2O3, PbO, SnO, ZnO, PbO2, SnO2, Сr2О3
PbO + 2HNO3→ Pb(NO3)2 + H2O
а) В кислой среде PbO (оксид свинца (II)) проявляет свойства основного оксида
б) в щелочной среде PbO проявляет свойства кислотного оксида.
t
PbO + 2NaOHтв → Na2 PbO2 + H2O
Амфотерные оксиды с водой непосредственно не взаимодействуют, следовательно, их гидратные формы получают косвенно - из солей. Несолеобразующие (индифферентные) оксиды - небольшая группа оксидов, не вступающая в химические реакции с образованием солей. К ним относятся: CO, N2O, NO, SiO.
Задание. 1) Из следующего перечня выписать отдельно химические формулы оксидов, оснований, кислот, солей:
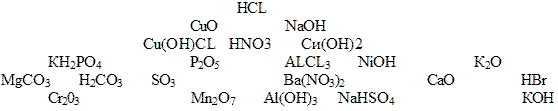
.
2 ) С какими из перечисленных веществ: NaOH, H2SO4, CO2, K2CO3, MgO, CuSO4 реагируют (1 вариант - КОН); (2 вариант - HCl), напишите возможные уравнения реакций:
3) Запишите уравнения реакций, с помощью которых можно осуществить превращения:
а) Cu –CuO – CuCl2---Cu (OH)2—Cu(NO3)2
б) Si –SIO2 --Na2SiO3 –H2SiO3
Химические реакции
Скорость химических реакций
ЛАБОРАТОРНАЯ РАБОТА № 6
Тема: «Реакция замещения меди железом в растворе медного купороса. Реакции, идущие с образованием осадка, газа или воды. Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. Зависимость скорости взаимодействия оксида меди (II) с соляной кислотой от температуры»
Цель: изучить реакции замещения, присоединения, обмена.
Оборудование: растворы: медного купороса (CuSO4· 5 H2O), BaCl2, NaOH, HCl, NaHCO3 (хлебная сода), скрепка или кнопка, фенолфталеин, раствор азотной кислоты; раствор уксусной кислоты; раствор карбоната натрия; раствор нитрата серебра, раствор медного купороса, оксида меди(II) CuO (порошок); пробирки, пипетки, спиртовка, штатив.
Теоретический материал
· Зависимость скорости реакции от природы металла.
Металлы (натрий и калий) с одним и тем же веществом (водой) будут реагировать с различной скоростью (в одинаковом состоянии и при одинаковых условиях).
Причина заключается в том, что атомы металлов отдают электроны, то есть окисляются. Атомы калия обладают большим радиусом чем натрия, и поэтому отдают электроны гораздо энергичнее.
· Зависимость скорости реакции от поверхности реагирующих веществ.
Для веществ в твердом состоянии скорость химической реакции прямо пропорциональна поверхности реагирующих веществ.
При измельчении вещества увеличивается площадь соприкосновения реагирующих веществ. Например, вещества железо и сера реагируют достаточно быстро при предварительном измельчении и перемешивании.
· Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации.
Вещества в растворенном состоянии и газы реагируют активнее с концентрированными веществами (например, горение веществ в чистом кислороде происходит активнее чем в воздухе так как в воздухе концентрация кислорода в воздухе в 5 раз меньше). Чтобы произошла реакция необходимо столкновение молекул реагирующих веществ. Частота столкновений зависит от числа молекул в единице объёма, то есть от концентрации.
Таблица признаки необратимости реакций
| Признак
| Примеры
| | Реакция идет с выделением большого количества теплоты
| 2Mg + O2 → 2MgO + Q
| | Хотя бы один продукт реакции покидает сферу реакции (выпадает в осадок или выделяется в виде газа)
| СаСl2 + Na2SO3 → CaSO3↓ + 2NaCl
CaCO3 →t→ CaO + CO2↑
| | В результате реакции образуются малодиссоциируемые вещества
| (CH3COO)NH4 + H2O → CH3COOH + NH4OH
HCl + NaOH → NaCl + H2O
|
Химическое равновесие и способы его смещения
Химическое равновесие – это такое состояние системы при котором скорость прямой и обратной реакции равны.
На химическое равновесие влияют: концентрация реагирующих веществ, температура, давление (для газов).
Принцип Ле – Шателье:
Если на систему, находящуюся в химическом равновесии, производится какое-либо внешнее воздействие, то в системе усиливаются процессы, которые стремятся свести это воздействие к минимуму.
Температура
| 


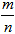 (рассчитывается по ПСХЭ)
(рассчитывается по ПСХЭ)



 При ранении стеклом удалите осколки из раны, смажьте края раны раствором йода и перевяжите бинтом. При необходимости обратиться к врачу
При ранении стеклом удалите осколки из раны, смажьте края раны раствором йода и перевяжите бинтом. При необходимости обратиться к врачу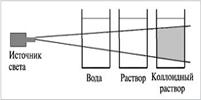 Краткие теоретические сведения
Краткие теоретические сведения