В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных признака: величину атомной массы и свойства. При этом он обнаружил, что свойства элементов изменяются в пределах определенных их совокупностей линейно (монотонно возрастают или убывают), а затем повторяются периодически, то есть через определенное число элементов встречаются сходные. Ученый выделил периоды, в которых свойства химических элементов и образованных ими веществ закономерно изменяются.
На основании этих наблюдений Д.И. Менделеев сформулировал Периодический закон, который в соответствии с принятой в настоящее время терминологией звучит так: «Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от их относительных атомных масс».
Днем рождения великого закона считается 1 марта 1869 г.
Графическим отражением периодического закона является периодическая система химических элементов Менделеева.
Элементы группы распределяются по подгруппам. Главная подгруппа – это вертикальный ряд элементов, атомы которых имеют одинаковое число электронов на внешнем энергетическом уровне. Это число равно номеру группы (кроме водорода и гелия).
Важнейшими свойствами химических элементов являются металличность и неметалличность.
Металличность – это способность атомов химического элемента отдавать электроны. Количественной характеристикой металличности является энергия ионизации.
Неметалличность – это способность атомов химического элемента присоединять электроны. Количественной характеристикой неметалличности является сродство к электрону.
Универсальной характеристикой металличности и неметалличности является электроотрицательность (Э О) элемента – способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.
Периодом называется т акая последовательность элементов, на протяжении которой свойства их изменяются в порядке постепенного усиления от типично металлических до типично неметаллических (металлоидных). Заканчивается каждый период инертным элементом. По мере ослабления металлических свойств у элементов начинают появляться и постепенно усиливаются неметаллические свойства; в середине периодов находятся обычно элементы, совмещающие в той или иной степени как металлические, так и неметаллические свойства. Эти элементы часто называют амфотерными.
Период – это последовательность элементов (от щелочного металла до инертного газа), атомы которых имеют одинаковое число энергетических уровней, равное номеру периода.
Периоды не равномерны по числу входящих в них элементов. Первые три называются малыми, остальные четыре — большими.
Строение атома
Атом состоит из атомного ядра и электронной оболочки. Форма атома - сферическая.
В состав ядра входят элементарные частицы (нуклоны) – протоны (11p) и нейтроны (10n). Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е -).
Число протонов N (p+) равно заряду ядра (Z) и порядковому номеру элемента
Сумма числа нейтронов N (n 0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А.
A = Z + N
Число электронов N (e -) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
N (p +) = N (e -) = Z
Состав атома:
| Частица
| Как определить?
| Масса
|
| Электрон е -
| По порядковому Номеру (N)
| -1
|
| Протон p+
| По порядковому номеру (N)
| +1
|
| Нейтрон n 0
| Ar – N
|
|
Атом – это электронейтральная частица, которая состоит из положительно заряженного ядра и отрицательно заряженных электронов.
Атомы одного и того же элемента могут отличаться друг от друга своей массой; такие атомы получили название изотопов. Примером могут служить атомы: 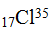 и
и 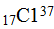 . В периодической системе изотопы одного и того же элемента занимают одну клетку.
. В периодической системе изотопы одного и того же элемента занимают одну клетку.
Изотопы – разновидность атомов одного и того же химического элемента, имеют одинаковое число протонов, но различаются числом содержащихся в них нейтронов, т.е. отличающиеся друг от друга только своей массой.
Изотопы известны для всех химических элементов. В природе большинство их существует в виде смеси изотопов. Относительная атомная масса элемента равна среднему значению относительных атомных масс всех его природных изотопов с учетом их распространенности. В таблице Периодической системы под символами химических элементов приведены средние значения их относительных атомных масс.
В связи с открытием изотопов было уточнено понятие химический элемент.
Химический элемент – вид атомов, имеющих одинаковый заряд ядра - одинаковое количество протонов в ядре. Была уточнена и формулировка периодического закона.
Открытие изотопов позволило дать другое, современное определение Периодического закона: «Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от зарядов их атомных ядер»



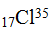 и
и 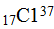 . В периодической системе изотопы одного и того же элемента занимают одну клетку.
. В периодической системе изотопы одного и того же элемента занимают одну клетку.


