Как известно, термодинамическим равновесием называется такое состояние системы, в которое она приходит через большой промежуток времени в условиях изоляции от внешней среды. Равновесное состояние термодинамической системы характеризуется функциями состояния, которые носят также название термодинамических функций или термодинамических потенциалов.
Основные функции состояния:
1) Внутренняя энергия U=U(S,V); dU=TdS-pdV;
2)Энтальпия H=H(S,p); dH=TdS+Vdp;
3) Энергия ГельмгольцаF=F(T,V); dF=-SdT-pdV;
4) Энергия Гиббса G=G(T,p); dG=-SdT+Vdp
Все эти выражения записаны для случая постоянства числа частиц N в системе, иначе в правой части этих уравнений добавляется член μdN, где μ-химический потенциал, имеющий смысл термодинамического потенциала, отнесенного к одной частице:
μ= 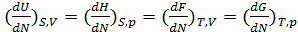
Общее термодинамическое рассмотрение фазовых переходов второго рода было выполнено Л.Д.Ландау. Его теория базируется на представлении об изменении симметрии термодинамической системы при фазовом переходе. Поскольку симметрия является качественной характеристикой системы, то она меняется даже при бесконечно малом изменении состояния системы, то есть фазовый переход происходит при точно определенных значениях параметров системы (температуре, давлении и других). Так, например, при сегнетоэлектрическом и ферромагнитном фазовых переходах наблюдается упорядочение электрических и магнитных моментов в веществе. Количественное описание степени симметричности и упорядоченности системы проводится с помощью параметра порядка фазового перехода. Первым постулатом теории Ландау является возможности разложения термодинамического потенциала (энергии Гиббса) в ряд по параметру порядка η:
G(p,T, η)= G0+α0η+A0η2+B0η3+C0η4+….(3),
где коэффициенты разложения α0,A0,B0,C0... являются функциями давления p и температурыT.
Возможность такого разложения обосновывается тем, что вблизи температуры фазового перехода значение параметра порядка η может быть сколь угодно малым. Из симметрии системы относительно величины η следует, что α0 ≡ 0, В0 ≡ 0
Для того, чтобы точка фазового перехода соответствовала устойчивому состоянию, термодинамический потенциал должен иметь минимум в этой точке:
 ;
; 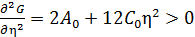 (4)
(4)
Из этих выражений следует, что при Т>Tпη =0 и
А0> 0; при T<Tпη=  (5)
(5)
Коэффициент разложения А0(p,Т) в (3) должен обращаться в нуль в точкефазового перехода, поскольку А0 > 0 при Т>Тп и А0 < 0 при Т <Tп. Только значению А0<0 может соответствовать минимум термодинамического потенциала при η ≠ 0. Коэффициент разложения С0> 0 во всем интервале температур ((4),(5)).
В точке фазового перехода G(р, Т, η) = G0.
Вторым постулатом теории Ландау является линейная температурная зависимость коэффициента А0 вблизи перехода при условии постоянства давления: 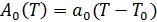 ,(6)где
,(6)где  - постоянная. Здесь предполагается, что С0 не зависит от температуры.
- постоянная. Здесь предполагается, что С0 не зависит от температуры.
Таким образом значение параметра порядка η при Т<Тп имеет вид:
η= 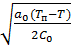 .(7)
.(7)
Вблизи температуры фазового перехода энтропия:
S=  (8)
(8)
В симметричной высокотемпературной фазе η = 0, S = S0; при T <Tn

Заметим, что полученная функция S(T) является непрерывной. Теперь можно найти значения теплоемкостей 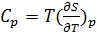 в обеих фазах при
в обеих фазах при
температуре Tп.
В низкотемпературной фазе 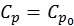 +
+ 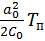 , в высокотемпературной фазе
, в высокотемпературной фазе 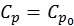 , где
, где 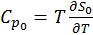 .
.
Скачок теплоемкости при фазовом переходе: [20]
∆ 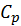 =
= 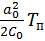 . (10)
. (10)
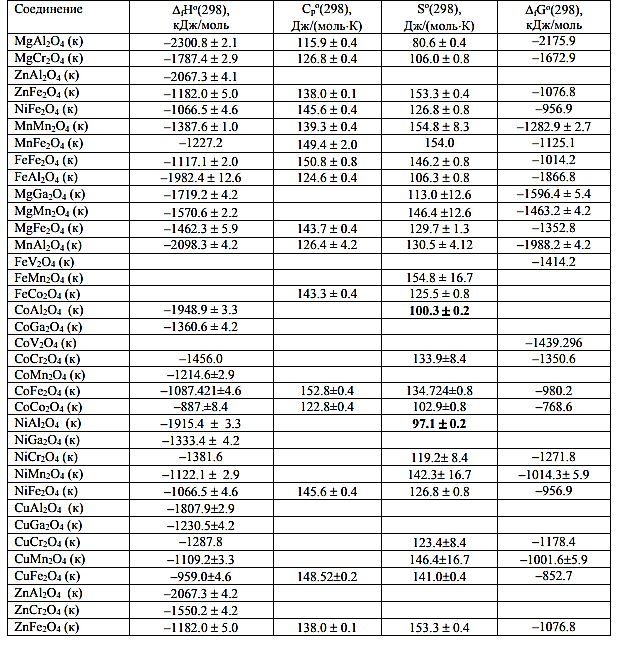
Термодинамические исследования представляют особую важность для прогнозирования свойств шпинелей,а также моделирования геохимических процессов с их участием. В литературе присутствуют сведения о стандартных термодинамических функциях соединений состава MIIAIIIAIIIO4 и только в последнее время исследуются соединения с общей формулой MIIAIIAIVO4.
Таблица 2. Абсолютные энтропии, теплоемкости и стандартные термодинамические функции образования некоторых соединений со структурой шпинели



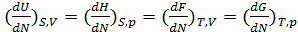
 ;
; 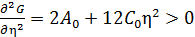 (4)
(4) (5)
(5)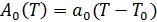 ,(6)где
,(6)где  - постоянная. Здесь предполагается, что С0 не зависит от температуры.
- постоянная. Здесь предполагается, что С0 не зависит от температуры.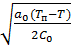 .(7)
.(7) (8)
(8)
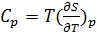 в обеих фазах при
в обеих фазах при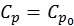 +
+ 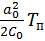 , в высокотемпературной фазе
, в высокотемпературной фазе 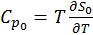 .
. 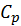 =
= 



