Термодинамика изучает взаимные превращения различных видов энергии. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называется термохимией. Реакции, которые сопровождаются выделением теплоты, называются экзотермическими, а которые сопровождаются поглощением теплоты – эндотермическими. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы DН. Энтальпия Н является функцией состояния системы, определяет запас энергии данного вещества. При экзотермических реакциях энтальпия системы уменьшается и DН<0, при эндотермических реакциях энтальпия системы увеличивается и DН>0.
Термохимические расчеты основаны на законе Гесса: тепловой эффект химической реакции (изменение энтальпии) зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Пример 1. Реакция горения этана выражается термохимическим уравнением
С2Н6(г) + 3  О2(г) = 2СО2(г) + 3Н2О(ж); DН = -1559,87 кДж
О2(г) = 2СО2(г) + 3Н2О(ж); DН = -1559,87 кДж
Вычислите энтальпию (теплоту) образования этана. Сколько теплоты выделится при сгорании 50 л этана в пересчете на нормальные условия.
Решение. Химические уравнения, в которых указан тепловой эффект реакции (DН) и агрегатные состояния веществ (ж – жидкое, к – кристаллическое, г – газообразное, р – растворенное вещество) или кристаллические модификации (графит, алмаз) – называются термохимическими. В термохимических расчетах применяется следствие из закона Гесса: тепловой эффект реакции (изменение энтальпии) равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов (числа молей участвующих в реакции веществ)

Энтальпией образования называют изменение энтальпии в реакции образования 1 моль химического соединения из простых веществ, устойчивых при данных условиях. Обычно энтальпии образования относят к стандартному состоянию: температуре 25°С(298К) и давлению 1,013×105Па, и обозначают DН  . Для этих же условий рассчитывают и тепловые эффекты реакций DН. Значения DН
. Для этих же условий рассчитывают и тепловые эффекты реакций DН. Значения DН  некоторых веществ приведены в таблице 3.
некоторых веществ приведены в таблице 3.
Таблица 3.Стандартные энтальпии образования DН  некоторых веществ
некоторых веществ
| Вещество
| Состояние
| DН  кДж/моль
кДж/моль
| Вещество
| Состояние
| DН  кДж/моль
кДж/моль
|
| CS2
C2H4
C6H6
C2H6
C2H2
CH4
CO
CO2
CH3OH
C2H5OH
SO2
| г
г
г
г
г
г
г
г
г
г
г
| +115,28
+52,28
+82,93
-84,67
+226,80
-74,85
-110,52
-393,51
-201,17
-235,31
-296,90
| H2S
H2O
H2O
HCl
NO
NO2
NH3
NH4Cl
Fe2O3
Ca(OH)2
Al2O3
| г
г
ж
г
г
г
г
к
к
к
к
| -20,15
-241,83
-285,84
-92,31
+90,37
+33,50
-46,19
-315,39
-822,10
-986,50
-1669,80
|
Тепловой эффект реакции сгорания этана, согласно следствию из закона Гесса, равен:

Отсюда, стандартная энтальпия образования этана:
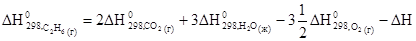
Из таблицы 3 выпишем значения стандартных энтальпий образования  и
и  .
.
 ,
, 
Энтальпии образования простых веществ в их наиболее устойчивых состояниях при стандартных условиях приняты равными нулю, следовательно  .
.
Подставляем табличные данные и производим расчет:

Стандартная энтальпия образования этана в расчете на 1 моль вещества: 
При сгорании 1 моль этана по условию задачи выделяется 1559,87кДж теплоты. Чтобы определить количество теплоты, выделяющейся при сгорании 50 л этана используем следствие из закона Авогадро: один моль газообразных веществ при нормальных условиях занимает объем 22,4 л.
При сгорании 22,4 л С2Н6 выделяется 1559,87 кДж теплоты
При сгорании 50 л С2Н6 выделяется х кДж теплоты

При сгорании 50 л этана С2Н6 выделяется 3481,85 кДж теплоты.
Пример 2. Реакция горения этилового спирта выражается термохимическим уравнением
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж); DН =?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования  равна 42,36 кДж. Укажите, какая это реакция – экзотермическая или эндотермическая.
равна 42,36 кДж. Укажите, какая это реакция – экзотермическая или эндотермическая.
Решение. Для вычисления теплового эффекта реакции DН необходимо определить энтальпию образования  . Запишем термохимическое уравнение фазового перехода этилового спирта из жидкого состояния в газообразное:
. Запишем термохимическое уравнение фазового перехода этилового спирта из жидкого состояния в газообразное:
 =
=  ; DН = 42,36 кДж
; DН = 42,36 кДж
Тепловой эффект фазового перехода:

Стандартная энтальпия образования газообразного этилового спирта
 (табл. 3)
(табл. 3)
Следовательно, стандартная энтальпия образования жидкого этилового спирта

Вычисляем тепловой эффект реакции сгорания этилового спирта:

Стандартные энтальпии образования 
 (табл. 3):
(табл. 3):


 , следовательно
, следовательно

Так как DН< 0, следовательно, реакция горения этилового спирта экзотермическая, сопровождается выделением 1366,87 кДж теплоты.
Пример 3. При растворении 52,06 г ВаCl2 в 400 молях Н2О выделяется 2,16 кДж теплоты, а при растворении одного моля кристаллогидрата ВаCl2×2Н2О в 400 молях Н2О поглощается 18,49 кДж теплоты. Вычислите энтальпию образования кристаллогидрата из безводной соли и воды.
Решение. Процесс растворения безводной соли ВаCl2 состоит из двух стадий:
а) процесса гидратации безводной соли ВаCl2
ВаCl2(к) + 2Н2О(ж) = ВаCl2×2Н2О(к); DН 
DН  – энтальпия образования кристаллогидрата – теплота, выделяемая при взаимодействии 1 моля растворяемого вещества с растворителем – водой.
– энтальпия образования кристаллогидрата – теплота, выделяемая при взаимодействии 1 моля растворяемого вещества с растворителем – водой.
б) процесса растворения образовавшегося кристаллогидрата:
ВаCl2×2Н2О(к) + nН2О(ж) = ВаCl2(р-р) +(n+2)Н2О(р-р); DН 
DН  – энтальпия растворения кристаллогидрата.
– энтальпия растворения кристаллогидрата.
Суммарный процесс выразится уравнением
ВаCl2(к) + (n+2)Н2О(ж) = ВаCl2(р-р) +(n+2)Н2О(р-р); DН,
где DН – тепловой эффект растворения безводной соли – изменение энтальпии при растворении 1 моль соли BaCl2 в растворителе.
Согласно закону Гесса, тепловой эффект растворения безводной соли равен алгебраической сумме тепловых эффектов процесса гидратации и растворения кристаллогидрата:
DН = DН  + DН
+ DН  , откуда DН
, откуда DН  = DН - DН
= DН - DН 
Энтальпия растворения одного моль кристаллогидрата ВаCl2×2Н2О по условию задачи: DН  = 18,49 кДж/моль. Вычислим энтальпию растворения одного моля безводной соли ВаCl2, т.е. для тех же условий, что и для кристаллогидрата, т.к. раствор в обоих случаях должен иметь одинаковую концентрацию.
= 18,49 кДж/моль. Вычислим энтальпию растворения одного моля безводной соли ВаCl2, т.е. для тех же условий, что и для кристаллогидрата, т.к. раствор в обоих случаях должен иметь одинаковую концентрацию.
Молярная масса ВаCl2 равна 208,25 г/моль.
При растворении 52,06 г ВаCl2 выделяется 2,16 кДж теплоты,
а при растворении 208,25 г ВаCl2 выделяется х кДж теплоты;
 следовательно
следовательно
тепловой эффект растворения безводной соли DН= -8,64 кДж/моль.
Энтальпия образования кристаллогидрата ВаCl2×2Н2О равна:
DН  = DН- DН
= DН- DН  = -8,64 – 18,49 = -27,13 кДж/моль.
= -8,64 – 18,49 = -27,13 кДж/моль.
Пример 4. Определите изменение энтропии в стандартных условиях для реакции, протекающей по уравнению.
2С(графит) + 3Н2(г) = С2Н6(г)
Объясните, почему изменяется энтропия системы.
Решение. Энтропия (S) – функция состояния системы, характеризует меру неупорядоченности системы. Она возрастает при нагревании, испарении, плавлении, при переходе от кристаллического к жидкому и газообразному состоянию, а также с усложнением структуры молекул. Энтропия уменьшается в процессах, в результате которых упорядоченность системы возрастает – при охлаждении, конденсации, кристаллизации, уменьшении числа частиц. При протекании химической реакции энтропия системы увеличивается, если объем газообразных продуктов реакции больше, чем исходных веществ, и уменьшается, если он меньше.
Изменение энтропии системы в результате химической реакции равно сумме стандартных энтропий продуктов реакции за вычетом суммы стандартных энтропий исходных веществ с учетом стехиометрических коэффициентов (числа молей участвующих в реакции веществ).
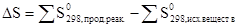
Стандартной энтропией называется энтропия одного моля вещества при стандартных условиях. Значения S 
 некоторых веществ приведены в таблице 4.
некоторых веществ приведены в таблице 4.
Таблица 4.Стандартные энтропии S  некоторых веществ.
некоторых веществ.
| Вещество
| Состояние
| S  Дж/моль×К
Дж/моль×К
| Вещество
| Состояние
| S  Дж/моль×К
Дж/моль×К
|
| C
C
S
C2H2
C2H4
C2H6
CO2
CO
CH4
CH3OH
H2
H2O
H2O
HCl
| Алмаз
Графит
Ромб
г
г
г
г
г
г
ж
г
ж
г
г
| 2,44
5,74
31,90
200,82
219,45
229,50
213,65
197,40
186,19
126,80
130,59
69,94
188,72
186,70
| H2S
N2
NO
NO2
NH3
NH4Cl
O2
Cl2
FeO
Fe3O4
PCl3
PCl5
SO2
Fe
Fe2O3
| г
г
г
г
г
к
г
г
к
к
г
г
г
к
к
| 205,64
191,49
210,20
240,46
192,50
94,56
205,03
222,95
54,00
146,40
311,66
352,71
248,10
27,15
89,96
|
Следует учитывать, что в отличие от энтальпии образования энтропия простого вещества, даже находящегося в кристаллическом состоянии, не равна нулю.
Значения стандартных энтропий веществ, участвующих в химической реакции (табл. 4):
| Вещество
| С(графит)
| Н2(г)
| С2Н6(г)
|
S  Дж/моль×К Дж/моль×К
| 5,74
| 130,59
| 229,50
|
Рассчитаем изменения энтропии при протекании реакции

Так как D S < 0, энтропия уменьшается. Это происходит вследствие уменьшения объема системы за счет уменьшения числа молекул газообразных веществ.
Пример 5. Что имеет большую энтропию: 1 моль кристаллического вещества йода (I2(к)) или 1 моль его паров I2(г) при той же температуре.
Решение. Любому состоянию вещества, взятому при определенных условиях, отвечает большое разнообразие микросостояний. Последние обусловлены тем, что отдельные частицы вещества – ионы, атомы и молекулы в кристаллических структурах твердых веществ, молекулы жидкостей, газов и составляющие их атомы совершают непрерывные колебательные движения, переходя в каждый данный момент из одного микросостояния в другое. В кристалле частицы (атомы, ионы) имеют упорядоченное расположение и могут находиться лишь в некоторых точках пространства, а для газа таких ограничений нет. 1 моль газа имеет гораздо больший объем, чем 1 моль кристалла, возможность хаотического движения молекул газа больше, больше число отдельных, непрерывно меняющихся микросостояний вещества и больше неупорядоченность его общего состояния, мерой которой служит энтропия. Вследствие этого энтропия моля паров вещества больше энтропии моля его кристаллов при одинаковой температуре, что и подтверждают величины стандартных энтропий:


Пример 6. На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса для химической реакции: Fe2O3(к) + 3СО(г) = 2Feк + 3CO2(г)
Укажите возможность ее протекания в стандартных условиях. Объясните изменение энтропии в результате реакции.
Решение. Любая химическая реакция характеризуется двумя энергетическими характеристиками: изменением энтальпии DН и энтропии DS. Для самопроизвольно протекающих реакций характерно стремление к уменьшению энергии за счет теплоотдачи в окружающую среду и одновременно к увеличению степени беспорядка. Эти факторы действуют в противоположных направлениях, поэтому результирующая величина будет равна их разности:
 где
где 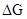 – изменение энергии Гиббса реакции (изобарно-изотермического потенциала).
– изменение энергии Гиббса реакции (изобарно-изотермического потенциала).
Для расчета изменений энергии Гиббса при температуре 298К выпишем из таблиц 3 и 4 значения стандартных энтальпий образования и энтропий веществ:
| Вещество
| Fe2O3(к)
| СО(г)
| Fe(к)
| CO2(г)
|
DН  , кДж/моль , кДж/моль
| -822,10
| -110,52
|
| -393,51
|
S  , Дж/моль×К , Дж/моль×К
| 89,96
| 197,4
| 27,15
| 213,65
|
Тепловой эффект химической реакции согласно следствию из закона Гесса равен:

DН < 0, следовательно, реакция - экзотермическая.
Изменение энтропии в химической реакции:
 =
=
DS>0, следовательно, энтропия увеличивается, причем незначительно. Объем системы в процессе реакции не меняется (3 моль газа СО в исходных веществах и 3 моль газа СО2 в продуктах реакции), но структура молекулы СО2 более сложная по сравнению с молекулой СО. Более сложные молекулы как в качественном, так и в количественном смысле, характеризуются большим числом микросостояний и, следовательно, более высокими значениями энтропии, поэтому энтропия в процессе реакции увеличивается.
Изменение энергии Гиббса в химической реакции:



При расчете  величину изменения энтропии следует умножить на 10-3, т.к. изменение энтальпии
величину изменения энтропии следует умножить на 10-3, т.к. изменение энтальпии 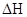 выражается в кДж, а изменение энтропии
выражается в кДж, а изменение энтропии  в Дж/К.
в Дж/К.
Возможность осуществления химической реакции определяется величиной и знаком изменения энергии Гиббса. Самопроизвольно протекают процессы только в том направлении, при котором энергия Гиббса системы уменьшается, и чем более отрицательное значение имеет  , тем сильнее стремление к протеканию реакции.
, тем сильнее стремление к протеканию реакции.
В процессе  <0, следовательно, в стандартных условиях самопроизвольное протекание данной реакции в прямом направлении возможно.
<0, следовательно, в стандартных условиях самопроизвольное протекание данной реакции в прямом направлении возможно.
Пример 7. На основании значений стандартных энергий Гиббса образования веществ, определите прямая или обратная реакция будет протекать при стандартных условиях в системе
СН4(г) + СО2(г) Û 2СО(г) + 2Н2(г)
Решение. Для ответа на вопрос следует вычислить  прямой реакции. Изменение энергии Гиббса
прямой реакции. Изменение энергии Гиббса  в системе в результате химической реакции равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ с учетом числа молей участвующих в реакции веществ
в системе в результате химической реакции равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ с учетом числа молей участвующих в реакции веществ 
Значения стандартных энергий Гиббса образования некоторых веществ приведены в таблице 5.
Таблица 5. Стандартная энергия Гиббса образования  некоторых веществ
некоторых веществ
| Вещество
| Состояние
|  кДж/моль
кДж/моль
| Вещество
| Состояние
|  кДж/моль
кДж/моль
|
| BaCO3
CaCO3
BeCO3
CaO
BaO
| к
к
к
к
к
| -1138,80
-1128,75
-944,75
-604,20
-528,40
| BeO
Fe3O4
CO2
FeO
CO
СН4
| к
к
г
к
г
г
| -581,64
-1014,20
-394,38
-244,30
-137,27
-50,79
|
Значения  наиболее устойчивой модификации простого вещества принимают равной нулю.
наиболее устойчивой модификации простого вещества принимают равной нулю.
Выпишем из табл. 5 значения стандартных энергий Гиббса образования веществ, участвующих в химической реакции:
| Вещество
| СН4(г)
| СО2(г)
| СО(г)
|
 кДж/моль кДж/моль
| -50,79
| -394,38
| -137,27
|

 > 0, что указывает на невозможность самопроизвольного протекания прямой реакции при стандартных условиях, наоборот, при этих условиях возможна обратная реакция.
> 0, что указывает на невозможность самопроизвольного протекания прямой реакции при стандартных условиях, наоборот, при этих условиях возможна обратная реакция.
Пример 7. Восстановление Fe2O3 водородом протекает по уравнению:
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г); DН = 96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии DS = 138,7Дж/К? При какой температуре начнется восстановление Fe2O3?
Решение. Вычислим DG реакции:
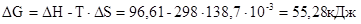
Так как DG > 0, прямая реакция при стандартных условиях невозможна, возможен лишь обратный процесс. Критерием состояния равновесия является равенство нулю энергии Гиббса: DG=0, тогда  . Температура, при которой равновероятны и прямая и обратная реакция:
. Температура, при которой равновероятны и прямая и обратная реакция:  . Следовательно, температура, при которой начнется восстановление Fe2O3 равна:
. Следовательно, температура, при которой начнется восстановление Fe2O3 равна:

ЗАДАНИЯ
81.Напишите термохимическое уравнение реакции восстановления оксида железа (III) металлическим алюминием, вычислив ее тепловой эффект.
82.Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Напишите термохимическое уравнение реакции, вычислив ее тепловой эффект.
83.При получении гидроксида кальция из CaO(к) и Н2О(ж) выделяется 65.06 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите энтальпию образования оксида кальция.
84.При взаимодействии газообразных сероводорода и оксида углерода (IV) образуются пары воды и сероуглерод CS2(г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
85.Напишите термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуются СН4(г) и Н2О(г). Сколько теплоты выделится при этой реакции?
86.При взаимодействии газообразных метана и сероводорода образуются сероуглерод CS2(г) и водород. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
87.Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия?
88.При сгорании ацетилена С2Н2(г) образуется оксид углерода (IV) и пары воды. Напишите термохимическое уравнение реакции, вычислив ее тепловой эффект. Сколько теплоты выделится при сгорании 825 л ацетилена в пересчете на нормальные условия.
89.При сгорании метана СН4(г) образуются пары воды и оксид углерода (IV). Напишите термохимическое уравнение реакции, вычислив ее тепловой эффект. Сколько теплоты выделится при сгорании 1 м3 метана в пересчете на нормальные условия.
90.При сгорании жидкого бензола с образованием паров воды и оксида углерода (IV) выделяется 3135,58 кДж теплоты. Напишите термохимическое уравнение реакции и вычислите энтальпию образования С6Н6(ж).
91.При взаимодействии трех молей оксида азота N2O с аммиаком образуется азот и пары воды. Реакция сопровождается выделением
877,76 кДж теплоты. Напишите термохимическое уравнение реакции и вычислите энтальпию образования N2O(г).
92. При сгорании газообразного аммиака образуются пары воды и оксида азота (II). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект в расчете на 1 моль NН3(г).
93. Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН(ж) +  О2(г) = СО2 (г) + 2Н2О(ж); DН =?
О2(г) = СО2 (г) + 2Н2О(ж); DН =?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования СН3ОН(ж) составляет +37,4 кДж.
94. Напишите термохимическое уравнение реакции горения 1 моль этилового спирта, в результате которой образуются пары воды и оксид углерода (IV). Вычислите энтальпию образования С2Н5ОН(ж), если известно, что при сгорании 11,5 г его выделилось 308,71 кДж теплоты.
95. Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 7  О2(г) = 6СО2 (г) + 3Н2О(г); DН =?
О2(г) = 6СО2 (г) + 3Н2О(г); DН =?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования С6Н6(ж) составляет +33,9кДж.
96. Реакция горения аммиака выражается термохимическим уравнением: 4NH3(г) + 3O2(г) = 2N2(г) + 6Н2О(ж), DН = -1530,28 кДж.
Вычислите энтальпию образования NH3(г).
97.При взаимодействии оксида азота (I) N2O(г) с углеродом образуется азот и оксид углерода (IV). Реакция сопровождается выделением
560 кДж теплоты. Напишите термохимическое уравнение реакции и вычислите энтальпию образования N2O(г).
98. Энтальпия образования кристаллогидрата Na2SO3×7H2O из безводной соли и воды составляет -58,16 кДж/моль. Вычислите тепловой эффект растворения безводной соли Na2SO3 в воде, если при растворении
1 моль кристаллогидрата в 800 мл воды поглощается 46,88 кДж теплоты.
99. При растворении в воде 10 г безводной соли CaCl2 выделилось 6,82 кДж, а при растворении в воде 10 г кристаллогидрата CaCl2×6Н2О поглотилось 0,87 кДж теплоты. Вычислите энтальпию образования кристаллогидрата из безводной соли и воды.
100. При растворении в воде безводной соли SrCl2 выделилось
47,7 кДж, а при растворении кристаллогидрата SrCl2×10Н2О поглотилось 31,0 кДж теплоты. Вычислите энтальпию образования кристаллогидрата из безводной соли и воды.
101. На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции, протекающей по уравнению
С2Н4(г) + 3О2(г) = 2СО2 (г) + 2Н2О(ж).
Возможна ли эта реакция при стандартных условиях? Объясните уменьшение энтропии в результате этой реакции. Экзо- или эндотермической является реакция?
102. Вычислите, при какой температуре начинается реакция восстановления Fe3O4, протекающая по уравнению
Fe3O4(к) + СО(г) = 3FeO(к) + СО2(г); DН = 34,55 кДж.
Экзо- или эндотермической является эта реакция? Объясните увеличение энтропии в результате этой реакции.
103.Вычислите, при какой температуре начинается диссоциация пентахлорида фосфора, протекающая по уравнению
PCl5(г) = PCl3(г) + Cl2(г); DН = 92,59 кДж.
Экзо- или эндотермической является эта реакция? Объясните увеличение энтропии в результате реакции.
104. Вычислите изменение энтропии для реакций, протекающих по уравнениям:
2СН4(г) =С2Н2 (г) + 3Н2(г)
N2(г) + 3Н2(г) = 2NН3 (г)
Сграфит + О2(г) = СО2 (г)
Объясните, почему в этих реакциях DS> 0; < 0;» 0?
105. На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции, протекающей по уравнению
SO2(г) + 2H2(г) = S (ромб.) + 2Н2О(ж).
Возможна ли эта реакция при стандартных условиях? Эндо- или экзотермической является эта реакция? Объясните уменьшение энтропии в результате реакции.
106. На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции, протекающей по уравнению
СО2(г) + 4Н2(г) = СН4 (г) + 2Н2О(ж).
Возможна ли эта реакция при стандартных условиях? Объясните уменьшение энтропии в результате реакции. Эндо- или экзотермической является реакция?
107. На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции образования аммиака из азота и водорода. Возможна ли эта реакция при стандартных условиях? Чем можно объяснить отрицательное значение изменения энтропии в результате реакции? Эндо- или экзотермической является реакция?
108. Какие из карбонатов: ВеСО3, СаСО3 или ВаСО3 – можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив изменение энергии Гиббса для каждой реакции.
109. На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции, протекающей по уравнению СО(г) + 3Н2(г) = СН4 (г) + Н2О(г).
Возможна ли эта реакция при стандартных условиях. Экзо- или эндотермической является реакция? Объясните уменьшение энтропии в результате реакции.
110. Образование сероводорода из простых веществ протекает по уравнению
Н2(г) + S(ромб.) = Н2S(г); DН = -20,15 кДж.
На основании значений стандартных энтропий соответствующих веществ вычислите изменение энтропии и объясните увеличение энтропии в результате реакции. Вычислите изменение энергии Гиббса и укажите, возможна ли эта реакция при стандартных условиях. Экзо- или эндотермической является реакция?
111. На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции, протекающей по уравнению
4НCl(г) + О2(г) Û 2Н2О(г) + 2Cl2(г);
Возможна ли прямая реакция при стандартных условиях? При какой температуре наступит равновесие системы? Экзо- или эндотермической является прямая реакция?
112. Восстановление Fe3O4 оксидом углерода (II) протекает по уравнению
Fe3O4(к) + СО(г) = 3FeO(к) + СО2(г)
На основании стандартных энергий Гиббса образования соответствующих веществ вычислите изменение энергии Гиббса реакции и сделайте вывод о возможности самопроизвольного протекания этой реакции в стандартных условиях. Вычислите изменение энтропии и объясните увеличение энтропии в результате реакции.
113. Реакция горения ацетилена протекает по уравнению
С2Н2(г) +  О2(г) = 2СО2(г) + Н2О(ж)
О2(г) = 2СО2(г) + Н2О(ж)
Исходя из значений стандартных энтальпий образования и стандартных энтропий соответствующих веществ, вычислите изменение энергии Гиббса реакции и укажите возможность ее протекания в стандартных условиях. Объясните уменьшение энтропии в результате реакции. Экзо- или эндотермической является реакция?
114. Уменьшится или увеличится энтропия при переходе: а) воды в пар; б) графита в алмаз? Почему? Вычислите изменение энтропии для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
115. На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции, протекающей по уравнению
Н2(г) + СО2(г) = СО(г) + Н2О(ж)
Возможна ли эта реакция при стандартных условиях? Экзо- или эндотермической является реакция?
116. Прямая или обратная реакция будет протекать при стандартных условиях в системе
2NО(г) + О2(г) Û 2NО2(г).
Ответ мотивируйте, вычислив изменение энергии Гиббса на основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ. Экзо- или эндотермической является прямая реакция? Объясните уменьшение энтропии в результате протекания прямой реакции.
117. Исходя из значений стандартных энтальпий образования и стандартных энтропий соответствующих веществ, вычислите изменение энергии Гиббса реакции, протекающей по уравнению
СН4(г) + 2О2(г) = 2Н2О(ж) + СО2(г).
Может ли эта реакция при стандартных условиях идти самопроизвольно? Экзо- или эндотермической является реакция? Объясните уменьшение энтропии при протекании реакции.
118. Вычислите, при какой температуре наступит равновесие системы
СО(г) + 2Н2(г) Û СН3ОН(ж); DН = -128,05 кДж
Экзо- или эндотермической является прямая реакция? Возможна ли она при стандартных условиях? Объясните уменьшение энтропии в результате протекания прямой реакции.
119. На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции, протекающей по уравнению
4NН3 (г) + 5О2(г) = 4NО(г) + 6Н2О(г)
Возможна ли эта реакция при стандартных условиях? Объясните увеличения энтропии в результате реакции.
120. Реакция взаимодействия метана с оксидом углерода (IV) протекает по уравнению
СН4(г) + СО2(г) = 2СО(г) + 2Н2 (г).
На основании стандартных энтальпий образования и стандартных энтропий соответствующих веществ вычислите изменение энергии Гиббса. Возможна ли эта реакция при стандартных условиях. При какой температуре начнется реакция? Экзо- или эндотермической является данная реакция?



 О2(г) = 2СО2(г) + 3Н2О(ж); DН = -1559,87 кДж
О2(г) = 2СО2(г) + 3Н2О(ж); DН = -1559,87 кДж
 . Для этих же условий рассчитывают и тепловые эффекты реакций DН. Значения DН
. Для этих же условий рассчитывают и тепловые эффекты реакций DН. Значения DН 
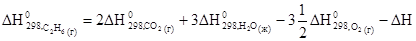
 и
и  .
. ,
, 
 .
.


 равна 42,36 кДж. Укажите, какая это реакция – экзотермическая или эндотермическая.
равна 42,36 кДж. Укажите, какая это реакция – экзотермическая или эндотермическая. . Запишем термохимическое уравнение фазового перехода этилового спирта из жидкого состояния в газообразное:
. Запишем термохимическое уравнение фазового перехода этилового спирта из жидкого состояния в газообразное: ; DН = 42,36 кДж
; DН = 42,36 кДж
 (табл. 3)
(табл. 3)


 (табл. 3):
(табл. 3):

 , следовательно
, следовательно


 следовательно
следовательно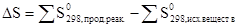
 некоторых веществ приведены в таблице 4.
некоторых веществ приведены в таблице 4.


 где
где 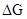 – изменение энергии Гиббса реакции (изобарно-изотермического потенциала).
– изменение энергии Гиббса реакции (изобарно-изотермического потенциала).
 =
=

 величину изменения энтропии следует умножить на 10-3, т.к. изменение энтальпии
величину изменения энтропии следует умножить на 10-3, т.к. изменение энтальпии 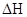 выражается в кДж, а изменение энтропии
выражается в кДж, а изменение энтропии  в Дж/К.
в Дж/К.
 некоторых веществ
некоторых веществ
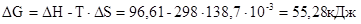
 . Температура, при которой равновероятны и прямая и обратная реакция:
. Температура, при которой равновероятны и прямая и обратная реакция:  . Следовательно, температура, при которой начнется восстановление Fe2O3 равна:
. Следовательно, температура, при которой начнется восстановление Fe2O3 равна:
 О2(г) = СО2 (г) + 2Н2О(ж); DН =?
О2(г) = СО2 (г) + 2Н2О(ж); DН =? О2(г) = 6СО2 (г) + 3Н2О(г); DН =?
О2(г) = 6СО2 (г) + 3Н2О(г); DН =? О2(г) = 2СО2(г) + Н2О(ж)
О2(г) = 2СО2(г) + Н2О(ж)


