

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Интересное:
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
В силу наличия у металлов особого типа связи (металлической) в кристаллической решетке металла существует подвижное равновесие между атомами, ионами, и свободно перемещающимися делокализованными электронами: М Û Мn+ + n 
Если металлическую пластинку погрузить в водный раствор соли того же металла, катионы металла под действием полярных молекул воды гидратируются и переходят в раствор. За счет этого в растворе появляется избыток катионов, а в металле – электронов. Поверхностный слой металла заряжается отрицательно, а граничащий с ним слой раствора положительно. И на границе металл – раствор возникает двойной электрический слой, которому соответствует некоторая разность потенциалов. По мере увеличения заряда металла (избытка электронов) усиливается электростатическое притяжение между катионами в растворе и поверхностью металла и протекает противоположный процесс – ионы металла из раствора принимают от пластины электроны и переходят в нейтральное состояние, образуя атомы металла, которые становятся частью кристаллической решетки. Этот процесс приводит к дефициту электронов и возникновению на пластине положительного заряда. Между металлическим электродом и раствором устанавливается состояние равновесия:
М + mН2О Û [М(Н2О)m]n+ + n 
(в растворе) в кристалле
металла
В зависимости от того, какой из двух рассмотренных процессов преобладает, положением равновесия определяется знак и величина заряда поверхности металла. Чем более активным является металл, тем легче его катионы будут переходить в раствор, тем в большей степени равновесия смещено вправо и тем больше будет отрицательный заряд на поверхности металла. В случае малоактивных металлов может преобладать обратный процесс – переход катионов металла из раствора на его поверхность, равновесие смещено влево, вследствие чего поверхность металла приобретает положительный заряд.
|
|
Таким образом, при контакте металла с раствором его соли эти две соприкасающиеся фазы приобретают противоположные заряды, в результате на поверхности раздела фаз металл – раствор образуется двойной электрический слой и возникает разность потенциалов, характеризующаяся определенным скачком потенциала – электродным потенциалом. Состояние равновесия определяется равновесным электродным потенциалом, величина которого зависит от природы металла, концентрации ионов металла в растворе, температуры. Измерить или вычислить абсолютную величину электродного потенциала невозможно. Определяют относительную величину потенциала как разность электродных потенциалов - электродвижущую силу (ЭДС) гальванического элемента, составленного из исследуемого электрода и электрода сравнения – водородного электрода.
Нормальный (стандартный) водородный электрод представляет собой погруженную в раствор серной кислоты с концентрацией (активностью) ионов водорода 1 моль/л платиновую пластинку, покрытую тонкодисперсной платиной, непрерывно насыщаемую водородом под давлением равным нормальному атмосферному (1,013×105 Па) и температуре 298К (25°С). На поверхности электрода устанавливается равновесие:
2Н+ + 2  Û Н2 и разность потенциалов между электродом и раствором условно принимают равным нулю (j
Û Н2 и разность потенциалов между электродом и раствором условно принимают равным нулю (j  ).
).
Электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (активностью) ионов металла 1 моль/л, измеренный при стандартных условиях по сравнению со стандартным водородным электродом называется стандартным электродным потенциалом металла.
Стандартный потенциал обозначают буквой j° (или Е°) с указанием электрода, который записывают следующим образом: сначала потенциал – определяющие ионы, находящиеся в растворе, а затем материал электрода, например электродный потенциал цинка j  .
.
|
|
Располагая металлы по мере возрастания их стандартных электродных потенциалов получают ряд стандартных электродных потенциалов (табл. 6).
Стандартный электродный потенциал металла количественно характеризует его электрохимическую активность: чем более отрицателен электродный потенциал, тем выше способность металла посылать ионы в раствор, тем сильнее восстановительные свойства металла, тем меньше окислительная способность его ионов.
Каждый металл этого ряда, не разлагающий воду, (после магния) вытесняет (восстанавливает) все следующие за ним металлы из водных растворов их солей.
Все металлы до водорода (с отрицательными значениями электродных потенциалов) восстанавливают водород из разбавленных кислот (за исключением азотной кислоты).
Чем дальше расположены друг от друга в ряду потенциалов два металла, тем большую электродвижущую силу будет иметь составленный из них гальванический элемент (при концентрациях ионов металла 1 моль/л), причем анодом (-) является более активный металл.
Таблица 6. Стандартные электродные потенциалы j0 металлов в водных растворах при Т = 298К
| Электрод | j0, В | Электрод | j0, В |
| Li+/Li Rb+/Rb K+/K Cs+/Cs Ba2+/Ba Ca2+/Ca Na+/Na Mg2+/Mg Be2+/Be Al3+/Al Ti2+/Ti Zr4+/Zr V2+/V Mn2+/Mn Cr2+/Cr Zn2+/Zn Cr3+/Cr Fe2+/Fe | -3,045 -2,925 -2,924 -2,923 -2,900 -2,870 -2,714 -2,370 -1,847 -1,70 -1,630 -1,580 -1,186 -1,180 -0,913 -0,763 -0,740 -0,440 | Cd2+/Cd Co2+/Co Ni2+/Ni Sn2+/Sn Pb2+/Pb Fe3+/Fe 2H +/H2 Sb3+/Sb Bi3+/Bi Cu2+/Cu Cu+/Cu Hg22+/2Hg Ag+/Ag Hg2+/Hg Pd2+/Pd Pt2+/Pt Au3+/Au Au +/Au | -0,403 -0,277 -0,250 -0,136 -0,127 -0,037 0,000 +0,200 +0,215 +0,340 +0,520 +0,790 +0,800 +0,850 +0,987 +1,190 +1,500 +1,700 |
Пример 1. Стандартный электродный потенциал никеля (-0,250 В) больше, чем у кобальта (-0,277 В). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией
0,001 моль/л, а кобальта с концентрацией 0,1 моль/л?
Решение. Электродный потенциал металла (j) зависит от концентрации его ионов в растворе. Строго говоря, величина электродного потенциала зависит от соотношения не концентраций, а активностей ионов металла в растворе.
Активность – это действительная концентрация ионов металла в растворе сильных электролитов. Но при невысоких концентрациях растворов погрешность, вносимая заменой активности на концентрацию, невелика. Поэтому, эту зависимость можно выразить уравнением Нернста в следующем виде:
|
|
 ,
,
где j  – стандартный электродный потенциал, В;
– стандартный электродный потенциал, В;
n – число электронов, принимающих участие в процессе (заряд иона металла);
С – концентрация гидратированных ионов металла в растворе, моль/л.
Вычислим электродные потенциалы этих металлов при данных в условии концентрациях:

Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2. Электродный потенциал оловянного электрода в растворе своей соли составил 90% от величины его стандартного потенциала. Вычислите концентрацию ионов Sn2+ в растворе (моль/л).
Решение. Стандартный электродный потенциал  (см. табл. 6).
(см. табл. 6).
Электродный потенциал оловянного электрода в растворе своей соли будет равен
 .
.
Тогда в соответствии с уравнением Нернста концентрацию ионов Sn2+ рассчитываем по уравнению

 ;
;  моль/л.
моль/л.
Пример 3. Гальванический элемент состоит из висмутового и медного, электродов, опущенных в растворы своих солей с концентрациями ионов C  = 0,001 моль/л, С
= 0,001 моль/л, С  = 0,01 моль/л. Вычислите ЭДС гальванического элемента, составьте схему, напишите электронные уравнения электродных процессов.
= 0,01 моль/л. Вычислите ЭДС гальванического элемента, составьте схему, напишите электронные уравнения электродных процессов.
Решение. Гальванический элемент – устройство для преобразования химической энергии окислительно-восстановительного процесса в электрическую.
Электрод, на котором происходит процесс окисления (анодный процесс), называется анодом. Электрод, на котором происходит процесс восстановления (катодный процесс), называется катодом. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой элемента. Она равна разности электродных потенциалов катода (более положительного электрода) и анода (менее положительного электрода):
Е = jкатода - jанода.
Стандартные электродные потенциалы металлов при концентрации их ионов в растворе 1 моль/л указаны в таблице 6. Так как концентрации ионов в растворах не являются стандартной величиной, определим электродные потенциалы металлов по уравнению Нернста:
|
|

Висмут в данном случае имеет меньший электродный потенциал и является анодом (А), медь имеет больший электродный потенциал и является катодом (К).
Электродвижущая сила данного элемента равна:  .
.

 Запишем электронные уравнения электродных процессов
Запишем электронные уравнения электродных процессов
А: Bi  - 3ē ® Bi3+ 2
- 3ē ® Bi3+ 2
K: Cu2+ + 2ē ® Cu  3
3
т.е. висмут, являясь анодом, растворяется при работе гальванического элемента, а медь осаждается в виде металла на катоде.
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента имеет вид:
2Bi  + 3Cu2+ ® 2Bi3+ + 3 Cu
+ 3Cu2+ ® 2Bi3+ + 3 Cu 
Схема данного гальванического элемента будет следующая:
А(-) Bi / Bi3+ ïï Cu2+/Cu (+) K.
Пример 4. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один цинковый электрод находится в 0,01М растворе, а другой такой же электрод – в 0,001М растворе сульфата цинка.
Решение. Электродные потенциалы равны

Так как электродный потенциал цинка в 0,001М растворе меньше, чем в 0,01М растворе, то схема данного гальванического элемента будет следующая
А(-) Zn/0,001M ZnSO4 ïï 0,01M ZnSO4/Zn (+) K
Запишем электронные уравнения электродных процессов
А: Zn0 - 2ē ® Zn2+
K: Zn2+ + 2ē ® Zn0
Электродвижущая сила элемента
Е = j  - j
- j  = j
= j 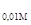 - j
- j  = -0,821 – (-0,850) = 0,029 В.
= -0,821 – (-0,850) = 0,029 В.
ЗАДАНИЯ
241.Составьте схему, напишите электронные уравнения электродных процессов, вычислите ЭДС гальванического элемента, состоящего из пластин цинка и меди, опущенных в растворы своих солей с концентрацией [Zn2+] = [Cu2+] = 0,1 моль/л.
242.Марганцевый электрод в растворе его соли имеет потенциал
j  = – 1,230 В. Вычислите концентрацию ионов Mn2+ в растворе. Составьте схему, напишите электронные уравнения электродных процессов, рассчитайте ЭДС гальванического элемента, состоящего из данного марганцевого электрода и из цинкового электрода, опущенного в раствор его соли с концентрацией [Zn2+] = 1 моль/л.
= – 1,230 В. Вычислите концентрацию ионов Mn2+ в растворе. Составьте схему, напишите электронные уравнения электродных процессов, рассчитайте ЭДС гальванического элемента, состоящего из данного марганцевого электрода и из цинкового электрода, опущенного в раствор его соли с концентрацией [Zn2+] = 1 моль/л.
243.Составьте схему, напишите электронные уравнения электродных процессов, вычислите ЭДС гальванического элемента, состоящего из пластин серебра и хрома, опущенных в растворы своих солей, если потенциал серебряного электрода в растворе AgNO3 составил 95% от величины его стандартного электродного потенциала, а хромовый электрод опущен в раствор Cr(NO3)3 с концентрацией 0,006 моль/л.
244.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один хромовый электрод находится в 0,02М растворе, а другой такой же электрод – в 0,001М растворе сульфата хрома (III).
245.Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Cd + 2AgNO3 ® Cd(NO3)2 + 2Ag.
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если концентрация ионов Cd2+ равна
|
|
0,001 моль/л, а ионов Ag+ равна 0,01моль/л.
246.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 моль/л.
247.Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению: Mg + FeSO4 ® MgSO4 + Fe.
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если концентрация ионов Mg2+ равна
0,05 моль/л, а ионов Fe2+ равна 0,08 моль/л.
248.Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных первый в 0,01М, а второй в 0,1М растворы нитрата серебра (I).
249.Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равна нулю, если [Zn2+] = 0,001 моль/л.
250.Составьте схему гальванического элемента в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 ® Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л,
[Pb2+] = 0,001 моль/л.
251.Хромовый электрод в растворе его соли имеет потенциал jCr3+/Cr = – 0,800 В. Электродный потенциал оловянного электрода в растворе своей соли составил 80% от величины его стандартного электродного потенциала. Составьте схему гальванического элемента, состоящего из хромового и оловянного электродов, опущенных в растворы их солей, напишите электронные уравнения электродных процессов и вычислите ЭДС.
252.Гальванический элемент состоит из никелевого и кадмиевого электродов, опущенных в растворы солей с концентрацией ионов
[Ni2+] = 0,001 моль/л и [Cd2+] = 0,1 моль/л. Вычислите ЭДС гальванического элемента, составьте схему, напишите электронные уравнения электродных процессов.
253.Гальванический элемент состоит из цинкового и железного электродов, опущенных в растворы их солей с концентрацией
[Zn2+] = 0,01 моль/л и [Fe2+] = 0,01 моль/л. Вычислите ЭДС гальванического элемента, составьте схему, напишите электронные уравнения процессов, происходящих на аноде и катоде.
254.Какие процессы происходят на электродах гальванического элемента, образованного железом, погруженным в раствор его соли с концентрацией [Fe2+] = 0,001 моль/л и серебром, погруженным в раствор его соли? Вычислите концентрацию ионов Ag+ в растворе его соли, если ЭДС этого элемента 1,152 В. Составьте схему элемента, напишите электронные уравнения электродных процессов.
255.Составьте схему, напишите электронные уравнения электродных процессов, происходящих при работе гальванического элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей с концентрацией катионов 0,1 моль/л. Вычислите ЭДС этого элемента.
256.Составьте схему, напишите электронные уравнения электродных процессов, вычислите ЭДС гальванического элемента, образованного кадмиевым электродом, погруженным в 0,001М раствор сульфата кадмия, и цинковым электродом, погруженным в 0,002М раствор сульфата цинка.
257.Составьте схему, напишите электронные уравнения процессов, протекающих на электродах магниевого концентрационного гальванического элемента, если у одного из электродов концентрация ионов Mg2+ равна 1 моль/л, а у другого 0,001 моль/л. Вычислите ЭДС этого элемента.
258.Железная и серебряная пластины соединены внешним проводником и опущены в растворы своих солей с концентрацией
[Ag+] = [Fe2+] = 0,001 моль/л. Составьте схему данного гальванического элемента, напишите электронные уравнения процессов, происходящих на аноде и на катоде, вычислите ЭДС.
259.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 0,01 моль/л.
260.Никелевый и кобальтовый электроды опущены в растворы своих солей с концентрацией [Ni2+] = 0,01 моль/л и [Со2+] = 0,001 моль/л. Составьте схему, напишите электронные уравнения электродных процессов, вычислите ЭДС данного гальванического элемента.
|
|
|

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!