

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Под химической связью понимают различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических веществ. По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронами друг с другом. Основные виды химической связи: ковалентная, ионная, металлическая. Для описания ковалентной связи используют два метода – метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
В основе метода ВС лежат следующие положения:
1.В образовании ковалентной связи участвуют только неспаренные электроны двух атомов с противоположно направленными спинами (обменный механизм образования связи), либо электронная пара одного атома

 - донора и свободная орбиталь другого атома – акцептора (донорно-акцепторный механизм).
- донора и свободная орбиталь другого атома – акцептора (донорно-акцепторный механизм).
2.Ковалентная химическая связь между двумя атомами возникает как результат перекрывания атомных орбиталей с образованием электронных пар (обобществление двух электронов).
Согласно теории валентных связей ковалентная связь направлена в сторону максимального перекрывания атомных орбиталей взаимодействующих атомов.
Геометрическая (пространственная) структура молекулы, состоящей из более чем двух атомов, обусловлена взаимным расположением атомных орбиталей, участвующих в образовании химических связей. Молекула АВ2 может иметь линейную  , или угловую структуру (а). Молекула АВ3 может иметь форму правильного треугольника (б), тригональной пирамиды (в). Молекула АВ4 – форму тетраэдра (г).
, или угловую структуру (а). Молекула АВ3 может иметь форму правильного треугольника (б), тригональной пирамиды (в). Молекула АВ4 – форму тетраэдра (г).
а)  б)
б)  в)
в)  г)
г) 
Пространственная структура молекулы определяется видом гибридизации валентных орбиталей центрального атома и числом неподеленных электронных пар, содержащихся в валентном электронном слое.
|
|
Пример 1. Опишите с позиций метода валентных связей строение молекул: а) РН3, б) BBr3. Какие атомные орбитали участвуют в образовании химических связей? Укажите тип гибридизации (если гибридизация имеет место). Какова пространственная структура этих молекул?
Решение. а) Образование молекулы РН3.
Напишем электронные формулы атомов, образующих молекулу PH3, в основном (нормальном) состоянии: 15Р 1s22s22p63s23p3; 1Н 1s1
Электронно-графические формулы внешнего уровня этих атомов:

 p s
p s

 s 1H 1
s 1H 1
15Р 3
В данной молекуле центральным атомом является атом фосфора, у которого в образовании трех химических связей участвуют только p – орбитали, расположенные на одном подуровне и обладающие одинаковой формой и одинаковой энергией. Следовательно, в молекуле РН3 гибридизация отсутствует.
Для наглядного изображения валентных схем можно использовать следующий способ. Электроны, находящиеся на внешнем электронном слое, обозначают точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек. Применяя эти обозначения, образование молекулы РН3 можно представить так:
 H
H
ê
Эту схему можно записать иначе: Н – Р – Н, где каждая пара электронов, связывающая два атома, соответствует одной черточке, изображающей ковалентную связь в структурных формулах.
р – электронные облака атома фосфора ориентированы во взаимноперпендикулярных направлениях (вдоль осей координат) –рх, ру, рz и имеют гантелевидную форму. У атома водорода в образовании химической связи Р-Н участвует s-электрон, имеющий сферическую форму облака. При образовании молекулы РН3 происходит перекрывание р - электронных облаков атома фосфора с s-электронными облаками трех атомов водорода:
|
|
 |
В соответствии с требованиями метода валентных связей три связи
Р - Н должны располагаться под углами, близкими к 90°С. Следовательно, пространственное расположение одинарных связей определяет геометрическую структуру молекулы. Молекула РН3 должна иметь форму тригональной пирамиды:

В вершине пирамиды находится атом фосфора, а в вершинах основания атомы водорода.
б) Образование молекулы ВВr3. В молекуле ВВr3 центральным атомом является атом бора.
Электронные формулы атомов:
5В 1s22s22p1 35Br 1s22s22p63s23p63d104s24p5
Электронно-графические формулы внешнего уровня имеют вид:
p p






 s s
s s

 5B 2
5B 2 

 35Br 4
35Br 4
 | |||||
 |  |
Поскольку бор в соединении трехвалентен, запишем электронно-графическую формулу атома бора в возбужденном состоянии:

 р
р
 s
s
5B* 2
В образовании трех химических связей в молекуле ВВr3 участвуют одна s- и две р-орбитали, расположенные на разных подуровнях и обладающие разной формой и разной энергией:

В этом случае вместо исходных одной s- и двух p-орбиталей возбужденного атома бора образуется три равноценные гибридные орбитали (sp2 – гибридизация). При sp2 гибридизации гибридные электронные облака располагаются в направлениях, лежащих в одной плоскости и ориентированных под углами 120° друг к другу:
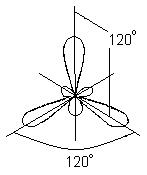
Этому типу гибридизации соответствует образование плоской треугольной молекулы. При образовании молекулы ВВr3 происходит перекрывание трех гибридных орбиталей атома бора с р - электронными орбиталями трех атомов брома:
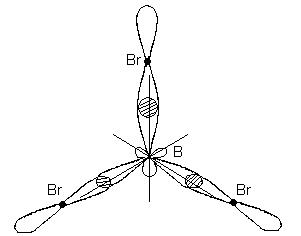
Молекула ВВr3 имеет форму плоского правильного треугольника, в центре которого расположен атом бора, а в вершинах – атомы брома. Все три связи В-Br в молекуле ВВr3 равноценны.
Пример 2. Нарисуйте энергетические схемы образования молекулы F2 и молекулярного иона F2+ по методу молекулярных орбиталей. Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этих частицах? Укажите их магнитную характеристику (парамагнетизм или диамагнетизм).
Решение. Согласно теории молекулярных орбиталей (ММО) молекула рассматривается как совокупность положительно заряженных ядер и отрицательно заряженных электронов, где каждый электрон движется в поле остальных электронов и всех ядер.
|
|
Описать молекулу согласно теории ММО – это значит определить тип ее орбиталей, их энергии и выяснить характер распределения электронов по орбиталям.
При образовании молекулы возникают молекулярные орбитали двух видов – связывающие и разрыхляющие. Если при образовании молекулы из атомов переход электрона на молекулярную орбиталь будет сопровождаться уменьшением энергии, то такая молекулярная орбиталь является связывающей. Если переход электрона на молекулярную орбиталь сопровождается увеличением энергии, то такая молекулярная орбиталь будет разрыхляющей.
Электроны в молекулах располагаются на s- и p- молекулярных орбиталях. s-орбитали могут быть образованы перекрыванием s – атомных орбиталей и перекрыванием 2рх- атомных орбиталей. При этом образуются молекулярные орбитали: s-связывающие (sсв) и s-разрыхляющие (sразр). При перекрывании 2ру и 2рz атомных орбиталей образуются молекулярные орбитали: pсв2Ру, pсв2Рz и pраз2Ру, pраз2Рz. Порядок размещения электронов по молекулярным орбиталям тот же, что и в случае атомных орбиталей, то есть соответствует принципу наименьшей энергии, принципу Паули, правилу Хунда.
|
|
|

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!