(Контрольная точка 1)
Паспорт оценочных средств контрольной точки № 1
В результате оценки осуществляется проверка следующих объектов:
Таблица 2[1]
| Объекты оценивания
| Показатели
| Критерии
| Тип задания[2]
| Форма аттестации
|
| знать:
Основные законы и понятия химии: периодический закон Д.И. Менделеева, закон постоянства состава веществ, закон сохранения массы веществ, принцип
Ле Шателье, определение электролитической диссоциации, электролиза, гидролиза, химические свойства металлов: натрия, кальция, алюминия; неметаллов: углерода, кислорода, хлора.
уметь:
Писать уравнения реакций в молекулярном и ионном виде; составлять схемы гидролиза солей, электролиза
Решать задачи: по формулам
- Определение массовой доли элементов в составе вещества
-Расчет относительной плотности газа
-Определение количества вещества по занимаемому объему
по уравнениям реакций:
-Вычисление теплового эффекта по известной массе (количеству вещества) исходного вещества и количеству теплоты, выделившейся при реакции
-Вычисление массы продукта реакции по уравнению, если известны массы исходных веществ, одно из которых взято в избытке
|
Изложение содержания основных законов и понятий химии
Составление уравнений реакций в молекулярном и ионном виде.
Составление схем гидролиза солей и электролиза
Решение задач по формулам и уравнениям реакций
|
Даны правильные формулировки основных законов и понятий химии в соответствии с эталоном
Правильные записи уравнений реакций в молекулярном и ионном виде в соответствии с эталоном
правильное составление схем гидролиза солей и электролиза в соответствии с эталоном
Правильное решение задач в соответствии с эталоном
| \
Теоретическое и практические задания
|
Контрольная работа
|
Форма текущего контроля и процедура оценивания
Согласно технологической карты дисциплины Химия первая контрольная точка по текущему контролю проводится в форме контрольной работы продолжительностью 1 час 20 минут. Контрольная работа по общей и неорганической химии предназначена для проверки степени усвоения студентами изученного материала по данному разделу дисциплины. Шесть вариантов контрольной работы содержат по 4 задания, одно из них теоретическое, 3 задания практические. Дополнительно студентам предложены задачи повышенной сложности. Решение этих задач показывает высокий уровень знаний и умений студентов решать задачи, но не влияет на рейтинг оценки.
3. Система и критерии оценок результатов текущей аттестации
| Система оценок
| Описание оценок
|
| Отлично (5)
| теоретическое содержание раздела дисциплины освоено полностью, без пробелов, необходимые практические навыки работы с освоенным материалом в основном сформированы, все предусмотренные программой обучения учебные задания выполнены, качество выполнения большинства из них оценено на отлично
|
| Хорошо (4)
| теоретическое содержание раздела дисциплины освоено полностью, без пробелов, некоторые практические навыки работы с освоенным материалом сформированы недостаточно, все предусмотренные
программой обучения учебные задания выполнены, качество выполнения ни одного из них не оценено на отлично, некоторые виды заданий выполнены с ошибками.
|
| Удовлетворительно (3)
| теоретическое содержание раздела дисциплины освоено частично, но пробелы не носят существенного характера, необходимые практические навыки работы с освоенным материалом в основном сформированы, большинство предусмотренных программой обучения учебных заданий выполнено, некоторые из выполненных заданий, содержат ошибки.
|
| Неудовлетворительно (2)
| теоретическое содержание раздела дисциплины освоено частично, необходимые практические навыки работы не сформированы, большинство предусмотренных программой обучения учебных заданий не выполнено, либо качество их выполнения оценено на неудовлетворительно. При дополнительной самостоятельной работе над материалом курса возможно повышение качества выполнения учебных заданий.
|
Пакет заданий
Вариант № 1
1. Современная формулировка периодического закона.
2. Химические свойства натрия. Написать уравнения реакций.
3. Написать уравнения реакций по генетической схеме в молекулярном и ионном виде:
S → SO2 → SO3 → H2SO4 → CaSO4
4. При взаимодействии кальция с избытком раствора серной кислоты
выделилось 2,24 л водорода. Вычислите массы растворившегося кальция и образовавшейся соли.
Вариант № 2
1. Закон постоянства состава. Закон сохранения массы веществ.
2. Химические свойства кальция. Написать уравнения реакций.
3. Составить схему электролиза раствора хлорида меди.
4. При взаимодействии 1,12 г жженой извести (CaO) с водой выделилось 13,06 кДж теплоты. Вычислите тепловой эффект реакции и составьте термохимическое уравнение реакции.
Вариант № 3
1. Определение химического равновесия. Принцип Ле Шателье.
2. Химические свойства алюминия. Написать уравнения реакций.
3. Составить схему электролиза раствора хлорида кальция.
4. Вычислить массовую долю меди и кислорода в оксиде меди.
Вариант № 4
1. Определение электролитической диссоциации.
2. Химические свойства хлора. Написать уравнения реакций.
3. Составить уравнения реакций по генетической схеме в молекулярном и ионном виде:
Ca → CaO → Ca (OH) 2 → CaCl2
4. Рассчитать относительную плотность водорода по азоту.
Вариант № 5
1. Определение электролиза.
2. Химические свойства кислорода. Написать уравнения реакций.
3. Составить схему гидролиза хлорида меди.
4. Определить количество вещества азота, занимающего объем 11,2 л при нормальных условиях.
Вариант № 6
1. Определение гидролиза соли.
2. Химические свойства азота. Написать уравнения реакций.
3. Составить уравнения реакций по генетической схеме в молекулярном и ионном виде: Cl2→HCl→NaCl→AgCl
4. Относительная плотность кислорода по воздуху равна 1,103. Рассчитайте молярную массу воздуха.
Задачи повышенной сложности
Задача 1
При растворении в серной кислоте загрязненного магния массой 6г был получен водород объемом 4,48л при нормальных условиях. Определите массовую долю ω примесей (%)
Задача 2
На 5,6г оксида кальция подействовали 200 граммами 10% раствора серной
кислоты. Найдите массу сульфата кальция.
Условия выполнения задания
1. Контрольная работа выполняется студентами в аудитории по химии на учебном занятии
2. Время выполнения 1 час 20 минут
3. Оборудование: периодическая система химических элементов Д.И. Менделеева, таблица растворимостей гидроксидов и солей в воде, таблица электрохимического ряда напряжений металлов
Эталон ответов
Вариант №1
1. Свойства элементов и их соединений находятся в периодической зависимости от величины заряда ядра атома.
2. -Взаимодействие натрия с неметаллами
2Na+Cl2→2NaCl
-Взаимодействие со сложными веществами
а) с водой
2Na+2H2O→2NaOH+H2
б) взаимодействие с кислотой
2Na+2HCl→2NaCl+H2
3. S→SO2→SO3→H2SO4→CaSO4
S+O2→SO2
2SO2+O2→2SO3
SO3+H2O→H2SO4
SO3+H2O 2H1++SO42-
H2SO4+CaO→CaSO4+H2O
2H1++SO42-+CaO→CaSO4+H2O
4. Дано:
V(H2)-2,24л Решение
H2SO4-избыток x y 2,24л
Сa+H2SO4→CaSO4+H2
m(Ca)-? 1моль 1моль 1моль 1моль
m(CaSO4)-? Y(H2) = 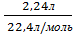 = 0,1 моль
= 0,1 моль
Y(Ca) = Y(H2) = 0,1 моль
Y(CaSO4) = Y(H2) = 0,1 моль
М(Ca) = 40г/моль
М(CaSO4) = 40+32+64 = 136 г/моль
m(Ca) = 40г/моль * 0,1 моль = 4г
m(CaSO4) = 136г/моль * 0,1 моль = 13,6г
Ответ: m(Ca) – 4г; m(CaSO4) – 13,6г
Вариант № 2
1. -Всякое чистое вещество независимо от способов его получения имеет постоянный качественный и количественный состав.
-Масса веществ, вступивших в реакцию равна массе веществ, образующихся в результате реакции
2. -Взаимодействие кальция с неметаллами.
Ca + Cl2 → Ca Cl2
2Ca + O2→2CaO
-Взаимодействие кальция со сложными веществами
а) с водой
Ca + 2H2O → Ca(OH)2 + H2 
б) с кислотой
Ca + 2HCl → Ca Cl2 + H2 
3. CuCl2 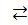 Сu2 + 2 Cl1-
Сu2 + 2 Cl1-
H2 O ⇄ H1+ + OH1-
K(-) Cu2+ + 2ē → Cu0 (восстановление)
А(+) Cl1- - 1ē → Cl0 (окисление)
2 Cl0 → Cl2 ↑
4. Дано: Решение:
1,12г 13,06КДж
m(CaO) – 1,12г CaO + H2 O → Ca (OH)2
Q1 – 13,06 КДж 1моль 1моль 1моль
Q -? M(Cao) = 40 + 16 = 56 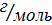
(CaO) = 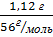 =0,02 моль
=0,02 моль
0,02 моль CaO ─ 13,06 кДж
1моль CaO ─ Q
Q = 653 кДж
Ответ: CaO + H2 O → Ca (OH)2 + 653 кДж
Вариант № 3
1. Химическое равновесие – это состояние системы, при котором скорости прямой и обратной реакции равны. Если на систему, находящуюся в равновесии оказывают внешнее воздействие (изменение концентрации веществ, температуры, давления), то в системе возникает процесс, ослабляющий этот процесс.
2. -Взаимодействие алюминия с простыми веществами.
2Al + 3Cl2 → 2 AlCl3
4Al +3O2 → 2Al2 O3
-Взаимодействие алюминия со сложными веществами.
а) с водой
2Al + 6 H2 O → 2 Al (OH)3 ↓ + 3H2
б) с кислотой
2Al + 6HCl → 2 Al Cl3 + 3H2 ↑
В) с солью
Al + Fe Cl3 → AlCl3 + Fe
3. Ca Cl2 ⇄ Ca2+ + 2 Cl1-
H2 O ⇄ H1+ + OH1-
K(-) H1+ + 1ē → H0 (восстановление)
2H0 → H2 ↑
A(+) Cl1- ─ 1ē → Cl0 (окисление)
2Сl0 → Cl2 ↑
4.Дано: Решение:
CuO M (CuO)= 64+16=80 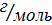
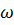 (Cu) -?
(Cu) -? 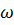 (Cu) =
(Cu) =  * 100% = 80%
* 100% = 80%
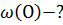
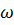 (О2) =
(О2) =  * 100% = 20%
* 100% = 20%
Ответ: 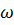 (Cu) - 80%,
(Cu) - 80%, 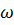 (О2) -20%
(О2) -20%
Вариант №4
1. Электролитическая диссоциация – это распад электролита на ионы в растворах или расплавах.
2. -Взаимодействие хлора с простыми веществами.
а) с неметаллами
Cl2 +H2 → 2HCl
б) с металлами
Ca + Cl2 → CaCl2
-Взаимодействие со сложными веществами
а) с водой
Cl2 +H2 O → HCl + HClO
3. Ca → CaO → Ca (OH)2 → CaCl2
1) 2 Ca + O2 → 2 CaO
2) CaO + H2 O → Ca (OH)2
CaO + H2 O → Ca2+ + 2OH1-
3) Ca (OH)2 + 2HCl → Ca Cl2 + 2H2O
Ca2+ + 2 OH1- + 2 H1+ + 2Cl1- ⇄ Ca2+ + 2 Cl1- + 2H2 O
2H1+ + 2 OH1- ⇄ 2 H2 O
4.Дано: Решение:
H 2,N2 D (N2) = 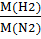
D(N2) -? M(H2) = 2 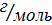
M (N2) = 28 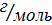
D (N2) =  = 0,07
= 0,07
Ответ: D(N2) – 0,07
Вариант №5
1. Электролиз - это окислительно - восстановительные реакции, протекающие на электродах при прохождении электрического тока через раствор или расплав электролита.
2. -Взаимодействие кислорода с простыми веществами
а) с неметаллами
2H2 + O2 → 2H2 O
S + O2 → SO2
б) с металлами.
2Ca + O2 → 2CaO
- Со сложными веществами
а) с оксидом серы (IV)
2SO2 + O2 → 2SO3
3.
Cu Cl 2 (Cu (OH)2, HCL)
Слабое основание сильная кислота
Cu Cl2 ⇄ Cu2+ + 2Cl1-
H2 O ⇄ H1+ + OH1-
Cu2+ + 2 Cl1- + H1+ OH1- ⇄ CuOH1+ +2 Cl1- + H1+ (кислая среда)
Cu2+ + H1+ + OH1-⇄ CuOH1+ + H1+
CuCl2 + H2 O ⇄ CuOHCl + HCL
4.Дано: Решение:
V (N2) – 11,2л V m =  ; V m = 22,4
; V m = 22,4 
𝒱(N2) -? 𝒱(N2)= 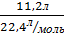 = 0,5 моль
= 0,5 моль
Ответ: 𝒱 (N2)- 0,5 моль
Вариант№6
1. Гидролиз соли – реакция обмена между солями и водой, ведущая к образованию слабого электролита.
2. -Взаимодействие углерода с простыми веществами
а) с неметаллами
C+O2 → CO2
C+2H2 → CH4
б) с металлами
4Al + 3C → Al4 C3
-Взаимодействие со сложными веществами
2Fe2 O3 + 3C → 4 Fe + 3CO2
1 2 3
3. Cl2 → HCl → Na Cl → Ag Cl
1.) Cl2 +H2 → 2HCl
Cl2 + H 2 ⇄ 2 H1+ + 2 Cl1-
2.) HCl + Na OH → NaCl+ H2 O
H1+ +Cl1- + Na1+ + OH1- ⇄ Na1+ + Cl1- + H2 O
H1+ + OH1- ⇄ H2 O
3) Na Cl + AgNO3 → Na NO3 + AgCl ↓
Na1+ + Cl1- + Ag1+ + NO31 ⇄ Na1+ + NO31- + Ag Cl↓
Ag1+ + Cl1- ⇄ Ag Cl 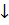
4. Дано Решение
Д (возд) = 1,103 Д (возд) = 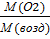 ;
;
М(возд) -? М (возд) = 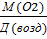 = =
= =  29
29 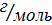
Ответ М(возд) = 29 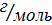
Задачи повышенной сложности
Задача 1
Дано
m (Mg+примеси) – 6г
V (Н2) – 4,48л
ω(примеси) -?
Решение
1.Напишем уравнение реакции. Над уравнением запишем имеющиеся данные, под уравнением – число молей
4,48л
Mg + H2SO4 = MgSO4 + H2
1 моль 1 моль
2.Находим по периодической системе молярную массу магния
M(Mg)=24г/моль
Молярный объем газа Vm=22,4л/моль
3.Определяем количество вещества водорода, которое содержится в 4,48л водорода по формуле
Y = 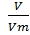 Y(Н2) =
Y(Н2) = 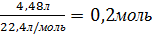
4. Находим количество вещества магния, необходимого по уравнению реакции.
Составляем пропорцию
1моль Mg – 1моль Н2
X моль Mg – 0,2 моль Н2
x = 0,2 моль
5.Находим массу магния по формуле
m = M * Y
где M – молярная масса
Y – количество вещества
m (Mg) = 24г/моль * 0,2 моль = 4,8г
6.Находим массу примесей
m (примеси) = 6г – 4,8г = 1,2г
7.Находим массовую долю примесей по формуле
ω = 
ω (примеси) = 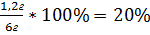
Ответ: ω (примеси) = 20%
Задача 2
Дано
m (СаО) – 5,6г
m (раствор 10% Н2SО4) – 200г
m(СаSО4) -?
Решение
1.Напишем уравнение реакции. Над уравнением запишем имеющиеся данные, под уравнением – число молей
5,6г
СаО + Н2SО4 = СаSО4 + Н2О
1 моль 1моль 1 моль
2.Находим молярные массы оксида кальция, серной кислоты, сульфата кальция
M(CаО) = 40 + 16 =56 г/моль
M(Н2SO4) = 1 * 2 + 32 + 16 * 4 = 98г/моль
М(СаSО4) = 40 + 32 + 64 = 136г/моль
3.Находим массу серной кислоты, которая содержится в 200г раствора
m(Н2SО4) = 200г * 0,1 = 20г
4.Находим количество вещества оксида кальция и серной кислоты
Y(СаО) = 
Y(Н2SО4) = 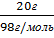 = 0,2моль
= 0,2моль
5.Находим какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке
0,1моль СаО – х моль Н2SО4
1 моль СаО – 1 моль Н2SО4
х = 0,1 моль Следовательно, СаО дан в недостатке, расчет ведем по нему
6.Находим количество вещества сульфата кальция
0,1 моль СаО – х моль СаSО4
1 моль СаО – 1 моль СаSО4
х = 0,1 моль
7.Находим массу сульфата кальция
m (СаSО4) = 136г/моль * 0,1 моль = 13,6г
Ответ: m(СаSО4) = 13,6г



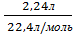 = 0,1 моль
= 0,1 моль
 Сu2 + 2 Cl1-
Сu2 + 2 Cl1-
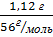 =0,02 моль
=0,02 моль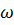 (Cu) -?
(Cu) -?  * 100% = 80%
* 100% = 80%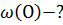
 * 100% = 20%
* 100% = 20%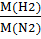
 = 0,07
= 0,07 ; V m = 22,4
; V m = 22,4 
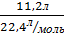 = 0,5 моль
= 0,5 моль
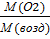 ;
;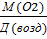 = =
= =  29
29 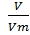 Y(Н2) =
Y(Н2) = 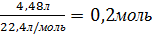

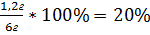

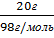 = 0,2моль
= 0,2моль


