МИНИСТЕРСТВО ОБРАЗОВАНИЯ ОМСКОЙ ОБЛАСТИ
бюджетное образовательное учреждение Омской области
«Омский автотранспортный колледж»
ФОНД
ОЦЕНОЧНЫХ СРЕДСТВ
ПО УЧЕБНОЙ ДИСЦИПЛИНЕ
ОБД. 06 Химия
основной профессиональной образовательной программы (ОПОП) по специальности СПО
190631.51 Техническое обслуживание и ремонт автомобильного транспорта
ОМСК, 2012
I. Общие положения
В результате освоения дисциплины обучающийся должен уметь:
- Применять изученные теоретические положения при рассмотрении классов неорганических и органических соединений.
- Уметь решать задачи и выполнять упражнения, лабораторные и практические задания.
- Оказывать первую помощь при химических отравлениях.
- Уметь связывать свойства веществ с их применением, раскрывать сущность глобальных проблем человека и объяснять роль химии в их решении.
В результате освоения дисциплины обучающийся должен знать:
- Основные теоретические положения по химии как одной из важнейших естественных наук.
- Классификацию, состав, номенклатуру и характерные свойства основных классов неорганических и органических соединений.
- Взаимосвязь между простыми веществами и их соединениями. Генетическую связь между основными классами неорганических и органических соединений.
- Промышленное и лабораторное получение неорганических и органических соединений, их применение; меры по охране окружающей среды.
- Роль химии в решении глобальных проблем человечества и воздействие химических соединений на организм человека и окружающую среду.
Результатом освоения программы является также освоение студентами общих компетенций и их компонентов, составных частей
Таблица 1
| Код и название компетенций
| Раздел, тема
| Компоненты, составные части ОК и ПК
| Уровень освоения
|
| ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), результат выполнения заданий.
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации.
ОК 9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
ОК 10. Исполнять воинскую обязанность, в том числе с применением полученных профессиональных знаний (для юношей).
| 1.5, 1.6, 1.7, 2.1, 2.4, 2.11
1.1, 1.2, 1.4, 1.5, 1.6, 1.8, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 2.10
1.6, 1.7, 2.5, 2.7, 2.9
1.1, 1.2, 1.5, 1.6, 1.7, 2.2, 2.3, 2.4, 2.8, 2.9, 2.10, 2.11
1.2, 1.5, 1.6, 1.7, 2.2, 2.3, 2.4, 2.8, 2.9, 2.10, 2.11
1.6, 1.7, 2.5, 2.7, 2.9
1.8, 2.11
1.2, 2.9
1.8, 2.10
1.1 – 2.11
| Понимать сущность процессов и их значимость в профессиональной деятельности и жизни
Организовывать собственную деятельность, уметь решать типовые задачи, упражнения, выбирать способы их выполнения, оценивать их качества
Умение ориентироваться в нестандартных ситуациях
Умение работать с литературой, осуществлять поиск информации
Использовать ИКТ
Умение работать в группе
Брать на себя ответственность за результаты выполнения задания
Самостоятельное осуществление элементов исследовательской деятельности
Готовность к осуществлению деятельности в измененных условиях
Умение подчиняться требованиям преподавателя и выполнять его рекомендации
| 1,2
1,2
1,2
1,2
1,2
1,2
1,2,3
1,2
1,2
1,2
|
II. Комплекты измерительных материалов
Комплект измерительных материалов текущего контроля
(Контрольная точка 1)
Пакет заданий
Вариант № 1
1. Современная формулировка периодического закона.
2. Химические свойства натрия. Написать уравнения реакций.
3. Написать уравнения реакций по генетической схеме в молекулярном и ионном виде:
S → SO2 → SO3 → H2SO4 → CaSO4
4. При взаимодействии кальция с избытком раствора серной кислоты
выделилось 2,24 л водорода. Вычислите массы растворившегося кальция и образовавшейся соли.
Вариант № 2
1. Закон постоянства состава. Закон сохранения массы веществ.
2. Химические свойства кальция. Написать уравнения реакций.
3. Составить схему электролиза раствора хлорида меди.
4. При взаимодействии 1,12 г жженой извести (CaO) с водой выделилось 13,06 кДж теплоты. Вычислите тепловой эффект реакции и составьте термохимическое уравнение реакции.
Вариант № 3
1. Определение химического равновесия. Принцип Ле Шателье.
2. Химические свойства алюминия. Написать уравнения реакций.
3. Составить схему электролиза раствора хлорида кальция.
4. Вычислить массовую долю меди и кислорода в оксиде меди.
Вариант № 4
1. Определение электролитической диссоциации.
2. Химические свойства хлора. Написать уравнения реакций.
3. Составить уравнения реакций по генетической схеме в молекулярном и ионном виде:
Ca → CaO → Ca (OH) 2 → CaCl2
4. Рассчитать относительную плотность водорода по азоту.
Вариант № 5
1. Определение электролиза.
2. Химические свойства кислорода. Написать уравнения реакций.
3. Составить схему гидролиза хлорида меди.
4. Определить количество вещества азота, занимающего объем 11,2 л при нормальных условиях.
Вариант № 6
1. Определение гидролиза соли.
2. Химические свойства азота. Написать уравнения реакций.
3. Составить уравнения реакций по генетической схеме в молекулярном и ионном виде: Cl2→HCl→NaCl→AgCl
4. Относительная плотность кислорода по воздуху равна 1,103. Рассчитайте молярную массу воздуха.
Задачи повышенной сложности
Задача 1
При растворении в серной кислоте загрязненного магния массой 6г был получен водород объемом 4,48л при нормальных условиях. Определите массовую долю ω примесей (%)
Задача 2
На 5,6г оксида кальция подействовали 200 граммами 10% раствора серной
кислоты. Найдите массу сульфата кальция.
Условия выполнения задания
1. Контрольная работа выполняется студентами в аудитории по химии на учебном занятии
2. Время выполнения 1 час 20 минут
3. Оборудование: периодическая система химических элементов Д.И. Менделеева, таблица растворимостей гидроксидов и солей в воде, таблица электрохимического ряда напряжений металлов
Эталон ответов
Вариант №1
1. Свойства элементов и их соединений находятся в периодической зависимости от величины заряда ядра атома.
2. -Взаимодействие натрия с неметаллами
2Na+Cl2→2NaCl
-Взаимодействие со сложными веществами
а) с водой
2Na+2H2O→2NaOH+H2
б) взаимодействие с кислотой
2Na+2HCl→2NaCl+H2
3. S→SO2→SO3→H2SO4→CaSO4
S+O2→SO2
2SO2+O2→2SO3
SO3+H2O→H2SO4
SO3+H2O 2H1++SO42-
H2SO4+CaO→CaSO4+H2O
2H1++SO42-+CaO→CaSO4+H2O
4. Дано:
V(H2)-2,24л Решение
H2SO4-избыток x y 2,24л
Сa+H2SO4→CaSO4+H2
m(Ca)-? 1моль 1моль 1моль 1моль
m(CaSO4)-? Y(H2) = 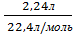 = 0,1 моль
= 0,1 моль
Y(Ca) = Y(H2) = 0,1 моль
Y(CaSO4) = Y(H2) = 0,1 моль
М(Ca) = 40г/моль
М(CaSO4) = 40+32+64 = 136 г/моль
m(Ca) = 40г/моль * 0,1 моль = 4г
m(CaSO4) = 136г/моль * 0,1 моль = 13,6г
Ответ: m(Ca) – 4г; m(CaSO4) – 13,6г
Вариант № 2
1. -Всякое чистое вещество независимо от способов его получения имеет постоянный качественный и количественный состав.
-Масса веществ, вступивших в реакцию равна массе веществ, образующихся в результате реакции
2. -Взаимодействие кальция с неметаллами.
Ca + Cl2 → Ca Cl2
2Ca + O2→2CaO
-Взаимодействие кальция со сложными веществами
а) с водой
Ca + 2H2O → Ca(OH)2 + H2 
б) с кислотой
Ca + 2HCl → Ca Cl2 + H2 
3. CuCl2 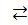 Сu2 + 2 Cl1-
Сu2 + 2 Cl1-
H2 O ⇄ H1+ + OH1-
K(-) Cu2+ + 2ē → Cu0 (восстановление)
А(+) Cl1- - 1ē → Cl0 (окисление)
2 Cl0 → Cl2 ↑
4. Дано: Решение:
1,12г 13,06КДж
m(CaO) – 1,12г CaO + H2 O → Ca (OH)2
Q1 – 13,06 КДж 1моль 1моль 1моль
Q -? M(Cao) = 40 + 16 = 56 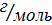
(CaO) = 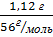 =0,02 моль
=0,02 моль
0,02 моль CaO ─ 13,06 кДж
1моль CaO ─ Q
Q = 653 кДж
Ответ: CaO + H2 O → Ca (OH)2 + 653 кДж
Вариант № 3
1. Химическое равновесие – это состояние системы, при котором скорости прямой и обратной реакции равны. Если на систему, находящуюся в равновесии оказывают внешнее воздействие (изменение концентрации веществ, температуры, давления), то в системе возникает процесс, ослабляющий этот процесс.
2. -Взаимодействие алюминия с простыми веществами.
2Al + 3Cl2 → 2 AlCl3
4Al +3O2 → 2Al2 O3
-Взаимодействие алюминия со сложными веществами.
а) с водой
2Al + 6 H2 O → 2 Al (OH)3 ↓ + 3H2
б) с кислотой
2Al + 6HCl → 2 Al Cl3 + 3H2 ↑
В) с солью
Al + Fe Cl3 → AlCl3 + Fe
3. Ca Cl2 ⇄ Ca2+ + 2 Cl1-
H2 O ⇄ H1+ + OH1-
K(-) H1+ + 1ē → H0 (восстановление)
2H0 → H2 ↑
A(+) Cl1- ─ 1ē → Cl0 (окисление)
2Сl0 → Cl2 ↑
4.Дано: Решение:
CuO M (CuO)= 64+16=80 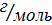
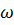 (Cu) -?
(Cu) -? 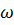 (Cu) =
(Cu) =  * 100% = 80%
* 100% = 80%
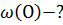
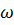 (О2) =
(О2) =  * 100% = 20%
* 100% = 20%
Ответ: 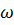 (Cu) - 80%,
(Cu) - 80%, 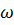 (О2) -20%
(О2) -20%
Вариант №4
1. Электролитическая диссоциация – это распад электролита на ионы в растворах или расплавах.
2. -Взаимодействие хлора с простыми веществами.
а) с неметаллами
Cl2 +H2 → 2HCl
б) с металлами
Ca + Cl2 → CaCl2
-Взаимодействие со сложными веществами
а) с водой
Cl2 +H2 O → HCl + HClO
3. Ca → CaO → Ca (OH)2 → CaCl2
1) 2 Ca + O2 → 2 CaO
2) CaO + H2 O → Ca (OH)2
CaO + H2 O → Ca2+ + 2OH1-
3) Ca (OH)2 + 2HCl → Ca Cl2 + 2H2O
Ca2+ + 2 OH1- + 2 H1+ + 2Cl1- ⇄ Ca2+ + 2 Cl1- + 2H2 O
2H1+ + 2 OH1- ⇄ 2 H2 O
4.Дано: Решение:
H 2,N2 D (N2) = 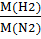
D(N2) -? M(H2) = 2 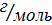
M (N2) = 28 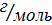
D (N2) =  = 0,07
= 0,07
Ответ: D(N2) – 0,07
Вариант №5
1. Электролиз - это окислительно - восстановительные реакции, протекающие на электродах при прохождении электрического тока через раствор или расплав электролита.
2. -Взаимодействие кислорода с простыми веществами
а) с неметаллами
2H2 + O2 → 2H2 O
S + O2 → SO2
б) с металлами.
2Ca + O2 → 2CaO
- Со сложными веществами
а) с оксидом серы (IV)
2SO2 + O2 → 2SO3
3.
Cu Cl 2 (Cu (OH)2, HCL)
Слабое основание сильная кислота
Cu Cl2 ⇄ Cu2+ + 2Cl1-
H2 O ⇄ H1+ + OH1-
Cu2+ + 2 Cl1- + H1+ OH1- ⇄ CuOH1+ +2 Cl1- + H1+ (кислая среда)
Cu2+ + H1+ + OH1-⇄ CuOH1+ + H1+
CuCl2 + H2 O ⇄ CuOHCl + HCL
4.Дано: Решение:
V (N2) – 11,2л V m =  ; V m = 22,4
; V m = 22,4 
𝒱(N2) -? 𝒱(N2)= 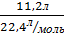 = 0,5 моль
= 0,5 моль
Ответ: 𝒱 (N2)- 0,5 моль
Вариант№6
1. Гидролиз соли – реакция обмена между солями и водой, ведущая к образованию слабого электролита.
2. -Взаимодействие углерода с простыми веществами
а) с неметаллами
C+O2 → CO2
C+2H2 → CH4
б) с металлами
4Al + 3C → Al4 C3
-Взаимодействие со сложными веществами
2Fe2 O3 + 3C → 4 Fe + 3CO2
1 2 3
3. Cl2 → HCl → Na Cl → Ag Cl
1.) Cl2 +H2 → 2HCl
Cl2 + H 2 ⇄ 2 H1+ + 2 Cl1-
2.) HCl + Na OH → NaCl+ H2 O
H1+ +Cl1- + Na1+ + OH1- ⇄ Na1+ + Cl1- + H2 O
H1+ + OH1- ⇄ H2 O
3) Na Cl + AgNO3 → Na NO3 + AgCl ↓
Na1+ + Cl1- + Ag1+ + NO31 ⇄ Na1+ + NO31- + Ag Cl↓
Ag1+ + Cl1- ⇄ Ag Cl 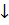
4. Дано Решение
Д (возд) = 1,103 Д (возд) = 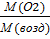 ;
;
М(возд) -? М (возд) = 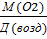 = =
= =  29
29 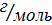
Ответ М(возд) = 29 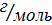
Задачи повышенной сложности
Задача 1
Дано
m (Mg+примеси) – 6г
V (Н2) – 4,48л
ω(примеси) -?
Решение
1.Напишем уравнение реакции. Над уравнением запишем имеющиеся данные, под уравнением – число молей
4,48л
Mg + H2SO4 = MgSO4 + H2
1 моль 1 моль
2.Находим по периодической системе молярную массу магния
M(Mg)=24г/моль
Молярный объем газа Vm=22,4л/моль
3.Определяем количество вещества водорода, которое содержится в 4,48л водорода по формуле
Y = 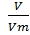 Y(Н2) =
Y(Н2) = 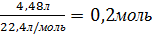
4. Находим количество вещества магния, необходимого по уравнению реакции.
Составляем пропорцию
1моль Mg – 1моль Н2
X моль Mg – 0,2 моль Н2
x = 0,2 моль
5.Находим массу магния по формуле
m = M * Y
где M – молярная масса
Y – количество вещества
m (Mg) = 24г/моль * 0,2 моль = 4,8г
6.Находим массу примесей
m (примеси) = 6г – 4,8г = 1,2г
7.Находим массовую долю примесей по формуле
ω = 
ω (примеси) = 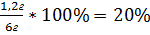
Ответ: ω (примеси) = 20%
Задача 2
Дано
m (СаО) – 5,6г
m (раствор 10% Н2SО4) – 200г
m(СаSО4) -?
Решение
1.Напишем уравнение реакции. Над уравнением запишем имеющиеся данные, под уравнением – число молей
5,6г
СаО + Н2SО4 = СаSО4 + Н2О
1 моль 1моль 1 моль
2.Находим молярные массы оксида кальция, серной кислоты, сульфата кальция
M(CаО) = 40 + 16 =56 г/моль
M(Н2SO4) = 1 * 2 + 32 + 16 * 4 = 98г/моль
М(СаSО4) = 40 + 32 + 64 = 136г/моль
3.Находим массу серной кислоты, которая содержится в 200г раствора
m(Н2SО4) = 200г * 0,1 = 20г
4.Находим количество вещества оксида кальция и серной кислоты
Y(СаО) = 
Y(Н2SО4) = 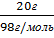 = 0,2моль
= 0,2моль
5.Находим какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке
0,1моль СаО – х моль Н2SО4
1 моль СаО – 1 моль Н2SО4
х = 0,1 моль Следовательно, СаО дан в недостатке, расчет ведем по нему
6.Находим количество вещества сульфата кальция
0,1 моль СаО – х моль СаSО4
1 моль СаО – 1 моль СаSО4
х = 0,1 моль
7.Находим массу сульфата кальция
m (СаSО4) = 136г/моль * 0,1 моль = 13,6г
Ответ: m(СаSО4) = 13,6г
Пакет заданий
Условия выполнения задания
1. Контрольное тестирование по теме «Теория химического строения А.М. Бутлерова. Алканы. Непредельные углеводороды» проводится в аудитории по химии на учебном занятии.
2. Время выполнения 45 минут
3. Оборудование: периодическая система химических элементов Д.И. Менделеева.
4. Эталон ответов
Эталоны ответов на тестовые задания по теме «Теория А.М. Бутлерова. Углеводороды»
| Вариант 1
| Вариант 2
| Вариант 3
| Вариант 4
|
| № задания
| № ответа
| № задания
| № ответа
| № задания
| № ответа
| № задания
| № ответа
|
| 1
| 3
| 1
| 2
| 1
| 4
| 1
| 3
|
| 2
| 3
| 2
| 1
| 2
| 3
| 2
| 2
|
| 3
| 1
| 3
| 2
| 3
| 2
| 3
| 2
|
| 4
| 2
| 4
| 2
| 4
| 3
| 4
| 3
|
| 5
| 4
| 5
| 4
| 5
| 1
| 5
| 2
|
| 6
| 2
| 6
| 1
| 6
| 2
| 6
| 3
|
| 7
| 4
| 7
| 4
| 7
| 4
| 7
| 2
|
| 8
| 4
| 8
| 4
| 8
| 2
| 8
| 1
|
| 9
| 3
| 9
| 2
| 9
| 1
| 9
| 4
|
| 10
| 1
| 10
| 3
| 10
| 4
| 10
| 3
|
1. Первое положение теории А.М.Бутлерова
2. Изомерами
3. Ковалентные
4. 2CH3J + 2Na → CH3 – CH3 + 2NaJ
5. 2-метилбутан
6. SP2- гибридизации
7. Бутадиен-1,3
8. Три изомера
Диапазон
Оценки в баллах
Экзамен, дифференцированный зачет
|
Зачет
| | Традиционная шкала
|
| 1
| 2
| 3
|
| 91 - 100
| Отлично (5)
| зачтено
|
| 71 – 90
| Хорошо (4)
|
| 51 - 70
| Удовлетворительно (3)
|
| 0 - 50
| Неудовлетворительно (2)
| незачтено
|
Описание системы оценок
| Диапазон
оценки в баллах
| Описание оценок
|
| 91 - 100
| Отлично - теоретическое содержание курса освоено полностью, без пробелов, необходимые практические навыки работы с освоенным материалом в основном сформированы, все предусмотренные программой обучения учебные задания выполнены, качество выполнения большинства из них оценено числом баллов, близким к максимальному.
|
| 71 – 90
| Хорошо - теоретическое содержание курса освоено полностью, без пробелов, некоторые практические навыки работы с освоенным материалом сформированы недостаточно, все предусмотренные
программой обучения учебные задания выполнены, качество выполнения ни одного из них не оценено минимальным числом баллов, некоторые виды заданий выполнены с ошибками.
|
| 51 - 70
| Удовлетворительно - теоретическое содержание курса освоено часстично, но пробелы не носят существенного характера, необходимые практические навыки работы с освоенным материалом в основном сформированы, большинство предусмотренных программой обучения учебных заданий выполнено, некоторые из выполненных заданий, содержат ошибки.
|
| 0 - 50
| Условно неудовлетворительно - теоретическое содержание курса освоено частично, необходимые практические навыки работы не сформированы, большинство предусмотренных программой обучения учебных заданий не выполнено, либо качество их выполнения оценено числом баллов, близким к минимальному; при дополнительной самостоятельной работе над материалом курса возможно повышение качества выполнения учебных заданий.
|
Пакет заданий
4.1. Теоретические задания
ТЕОРЕТИЧЕСКОЕ ЗАДАНИЕ (ТЗ) № 1- n
Текст задания:________________________________________________________
_____________________________________________________________________________
4.2. Практические задания
ПРАКТИЧЕСКОЕ ЗАДАНИЕ (ПЗ) № 1- n
Текст задания:________________________________________________________________
_____________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания (на учебной/ производственной практике, в цеху организации (предприятия), мастерской ОУ (ресурсного центра), на полигоне, в учебной фирме и т.п.):______________
2. Максимальное время выполнения задания: ___________ мин./час.
3. Вы можете воспользоваться (указать используемое оборудование (инвентарь), расходные материалы, литературу и другие источники, информационно-коммуникационные технологии и проч.) _____________________________________________________________________________4. Указать другие характеристики, отражающие сущность задания: в реальных (модельных) условиях профессиональной деятельности __________________________________________________
5. Бланк ответов (для тестов)
Группа ________ Курс _______ Дата_________________
Дисциплина ____________________________________________________
Специальность __________________________________________________
ФИО Студента __________________________________________________
Вариант № _____
Выбранный номер ответа обведи кружочком или впиши ответ
| № задания
| Номера ответов
| № задания
| Номера ответов
|
| 1
| 1 2 3 4 5
| 6
|
|
| 2
| …….
| 7
|
|
| 3
|
| 8
|
|
| 4
|
| 9
|
|
| 5
|
| 10
|
|
6. Эталон ответов (ключ или решение)
ЗАЧЕТНАЯ ВЕДОМОСТЬ
Учебная дисциплина: ________________________________________
Преподаватель: __________________________________________
Группа: _____________
| № п/п
| Фамилия, имя, отчество студента
| Оценка
| Подпись преподавателя
|
| 1
|
|
|
|
| 2
|
|
|
|
| 3
|
|
|
|
| 4
|
|
|
|
| 5
|
|
|
|
| 6
|
|
|
|
| 7
|
|
|
|
| 8
|
|
|
|
| 9
|
|
|
|
| 10
|
|
|
|
| 11
|
|
|
|
| 12
|
|
|
|
| 13
|
|
|
|
| 14
|
|
|
|
| 15
|
|
|
|
| 16
|
|
|
|
| 17
|
|
|
|
Дата проведения зачета _______________
Результаты: Успеваемость:
«отлично» ________________ общая ________%
«хорошо» _________________ качественная ________%
«удовлетворительно»_______
«неудовлетворительно»_____
Преподаватель______________
[4] Пояснения по заполнению таблицы на стр.
[5] Характеристика заданий дана на стр.
[6] показатели и критерии у обобщенных результатов обучения следует также обобщить.
[7] Дисциплина Основы электроники и цифровой схемотехники, специальность 230401
МИНИСТЕРСТВО ОБРАЗОВАНИЯ ОМСКОЙ ОБЛАСТИ
бюджетное образовательное учреждение Омской области
«Омский автотранспортный колледж»
ФОНД
ОЦЕНОЧНЫХ СРЕДСТВ
ПО УЧЕБНОЙ ДИСЦИПЛИНЕ
ОБД. 06 Химия
основной профессиональной образовательной программы (ОПОП) по специальности СПО
190631.51 Техническое обслуживание и ремонт автомобильного транспорта
ОМСК, 2012
I. Общие положения
В результате освоения дисциплины обучающийся должен уметь:
- Применять изученные теоретические положения при рассмотрении классов неорганических и органических соединений.
- Уметь решать задачи и выполнять упражнения, лабораторные и практические задания.
- Оказывать первую помощь при химических отравлениях.
- Уметь связывать свойства веществ с их применением, раскрывать сущность глобальных проблем человека и объяснять роль химии в их решении.
В результате освоения дисциплины обучающийся должен знать:
- Основные теоретические положения по химии как одной из важнейших естественных наук.
- Классификацию, состав, номенклатуру и характерные свойства основных классов неорганических и органических соединений.
- Взаимосвязь между простыми веществами и их соединениями. Генетическую связь между основными классами неорганических и органических соединений.
- Промышленное и лабораторное получение неорганических и органических соединений, их применение; меры по охране окружающей среды.
- Роль химии в решении глобальных проблем человечества и воздействие химических соединений на организм человека и окружающую среду.
Результатом освоения программы является также освоение студентами общих компетенций и их компонентов, составных частей
Таблица 1
| Код и название компетенций
| Раздел, тема
| Компоненты, составные части ОК и ПК
| Уровень освоения
|
| ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), результат выполнения заданий.
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации.
ОК 9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
ОК 10. Исполнять воинскую обязанность, в том числе с применением полученных профессиональных знаний (для юношей).
| 1.5, 1.6, 1.7, 2.1, 2.4, 2.11
1.1, 1.2, 1.4, 1.5, 1.6, 1.8, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 2.10
1.6, 1.7, 2.5, 2.7, 2.9
1.1, 1.2, 1.5, 1.6, 1.7, 2.2, 2.3, 2.4, 2.8, 2.9, 2.10, 2.11
1.2, 1.5, 1.6, 1.7, 2.2, 2.3, 2.4, 2.8, 2.9, 2.10, 2.11
1.6, 1.7, 2.5, 2.7, 2.9
1.8, 2.11
1.2, 2.9
1.8, 2.10
1.1 – 2.11
| Понимать сущность процессов и их значимость в профессиональной деятельности и жизни
Организовывать собственную деятельность, уметь решать типовые задачи, упражнения, выбирать способы их выполнения, оценивать их качества
Умение ориентироваться в нестандартных ситуациях
Умение работать с литературой, осуществлять поиск информации
Использовать ИКТ
Умение работать в группе
Брать на себя ответственность за результаты выполнения задания
Самостоятельное осуществление элементов исследовательской деятельности
Готовность к осуществлению деятельности в измененных условиях
Умение подчиняться требованиям преподавателя и выполнять его рекомендации
| 1,2
1,2
1,2
1,2
1,2
1,2
1,2,3
1,2
1,2
1,2
|
II. Комплекты измерительных материалов



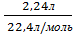 = 0,1 моль
= 0,1 моль
 Сu2 + 2 Cl1-
Сu2 + 2 Cl1-
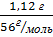 =0,02 моль
=0,02 моль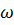 (Cu) -?
(Cu) -?  * 100% = 80%
* 100% = 80%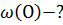
 * 100% = 20%
* 100% = 20%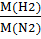
 = 0,07
= 0,07 ; V m = 22,4
; V m = 22,4 
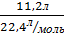 = 0,5 моль
= 0,5 моль
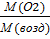 ;
;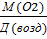 = =
= =  29
29 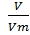 Y(Н2) =
Y(Н2) = 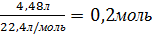

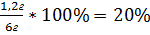

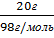 = 0,2моль
= 0,2моль


