Причем эта зависимость прямо пропорциональна.
Наконец, скорость катализируемой ферментом реакции постепенно снижается при увеличении времени инкубации реакционной смеси
Скорость снижается за счет действия 2 факторов:
1. Увеличение времени инкубации приводит к уменьшению концентрации субстрата, увеличивается также концентрация продуктов р-ии
1. Увеличение времени инкубации может сопровождаться денатурацией части молекул фермента
Влияние активаторов и ингибиторов
Наличие в к-ке или в реакционной смеси определенных соединений (активаторов и ингибиторов) оказывает выраженное влияние на скорость катализируемых ферментом р-ий.
Активаторы – соединения, повышающие каталитическую активность фермента
Механизм действия активатора
1. Активатор может вытеснять ингибитор или отщеплять его от фермента.
2. Активатор может связываться с субстратом и тем самым обеспечивать его более эффективное взаимодействие с активным центром фермента.
Например, АТФ, который образует комплекс с ионами магния. В настоящее время считают, что субстратом для многих ферментов является не АТФ сам по себе, а магниевая соль АТФ, вот почему магний или калий имеют достаточно широкое применение в качестве лекарственных препаратов.
3. Активатор может способствовать присоединению кофермента к апоферменту.
4. Активатор может взаимодействовать с аллостерическим центром фермента.
Активатор соединяется с аллостерическим центром, это сопровождается изменением конформации фермента, конформационная волна затрагивает структуру активного центра, и повышение активности фермента связано с изменением структуры активного центра
Ингибиторы – соединения снижающие, а иногда полностью подавляющие каталитическую активность ферментов
В качестве ингибиторов выступают самые различные по структуре вещества:
1. Ионы некоторых металлов
2. Ряд низкомолекулярных органических соединений
3. Высокомолекулярные полипептиды или белки
Механизм ингибирования
1. При взаимодействии ингибитора с ферментом, изменяется коформация фермента, что влечет за собой изменение структуры активного центра и снижение эффективности катализа
2. Ингибитор связывается с активным центром фермента и блокирует его
3. Ингибитор может вытеснять или подменять кофактор из фермента или изменять химическую структуру кофактора
4. Ингибитор может взаимодействовать с субстратом, изменяя его структуру
Ингибирование
1. Обратимое
2. Необратимое
Необратимое ингибирование
При нем происходит или разрушение пространственной структуры элемента или образование недиссоциирущего комплекса
Е+У àЕУ
В ряде случаев необратимое ингибирование ферментов под действием того или иного соединения вызывает образование ковалентных связей между ингибитором и кокой-либо группировкой в активном центре, в этом случае структура активного центра не просто изменяется, а иногда разрушается, поэтому фермент перестает работать
 Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп
Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп
Деизопропилфторфосфат является необратимым ингибитором ферментов, активность которых зависит от гидроксильных групп серина в их активном центре, такие ферменты как трипсин, фосфорилазы и др.
В большинстве своем необратимые ингибиторы являются сильными ядами, поскольку, выводя из строя ферменты, они несомненно дезорганизуют обмен в-в
Исключение: Аспирин – лекарственный препарат или ацетилсалициловая к-та – необратимый ингибитор фермента циклооксигеназы, который участвует в синтезе простогландина в биорегуляторах, в этом качестве аспирин нашел широкое применение в медицине
При обратимом ингибировании который делится:
1. Конкурентный
2. Неконкурентные
Образовавшийся энзим-ингибиторный комплекс нестойкий, поэтому происходит диссоциация энзим-ингибиторного комплекса, возврат фермента в исходное состояние,
Е+У <-> ЕУ
В этом случае фермент восстанавливает свою активность
Различают 2 вида обратимого ингибирования
1. Конкурентные
2. Неконкурентные
При конкурентном ингибировании ингибитор по своей структуре подобен, но не идентичен субстрату, поэтому он может связываться с активным центром фермента, но не подвергается в нем дальнейшим превращениям и фермент на время выводится из строя
Из-за непрочности связывания, ингибитор через некоторое время покидает активный центр, и фермент может взаимодействовать с субстратом
Если в к-ке или в реакционной смеси одновременно присутствуют и субстрат и ингибитор, то параллельно работают 2 системы, т.е. часть молекул фермента связываются с субстратом, образуют энзим-субстратный комплекс, превращается субстрат в продукты р-ии, регенерация энзима и продукта р-ии, а часть молекул фермента связывается с ингибитором с образованием ингибиторного комплекса
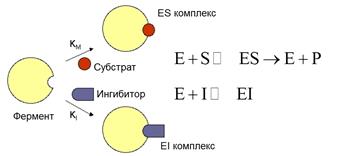
Ингибирование зависит
1. Если концентрация ингибитора высокая, то ингибирование будет иметь место
2. Если в к-ке повышается концентрация истинного субстрата, ингибитор вытесняется, поскольку он непрочно связан с группировками активного центра, фермент восстанавливает свою активность, т.е. концентрация субстрата несомненно оказывает влияние
Например: ингибирование и угнетение активности фермента сукцинатдегидрогеназы, (р-я из цикла трикарбоновых к-т)
Сукцинат – янтарная к-та (широко используется в качестве лекарственного препарата). Он окисляется, теряя 2 атома водорода путем дегидрирования, под действием сукцинатдегидрогеназы, превращается в непредельную тумаровую к-ту, атомы водорода передаются на ФАД.
Конкурентные ингибиторы сукцинатдегидрогеназы:
 Малоновая к-та Оксалоацетат малат
Малоновая к-та Оксалоацетат малат
Характерной чертой этого типа ингибирования является то, что ингибитор связывается только со свободным ферментом, поскольку взаимодействие идет по активному центру
При воздействии на фермент конкурентного ингибитора происходит увеличение константы Михаэлиса ингибируемого фермента, а V max не претерпевает изменений
При неконкурентном ингибировании, ингибитор не похож по структуре на субстрат, он реагирует с той или иной функциональной группой фермента, которая может быть или в активном центре, или вне его.
Степень такого ингибирования зависит только от концентрации ингибитора и его сродства к ферменту, т.е. чем больше концентрация ингибитора и чем больше сродство ингибитора к ферменту, тем больше степень угнетения активности фермента
Поскольку ингибитор реагирует с функциональной группой на поверхности фермента, он может воздействовать как на свободный фермент, так на весь фермент в составе ES-комплекса, причем повышение концентрации субстрата несомненно не оказывает влияние на степень ингибирования

Например:
Угнетение некоторых ферментов ионами серебра, они связывают сульфгидрильные группы фермента, но это связывание обратимо
Отравление цианидами – солями синильной к-ты
Цианиды – связываются с ферментом цитохромоксидазы, причем это связывание обратимо
При неконкурентном ингибировании значение константы Михаэлиса для ингибированного фермента не изменяется, а значение V max падает
В виду особой важности в регуляции клеточного метаболизма обычно отдельно рассматривают аллостерическое ингибирование ферментов, аллостерического ингибирование- частный случай неконкурентного ингибирования, с одной очень важной особенностью: связывание аллостерического ингибитора происходит в аллостерическом центре на основе принципа комплементарности, присоединение аллостерического ингибитора к аллостерическому центру приводит к изменению пространственной структуры фермента, затрагивается при этом структура активного центра, при этом связывание и эффективность катализа падают, и мы регистрируем падение активности фермента
Многие лекарственные препараты являются ингибиторами тех или иных ферментов в организме человека
Н-р:
Сердечный гликозид – строфантин, который используется для лечения некоторых заболеваний сердца, является неконкурентным ингибитором _____ независимой АТФ-азы в миокардиоцитах
Аллопуринол (алло – другой, иной, пуринол – спирт) используется для лечения подагры, является конкурентным ингибитором фермента сантинокиназы



 Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп
Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп


 Малоновая к-та Оксалоацетат малат
Малоновая к-та Оксалоацетат малат




