Ферменты
Сходства и различия ферментов и катализаторов небиологической природы
Ферменты по ряду свойств напоминают катализаторы небиологической природы.
- ферменты катализируют только термодинамически возможные реакции, т.е. ферменты не могут создавать новых реакции, а могут только катализировать существующие
- Ферменты не расходуются в ходе реакции;
- не смещают положение равновесия катализируемой реакции, а только ускоряют его наступление, т.е. ферменты ускоряют и прямую и обратную реакцию
- Работают по принципу гетерогенного катализа

Ферменты обладают рядом свойств, отличающих их от катализаторов небиологической природы (специфические свойства ферментов)
- Ферменты-белки или некоторые РНК, получившие название рибозимы, работают в мягких условиях
(Т = 40–50°С; нейтральный pH, атмосферное давление и др.), в жестких условиях не могут работать из-за денатурации их молекул
- Очень высокая эффективность действия; превышает, как правило, на один или несколько порядков активность катализаторов небиологической природы
- Специфичность действия ферментов к типу катализируемой реакции и к структуре реагирующих соединений
- Регулируемость каталитической активности ферментов;
- Отсутствие побочных продуктов реакции. При действии катализаторов небиологической природы, наблюдается образование побочных продуктов
Номенклатура и классификация ферментов
1. Тривиальная
a. Исторические сложившееся названия ферментов (пепсин (катализирует расщепление белков в желудке), трипсин (расщепление белков в тонкой кишке))
2. Рациональная (рабочая) – более информативен
a. Названия ферментов строятся из названия субстрата (соединение, которое превращается под действием фермента) и характера катализируемой реакции + аза
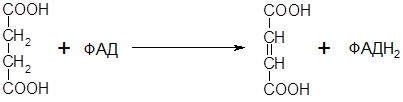
Окисление янтарной кислоты (сукцинат) под действием фермента Сукцинатдигидрогеназа образуется тумаровая кислота и ФАДН2
Атомы водорода переносятся на восстановление ФАД
3. Систематическая (самое информативное, неудобство – очень длинное название), дело в том, что большая часть реакций, которые протекают ___ системы являются реакциями димолекулярными, т.е. в ходе реакции принимает участие не одно соединение, а два
Субстрат: субстрат – характер реакции + аза
(субстраты, которые участвуют в реакции (сукцинат и ФАД), характер реакции произошла оксидоредукция – окисление и восстановление)
Н-р: Сукцинат: ФАД – оксидоредуктаза
Международная классификация ферментов
Классы
Подклассы - уточнение типа катализируемой реакции
Подподклассы – с дальнейшим уточнением характера катализируемой реакции
Индивидуальные ферменты,имеющие индивидуальный порядковый номер
1 пример:

2 пример: 1.1.1.27 – Лактатдегидрогеназа (ЛДГ)
Катализирует реакцию: 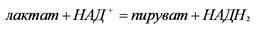
Ферменты
1. Простые (протеины)– одна цепь или олигомерные белки
2. Сложные (протеиды) – двукомпонентные:
a. Белковая часть – АПОФЕРМЕНТ
b. Небелковая – КОФАКТОР
Совокупность апофермента и кофермента называется ХОЛОФЕРМЕНТ
АПОФЕРМЕНТ не обладает каталитической активностью совсем
Один КОФАКТОР может обладать слабой каталитической активностью
Но в этом случае специфичность катализа очень низкая, только комплекс апофермента и кофактора обладает высокой каталитической активностью и специфичностью действия
Кофакторы по природе делят:
1. Кофакторы алифатического ряда
a. Долихолфосфат
b. Глутатион
c. Липоевая кислота (липоат) участвует в окислительном декарбоксилировании кетокислот
2. Кофакторы ароматического ряда (угихиноны) - относятся коэнзимы Q
3. Кофакторы гетероциклического ряда
a. Кофакторы – производные витаминов
i. Тетрагидрофолат (активная форма витамина - В9 – фолиевая кислота (фолат))
ii. Тиаминпирофосфат (В1) – в качестве лекарственного препарата используется соль кокарбоксилаза
iii. Биоцитин (В7)
iv. Фосфопиридоксаль (В6) (имеется 3 формы: перидоксол, перидоксамин, пиридоксаль) – выполняет функцию переносчика аминогрупп
b. Кофакторы – не являющиеся производными витаминов – диминовые кофакторы
4. Кофакторы нуклеотидной природы – гетероциклы
a. Кофакторы – нуклеотидной природы, в состав которых входят витамины:
ФМН- флавинмононуктеотид (В2), ФАД - флавинадениндинуклеотид (В2), НАД - Никотинамидадениндинуклеоти́д (PP – витамин В5), НАДФ - Никотинамидадениндинуклеотидфосфа́т (PP), HS-КоА (В3),
кобамидные кофакторы (В12) – дезоксиаденозилкоболамин, митинкоболамин
b. Кофакторы – нуклеотидной природы, не содержащие витаминов: АТФ- Аденозинтрифосфа́т, ГТФ- гуэнозилтрифосфа́т, УТФ-Уридинтрифосфат, ЦТФ, ФАФС – фосфоаденозинфосфосульфат (активная форма серной к-ты)
5. Кофакторы ионных металлов Na+,K+, Mg2+, Ca2+, Fe2+, Cu+ и др
Проферменты и изоферменты
Часть ферментов синтезируется в организме человека в виде неактивных предшественников – проферментов
Профермены:
1. Более длинная полипептидную цепь, по сравнению с образующейся из них активных ферментов
2. Конформация полипептидной цепи профермента такова, что в структуре его нет активного центра или он прикрыт участком полипептидной цепи, поэтому профермент или вообще не обладает каталитической активностью, или активность его крайне низкая
Превращение профермента в фермент осуществляется путем ограниченно избирательного протеолиза, т.е. расщепляется одна пептидная связь, отщепляется ингибиторный пептид, конформация оставшейся полипептидной цепи меняется, в результате на поверхности – активный центр, который обеспечивает катализ (например, превращение протромбина в тромбин)
Как правило, в виде профермента синтезируются те ферменты, которые в биологической системе постоянной не нужны, в тоже время при необходимости, они нужны в достаточно большом количестве, это касается ферментов участвующих в свертывании крови, если бы все участники свертывания крови были бы активны, у нас постоянно образовывались бы тромбы, поэтому оптимальным вариантом является наличие профермента, который при необходимости быстро превращается в фермент, и тем самым останавливается кровотечение, т.е. избегается большая кровопотеря
Преобразование профермента в ферменты (касающихся свертывания крови) происходит при повреждении стенки сосудов
В ряде случает в плазме крови, органах и тканях удается обнаружить 2 или более белка, способных катализировать одну и ту же реакцию, но эти белки отличаются по физико-химическим свойствам
Например, фермент лактатдегидрогеназа существует в виде 5 различных белков, они названы: ЛДГ 1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5
Изоферменты
- ферменты, катализирующие одни и те же химические реакции, но различающиеся генетически детерминированной структурой.
1. Оказалось, что некоторые изоферменты, работают в определенных органах и тканях, так предположим ЛДГ1 и ЛДГ2 работают в сердечной мышце, а ЛДГ5, ЛДГ 4 характерны для печени
2. Креатинкеназа (КК)
Широко используется для диагностики инфаркта миокарда и диагностики повреждения мышечной ткани
Существует 3 изофермента креатинкеназы:
ВВ – форма КК типична для головного мозга,
МВ – форма КК, характерна для сердечной мышцы
ММ – форма КК, характерна для мышечной ткани и мышечной мускулатуры
Определяя содержание соответствующих изоферментов в плазме крови, удается диагносцировать определенные патологии, сопровождающиеся деструкцией определенных тканей, и более того контролировать интенсивность, ход проводимого лечения. При правильно проведенном лечении, изоферменты нетипичные для плазмы исчезают из нее.
Функциональные центры
- Активный центр
- Регуляторные центры
- Контактные площадки
АКТИВНЫЕ ЦЕНТРЫ
Осознание того, что в большинстве случаев в образовании ES –комплекса участвует макромолекула РНК-ферментов и чаще небольшая молекула субстрата, навело на мысль, что в этом белок-лигандном взаимодействии участвует сравнительно небольшой участок поверхности фермента
Активный центр – участок поверхности фермента, ответственный за связывание субстрата и его дальнейшие превращения.
Элемент активного центра
К составным элементам активного центра относят участки остова полипептидной цепи, которые удерживают АК-ые радикалы в определенном пространственном расположении друг к другу
Элемент
В активный центр входит кофактор, если фермент представляет собой сложный белок
Исключение: ионы металлов, обычно они отличаются в стабилизации третичной или четвертичной структуры
В активном центре условно выделяют 2 участка (2 центра)
1. Субстратный участок – якорная площадка – связывание субстрата лиганда
2. Каталитический участок – непосредственно обеспечивает катализ превращения субстрата (входят кофакторы)
В связывании субстрата, как и в катализе, важнейщая роль принадлежит функциональным группам, имеющимся в радикалах АК-т, которые образуют активные центры
Функциональные группы:
1. Гидроксильная группа
a. Серин –ОН
b. Тирозин –ОН
c. Треонин –ОН
2. Сульфгидринная меркаптогруппа
a. Цистеин - SН
3. Карбоксильная группа
a. Глутамата -СООН
b. Аспартата –СООН
4. Аминогруппа
a. Лизин –NН2
b. Аргинин - NН2
5. группировки CO и NH остова полипептидной цепи
важную роль в связывании субстрата могут иметь гидрофобные радикалы АК-т: валин, глицин, триптофан, метионин и фенилаланин
как правило активный центр фермента часто имеет вид углубления или щели на поверхности ферментов, у ферментов имеющих доменную структуру активный центр часто располагается в щели между прилегающими друг к другу доменами,
некоторые ферменты в своей структуре имеют несколько одинаковых протомеров, иногда в одном из них имеется одинаковые активные центры, в некоторых случаях в ферменте в пределах даже одной полипептидной цепи может быть несколько разных активных центров, такие ферменты получили название – Полифункциональные ферменты
К ним относится фермент – пальметоилситетаза – синтез пальметиновой кислоты
РЕГУЛЯТОРНЫЕ ЦЕНТРЫ
§ аллостерический центр
§ центр ковалентной модификации
§ центр белок-белкового взаимодействия
КОНТАКТНЫЕ ПЛОЩАДКИ
ферменты, имеющие в своей структуре регуляторные центры, получили название регуляторные ферменты
Не все ферменты имеют полный набор названных функциональных центров. Некоторые ферменты имеют всего один активный центр, есть ферменты, имеющие несколько активных центров, а некоторые ферменты вооружены несколькими активными центрами и несколькими регуляторными центрами.
Аллостерический центр (аллос – другой, иной) – регуляторный функциональный центр, который расположен вне активного центра
Аллостерический центр – участок на поверхности молекулы белка – фермента, образованный определенным набором АК-ых радикалов, но его трехмерная структура комплементарна не субстрату, а тому или иному низкомолекулярному леганду, который выступает в качестве регулятора активности фермента
Примеры аллостерических модуляторов:
• цAMФ
• ATФ
• НАДH
• Н3РО4
Если к аллостерическому центру присоединяется аллострерический модулятор, это приводит к изменению конформации фермента, которое сопровождается изменением пространственной структуры активного центра, поэтому изменяется эффективность катализа, причем может изменяться способность активного центра связывать субстрат, может меняться способность осуществлять непосредственное химическое превращение субстрата
• Аллостерический активатор – повышает каталитическую активность фермента.
• Аллостерический ингибитор – снижает каталитическую активность фермента.
Например: фосфофруктокиназа – катализирует фосфолирирование фруктозо-6-фосфата (одна из реакции гликолиза, т.е. окислительного расщепления белков)
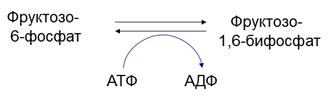
Аллостерические ингибиторы для данного фермента:
• ATФ
• Цитрат(лимонная кислота)
Аллостерический активатор:
Связывание лигандного модулятора осуществляется только за счет слабых взаимодействий: гидрофобные и электростатические, поэтому такое связывание обратимо, значит возможет возврат фермента в исходное состояние, в итоге суммарно-ферментативная активность будет в значительной степени определяться концентрацией аллостерического модулятора
Аллостерические ферменты имеют четвертичную структуру, причем обычный регуляторный центр находится на одном протомере, а активный центр на другом
В целом ряде случает один и тот же фермент имеет в своей структуре 2 и более аллостерических центра, которые комплементарны различным лигандным регуляторам
В этом случае сродство фермента к конкретному аллостерическому модулятору зависит от состояния других аллостерических центров
КОНТАКТНЫЕ ПЛОЩАДКИ.
Участки, ответственные за взаимодействие фермента с другими белками или внутриклеточными структурами.
Контактные площадки комплементарны контактным площадкам, имеющимся на поверхности других белков или других ферментов, подобного рода взаимодействия встречаются при формировании надмолекулярных белковых комплексов
Ферменты, катализирующие определенный метаболический путь, например, синтез пуриновых, пиримидиновых и др.
Клетка входит в состав метаболона – мулльтиэнзимные белковые комплексы, которые обеспечивают соответствующий метаболический путь, связи между ними обычно электростатические или гидрофобные,
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
Почему в присутствии фермента возрастает скорость химических реакции?
2 аспекта
1. Термодинамический
2. Структурнокинетический
Термодинамический
Каждая молекула любого вещества обладает уровнем энергии, причем этого уровня энергии явно недостаточно, чтобы вещество вступало в реакцию с другими окружающими его веществами, только мы имеем дело с относительно стабильными окружающими предметами. Но достаточно поднять уровень внутренней энергии молекулы вещества, как оно начинает реагировать, взаимодействовать со своим окружением
Превращение субстратов в продукт реакции
Молекулы вещества субстрата обладают недостаточным уровнем внутренней энергии, для того чтобы вступить в реакцию, только отдельные молекулы за счет соударений или внешних воздействий могут повысить внутреннюю энергию, перейти в реакционноспособное состояние
Минимальный уровень внутренней энергии, необходимый для перехода молекулы вещества в реакционноспособное состояние - энергетический барьер реакции
Количество энергии, которое нужно сообщить одному молю вещества субстрата, для их перехода в реакционноспособное состояние - энергия активации
Ккал/моль или КДж/моль
Чем больше энергия активации, чем выше энергетический барьер реакции, тем медленнее пойдет эта реакция
Величину энергии активации можно уменьшить путем увеличения температуры
Произвольн ую температур у биологических объектов менять мы не можем ввиду т епловой нестабильности белков
Можно попытаться снизить энергетический барьер реакции, но для это нужно воздействовать на структуру вещества
Нужно направить реакцию по обходному пути, добавив в реакционную смесь катализатор
Речь идет о 2 реакциях:
1.Субстрат соединяется с энзимом, с образованием энзим-субстратного комплекса
2.Расщипление с образованием продукта реакции
Каждая из этих реакций имеет свой энергетический барьер и свою энергию активации
Мы будем наблюдать ускорение реакции, если энергия активации этих реакций в присутствии ферментов будет ниже, чем энергия активации прямой реакции
Вывод: ферменты ускоряют ход химических реакций в организме за счет проведения реакции по обходному пути, включающего образование энзим-субстратных комплексов
При этом энергетический барьер, а значит и энергия активации каждой из промежуточных реакции ниже соответствующих значений для прямой реакции
Запись 51
Ингибирование
1. Обратимое
2. Необратимое
Необратимое ингибирование
При нем происходит или разрушение пространственной структуры элемента или образование недиссоциирущего комплекса
Е+У àЕУ
В ряде случаев необратимое ингибирование ферментов под действием того или иного соединения вызывает образование ковалентных связей между ингибитором и кокой-либо группировкой в активном центре, в этом случае структура активного центра не просто изменяется, а иногда разрушается, поэтому фермент перестает работать
 Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп
Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп
Деизопропилфторфосфат является необратимым ингибитором ферментов, активность которых зависит от гидроксильных групп серина в их активном центре, такие ферменты как трипсин, фосфорилазы и др.
В большинстве своем необратимые ингибиторы являются сильными ядами, поскольку, выводя из строя ферменты, они несомненно дезорганизуют обмен в-в
Исключение: Аспирин – лекарственный препарат или ацетилсалициловая к-та – необратимый ингибитор фермента циклооксигеназы, который участвует в синтезе простогландина в биорегуляторах, в этом качестве аспирин нашел широкое применение в медицине
При обратимом ингибировании который делится:
1. Конкурентный
2. Неконкурентные
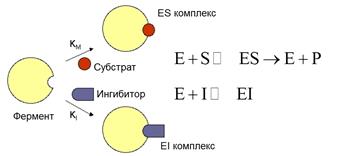
Образовавшийся энзим-ингибиторный комплекс нестойкий, поэтому происходит диссоциация энзим-ингибиторного комплекса, возврат фермента в исходное состояние,
Е+У <-> ЕУ
В этом случае фермент восстанавливает свою активность
Различают 2 вида обратимого ингибирования
1. Конкурентные
2. Неконкурентные
При конкурентном ингибировании ингибитор по своей структуре подобен, но не идентичен субстрату, поэтому он может связываться с активным центром фермента, но не подвергается в нем дальнейшим превращениям и фермент на время выводится из строя
Из-за непрочности связывания, ингибитор через некоторое время покидает активный центр, и фермент может взаимодействовать с субстратом
Если в к-ке или в реакционной смеси одновременно присутствуют и субстрат и ингибитор, то параллельно работают 2 системы, т.е. часть молекул фермента связываются с субстратом, образуют энзим-субстратный комплекс, превращается субстрат в продукты р-ии, регенерация энзима и продукта р-ии, а часть молекул фермента связывается с ингибитором с образованием ингибиторного комплекса
Ингибирование зависит
1. Если концентрация ингибитора высокая, то ингибирование будет иметь место
2. Если в к-ке повышается концентрация истинного субстрата, ингибитор вытесняется, поскольку он непрочно связан с группировками активного центра, фермент восстанавливает свою активность, т.е. концентрация субстрата несомненно оказывает влияние
Например: ингибирование и угнетение активности фермента сукцинатдегидрогеназы, (р-я из цикла трикарбоновых к-т)
Сукцинат – янтарная к-та (широко используется в качестве лекарственного препарата). Он окисляется, теряя 2 атома водорода путем дегидрирования, под действием сукцинатдегидрогеназы, превращается в непредельную тумаровую к-ту, атомы водорода передаются на ФАД.
Конкурентные ингибиторы сукцинатдегидрогеназы:
 Малоновая к-та Оксалоацетат малат
Малоновая к-та Оксалоацетат малат
Характерной чертой этого типа ингибирования является то, что ингибитор связывается только со свободным ферментом, поскольку взаимодействие идет по активному центру
При воздействии на фермент конкурентного ингибитора происходит увеличение константы Михаэлиса ингибируемого фермента, а V max не претерпевает изменений
При неконкурентном ингибировании, ингибитор не похож по структуре на субстрат, он реагирует с той или иной функциональной группой фермента, которая может быть или в активном центре, или вне его.
Степень такого ингибирования зависит только от концентрации ингибитора и его сродства к ферменту, т.е. чем больше концентрация ингибитора и чем больше сродство ингибитора к ферменту, тем больше степень угнетения активности фермента
Поскольку ингибитор реагирует с функциональной группой на поверхности фермента, он может воздействовать как на свободный фермент, так на весь фермент в составе ES-комплекса, причем повышение концентрации субстрата несомненно не оказывает влияние на степень ингибирования

Например:
Угнетение некоторых ферментов ионами серебра, они связывают сульфгидрильные группы фермента, но это связывание обратимо
Отравление цианидами – солями синильной к-ты
Цианиды – связываются с ферментом цитохромоксидазы, причем это связывание обратимо
При неконкурентном ингибировании значение константы Михаэлиса для ингибированного фермента не изменяется, а значение V max падает
В виду особой важности в регуляции клеточного метаболизма обычно отдельно рассматривают аллостерическое ингибирование ферментов, аллостерического ингибирование- частный случай неконкурентного ингибирования, с одной очень важной особенностью: связывание аллостерического ингибитора происходит в аллостерическом центре на основе принципа комплементарности, присоединение аллостерического ингибитора к аллостерическому центру приводит к изменению пространственной структуры фермента, затрагивается при этом структура активного центра, при этом связывание и эффективность катализа падают, и мы регистрируем падение активности фермента
Многие лекарственные препараты являются ингибиторами тех или иных ферментов в организме человека
Н-р:
Сердечный гликозид – строфантин, который используется для лечения некоторых заболеваний сердца, является неконкурентным ингибитором _____ независимой АТФ-азы в миокардиоцитах
Аллопуринол (алло – другой, иной, пуринол – спирт) используется для лечения подагры, является конкурентным ингибитором фермента сантинокиназы
Медицинская энзимология
Сведения, которые получили энзимологи, нашли широкое применение в медицинской практике, в настоящие время сформировалось 3 основных направления мед энзимологии
1. ЭНЗИМОПАТОЛОГИЯ – изменение активности ферментов при тех или иных заболеваниях
2. ЭНЗИМОДИАГНОСТИКА – изменение активности ферментов в плазме крови, эритроцитах и биоптатах
3. ЭНЗИМОТЕРАПИЯ – использование препаратов в лечебных целях
Энзимопатология
Выясняются варианты отклонения активности ферментов по сравнению с нормой, стремятся выяснить первопричину этих отклонений, а так же выяснить связь изменения активности ферментов с патогенезом, т.е. механизмов появления и развития тех или иных заболеваний
Нарушение активности ферментов, выявляемое при тех или иных патологических состояниях, получили собирательное название энзимопатии
Энзимопатии могут проявляться либо в виде:
1. Повышения активности ферментов
2. Снижения активности ферментов
3. Появление ферментов там, где они в норме не обнаруживаются или присутствуют в незначительных кол-вах (нарушение топологии)
По происхождению энзимопатии можно разделить на:
1. Первичные (врожденные)
2. Вторичные (приобретённые)
Первичные энзимопатии
Нарушение активности ферментов, обусловленные тем или иным генетическим дефектом
Варианты нарушения могут быть различными
1. Фермент может вообще не синтезироваться в к-ках (полный блок синтеза)
2. Фермент может синтезироваться или в недостаточном кол-ве, или с пониженной активностью
3. Фермент может быть лишен регуляторных св-в,
В любом из этих вариантов происходит нарушение обменных процессов, которые проявляются как заболевание
Н-р:
1. Альбинизм
2. Гликогенозы
3. Лизосомные болезни накопления
4. Фенилопировиноградная олигофрения (мы называем – фенилкетанурия)
Вторичные (приобретенные) энзимопатии – нарушение активности ферментов, развивающиеся вследствие того или иного патологического состояния
Н-р
1. Результат поступления в организм токсичных ксенобиотиков (чужеродные соединения)
Н-р, поступление цианида блокирует работу фермента цитохромоксидазы,
поступление в организм фосфоорганических соединений (то, что травили тараканов), блокируется активность фермента холиностеразы?????
поступление в организм диоксина (образуется при большом сжигании всякого г***) повышает активность фермента цитохром-(РилиВ)450 ?????????
2. Нарушение компактиннтализации????? того или иного фермента, т.е. появление фермента или же повышение его активности в тех отделах организма, где в норме его нет или он обнаруживается в незначительных кол-вах
Н-р, в гепатоцитах (основная ф-я – детоксиказия) работает огромное кол-во ферментов,
При заболеваниях печени, резко увеличивает активность ферментов в плазме крови, поскольку при этом наблюдается гибель печеночных к-к.
3. К развитию третьих заболеваний в межклеточной жидкости всегда нарастает активность протеиназ, ферментов, расщепляющих белки, в норме протеиназы в к-ках находтся в лизосомах, где занимаются расщеплением денатурированных белков
Изменение активности фермента, т.е. тот или иной вариант энзимопатий, должно своевременно выявляться. Выявление энзимопатий является основной задачей энзимодиагностики
В основе энзимодиагностики лежит простой прием: определяя активность одного из ферментов в крови, а иногда и в других биологических жидкостях, включая слюну, иногда определяют в биоптатах, т.е. взятых в стерильных условиях кусочках ткани у большого количества здоровых людей
И тем самым выясняет количественное значение нормальной активности ферментов, и активности ферментов в норме человеческой популяции, далее активность фермента определяют у больных теми или иными заболеваниями. В целом ряде случает удается установить, что активность фермента при патологии при некоторых заболеваниях меняется закономерно, т.е. активность некоторых ферментов повышается, других понижается. Поэтому определение активности ферментов можно и используют в качестве диагностического теста на ряду с другими методами диагностики
Н-р, повышение активности креатинкеназы используется очень широко в биодиагностике инфаркта миокарда
Активность каталазы в крови снижается при раке или туберкулезе
В клинической практике определяют активность более 100-ни ферментов в плазме крови, наиболее часто определяют активность аминотрансферраз, щелочных и кислых фосфотаз, креатикеназы, лактатдегидрогеназы, гистидазы, урокониназы и др
Используют энзимные диагностические тесты - о пределение активности нескольких ферментов в одной группе крови
Так же используются изоэнзимные диагностические тесты – определение изоферментов, н-р, ЛДГ, которая существует в виде 5 изоферментов, креатинкеназы которая существует в виде 3 изоферментов, щелочной фосфотазы, которая существует в виде 3 изоферментов
Энзимотерапия - использование препаратов ферментов, а так же ингибиторов и активаторов ферментов в лечебных целях
Чаще всего в клинике используется заместительно-ферментная терапия – искусственное введение в организм препарата, содержащего фермент при его недостатке в организме
Н-р, при нарушении функций панкреатической поджелудочной железы, назначается панкреатин или другие комплексы ферментов препаратов, выпускаемых под различными названиями различными фирмами
При нарушении деятельности желудка, назначают препараты, содержащие пепсин
При ранениях, особенно обширных, часть тканей вокруг раны некротизируется, эти омертвевшие ткани мешают, препятствуют заживлению раны, как правило, всегда инфицируются, для удаления некротизированных участков, мешающих процессам заживления ран, используются ферменты, расщепляющие белки, причем используется трипсин, его пришивают с помощью ковалентных связей к перевязочному материалу, он расщепляет белки некротизированной зоны и способствует очищению раны.
Наиболее перспективным направлением использования ферментов для очистки ран является использование иммобилизованных ферментов(трипсин, пришитый к перевязке) получается олеиназы из присосок щупальцев кальмара
Вполне возможны другие варианты использования ферментов:
Фермент гиалуронидаза (ладаза) используется для увеличения проницаемости кожи или слизистых, что способствует лучшему всасыванию других лекарственных в-в с поверхности этих тканей
При вирусном конъюнктивите достаточно широко используется фермент дезоксирибонуклеаза
При лечении некоторых форм лейкозов, используют в последнее время фнмент – аспорагиназа
Для ускорения растворения тромбов при тромбофлибитах, при инфаркте миокарда используют фермнт урокеназа
Лечение врожденных энзимопатий – отсутствие фермента, работающего внутри к-к, или даже внутри органелл к-к; введение фермента в кровь, мало что дает, поскольку фермент моментально выводится, в настоящее время разрабатываются способы введения фермента в к-ки с помощью рибосом, но это пока на стадии изучения
Энзимопатия относится к использованию ингибиторов и активаторов ферментов,
Н-р, при панкреатитах кровь поступает большое кол-во трипсина, и для устранения его неблагоприятного действия на белки плазмы крови назначают препарат просилол, фантрикал, фантрипин – мощные ингибиторы трипсина
При угнетении крови, данные ингибиторы протеиназ используется в стоматологии для лечения периодонтитов, дело в том что при пародонтитах резко повышается активность протеиназ, что явно формирует порочный круг, поэтому используют или электрофорез, или местное _____
Большинство лекарственных препаратов так или иначе вмешиваются в ход обменных процессов в организме, выступая в большинстве своем или как активаторы, или как ингибиторы ферментов
Еще одним направлением использования ферментов является их применение в качестве реагентов при проведении клинических лабораторных исследований: определение мочевины, лактата и ряда других констант, которые используются в лабораторной практике
Ферменты
Сходства и различия ферментов и катализаторов небиологической природы
Ферменты по ряду свойств напоминают катализаторы небиологической природы.
- ферменты катализируют только термодинамически возможные реакции, т.е. ферменты не могут создавать новых реакции, а могут только катализировать существующие
- Ферменты не расходуются в ходе реакции;
- не смещают положение равновесия катализируемой реакции, а только ускоряют его наступление, т.е. ферменты ускоряют и прямую и обратную реакцию
- Работают по принципу гетерогенного катализа

Ферменты обладают рядом свойств, отличающих их от катализаторов небиологической природы (специфические свойства ферментов)
- Ферменты-белки или некоторые РНК, получившие название рибозимы, работают в мягких условиях
(Т = 40–50°С; нейтральный pH, атмосферное давление и др.), в жестких условиях не могут работать из-за денатурации их молекул
- Очень высокая эффективность действия; превышает, как правило, на один или несколько порядков активность катализаторов небиологической природы
- Специфичность действия ферментов к типу катализируемой реакции и к структуре реагирующих соединений
- Регулируемость каталитической активности ферментов;
- Отсутствие побочных продуктов реакции. При действии катализаторов небиологической природы, наблюдается образование побочных продуктов





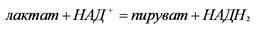

 Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп
Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп


 Малоновая к-та Оксалоацетат малат
Малоновая к-та Оксалоацетат малат




