Уско рение химических реакции
 Современный взгляд на механизм действия ферментов базируется на представлении о том, что в процессе своего функционирования ферменты вступают в прямое взаимодействие с субстратами, с образованием нестабильных энцим-субстратных комплексов (ES)
Современный взгляд на механизм действия ферментов базируется на представлении о том, что в процессе своего функционирования ферменты вступают в прямое взаимодействие с субстратами, с образованием нестабильных энцим-субстратных комплексов (ES)
• E – фермент
• S – субстрат
• P – продукт реакции
• ES и EP – нестабильные комплексы фермента с субстратом и с продуктом реакции.
Наличие ES комплексов удалось подтвердить прямыми экспериментальными наблюдениями, пространственная структура некоторых ES-комплексов изучена с помощью рентгеноструктурного анализа, а так же удалось выделить некоторые ES –комплексы в чистом виде
Функциональные центры
- Активный центр
- Регуляторные центры
- Контактные площадки
АКТИВНЫЕ ЦЕНТРЫ
Осознание того, что в большинстве случаев в образовании ES –комплекса участвует макромолекула РНК-ферментов и чаще небольшая молекула субстрата, навело на мысль, что в этом белок-лигандном взаимодействии участвует сравнительно небольшой участок поверхности фермента
Активный центр – участок поверхности фермента, ответственный за связывание субстрата и его дальнейшие превращения.
Взаимодействие фермента с субстратом этапы:
- Специфическое связывание субстрата
- Осуществление перестройки субстрата, т.е. осуществление химической реакции,
- Высвобождение продуктов реакции
Поверхность любого фермента представляет собой мозаику радикалов АК,
Взаимодействие белка с лигандом – специфичное взаимодействие, которое базируется на принципе комплементарности. Специфичность взаимодействия фермента со своим субстратом -лигандом обеспечивается комплементарностью участка поверхности субстрата и активного центра фермента
В образовании активного центра принимает участие не более 10-12 АК-ых радикалов, которые определенным образом ориентированы по отношению друг к другу, причем эти АК-ые остатки могут далеко располагаться по ходу полипептидной цепи друг от друга, но при образовании третичной структуры – нативной конформации белка-фермента, они сближаются и формируют пространственную структуру активного центра
Например, при образовании активного центра химотрипсина, принимает участие всего 4 АК-ых остатка, это гистидин-57, гистидин-40, серин-195, аспартат 102
В то же время далеко не все имеющиеся в структуре химотрипсина остатки гистидина, серина и аспартата участвуют в образовании активного центра,
например, в химотрипсине в образовании активного центра принимает участие только один остаток серина из 26 имеющихся.
Элемент активного центра
К составным элементам активного центра относят участки остова полипептидной цепи, которые удерживают АК-ые радикалы в определенном пространственном расположении друг к другу
Элемент
В активный центр входит кофактор, если фермент представляет собой сложный белок
Исключение: ионы металлов, обычно они отличаются в стабилизации третичной или четвертичной структуры
В активном центре условно выделяют 2 участка (2 центра)
1. Субстратный участок – якорная площадка – связывание субстрата лиганда
2. Каталитический участок – непосредственно обеспечивает катализ превращения субстрата (входят кофакторы)
В связывании субстрата, как и в катализе, важнейщая роль принадлежит функциональным группам, имеющимся в радикалах АК-т, которые образуют активные центры
Функциональные группы:
1. Гидроксильная группа
a. Серин –ОН
b. Тирозин –ОН
c. Треонин –ОН
2. Сульфгидринная меркаптогруппа
a. Цистеин - SН
3. Карбоксильная группа
a. Глутамата -СООН
b. Аспартата –СООН
4. Аминогруппа
a. Лизин –NН2
b. Аргинин - NН2
5. группировки CO и NH остова полипептидной цепи
важную роль в связывании субстрата могут иметь гидрофобные радикалы АК-т: валин, глицин, триптофан, метионин и фенилаланин
как правило активный центр фермента часто имеет вид углубления или щели на поверхности ферментов, у ферментов имеющих доменную структуру активный центр часто располагается в щели между прилегающими друг к другу доменами,
некоторые ферменты в своей структуре имеют несколько одинаковых протомеров, иногда в одном из них имеется одинаковые активные центры, в некоторых случаях в ферменте в пределах даже одной полипептидной цепи может быть несколько разных активных центров, такие ферменты получили название – Полифункциональные ферменты
К ним относится фермент – пальметоилситетаза – синтез пальметиновой кислоты
РЕГУЛЯТОРНЫЕ ЦЕНТРЫ
§ аллостерический центр
§ центр ковалентной модификации
§ центр белок-белкового взаимодействия
КОНТАКТНЫЕ ПЛОЩАДКИ
ферменты, имеющие в своей структуре регуляторные центры, получили название регуляторные ферменты
Не все ферменты имеют полный набор названных функциональных центров. Некоторые ферменты имеют всего один активный центр, есть ферменты, имеющие несколько активных центров, а некоторые ферменты вооружены несколькими активными центрами и несколькими регуляторными центрами.
Аллостерический центр (аллос – другой, иной) – регуляторный функциональный центр, который расположен вне активного центра
Аллостерический центр – участок на поверхности молекулы белка – фермента, образованный определенным набором АК-ых радикалов, но его трехмерная структура комплементарна не субстрату, а тому или иному низкомолекулярному леганду, который выступает в качестве регулятора активности фермента
Примеры аллостерических модуляторов:
• цAMФ
• ATФ
• НАДH
• Н3РО4
Если к аллостерическому центру присоединяется аллострерический модулятор, это приводит к изменению конформации фермента, которое сопровождается изменением пространственной структуры активного центра, поэтому изменяется эффективность катализа, причем может изменяться способность активного центра связывать субстрат, может меняться способность осуществлять непосредственное химическое превращение субстрата
• Аллостерический активатор – повышает каталитическую активность фермента.
• Аллостерический ингибитор – снижает каталитическую активность фермента.
Например: фосфофруктокиназа – катализирует фосфолирирование фруктозо-6-фосфата (одна из реакции гликолиза, т.е. окислительного расщепления белков)
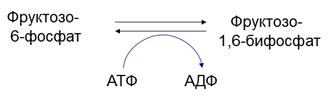
Аллостерические ингибиторы для данного фермента:
• ATФ
• Цитрат(лимонная кислота)
Аллостерический активатор:
Связывание лигандного модулятора осуществляется только за счет слабых взаимодействий: гидрофобные и электростатические, поэтому такое связывание обратимо, значит возможет возврат фермента в исходное состояние, в итоге суммарно-ферментативная активность будет в значительной степени определяться концентрацией аллостерического модулятора
Аллостерические ферменты имеют четвертичную структуру, причем обычный регуляторный центр находится на одном протомере, а активный центр на другом
В целом ряде случает один и тот же фермент имеет в своей структуре 2 и более аллостерических центра, которые комплементарны различным лигандным регуляторам
В этом случае сродство фермента к конкретному аллостерическому модулятору зависит от состояния других аллостерических центров



 Современный взгляд на механизм действия ферментов базируется на представлении о том, что в процессе своего функционирования ферменты вступают в прямое взаимодействие с субстратами, с образованием нестабильных энцим-субстратных комплексов (ES)
Современный взгляд на механизм действия ферментов базируется на представлении о том, что в процессе своего функционирования ферменты вступают в прямое взаимодействие с субстратами, с образованием нестабильных энцим-субстратных комплексов (ES)



