Моносахариды – соединения полифункциональные и обладают к тому же строго определенной конфигурацией при нескольких асимметрических атомах углерода. По этой причине необходимо представлять себе пути проведения того или иного превращения строго направленно и с сохранением конфигурации, т.е. регио- и стереоспецифично. Знание этого материала позволит понять, как проводятся синтетические исследования в ряду моносахаридов, приобретающие в последнее время все большее теоретическое и практическое применение.
Углеродная цепь моносахаридов содержит большое число электро-отрицательных групп. Это приводит к уменьшению прочности углерод-углеродных связей, которые оказываются неустойчивыми к действию щелочей и окислителей.
Гидроксильные группы в молекулах моносахаридов обладают значительно более сильными кислотными свойствами, чем в спиртах. Это может объясняться как наличием заместителей, обладающих отрицательным индуктивным эффектом (гидроксильная и карбонильная группы), так и способностью гидроксогрупп стабилизировать соответствующие анионы за счет образования внутримолекулярных водородных связей. Этим объясняется способность моносахаридов образовывать алкоголяты (сахараты) не только со щелочными металлами, но и с их гидроксидами, а также с гидроксидами щелочно-земельных металлов.
Важно отметить, что под действием оснований альдозы и кетозы, являясь по сути альдолями, подвергаются наряду со многими другими превращениями усложнению (конденсации типа альдольной) и деградации (распад типа ретроальдольного) углеродной цепи.
Моносахариды дают реакцию серебряного зеркала при обработке их аммиачным раствором оксида серебра. В случае кетоз это объясняется тем, что в присутствии оснований они способны к изомеризации (эпимеризации), в результате которой генерируется альдегидная форма.
Для качественного обнаружения моносахаридов используют также комплекс меди (II) с винной кислотой, образующийся при взаимодействии последней с сульфатом меди (II) в щелочном растворе. При обработке этим комплексом (так называемый реактив Фелинга) альдоз, а также способных к эпимеризации кетоз выделяется красный осадок оксида меди (I) и образуется сложная смесь продуктов окисления.
В целях селективного окисления альдегидной группы в альдозах может быть использована бромная вода или разбавленная азотная кислота, при этом образуюся альдоновые кислоты:
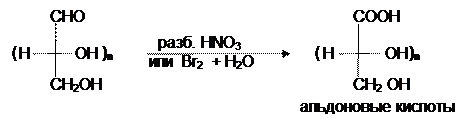
Окислители со средней окисляющей способностью, например, концентрированная азотная кислота, превращают в карбоксильную группу не только альдегидную, но и первичноспиртовую группы, давая при этом сахарные (альдаровые) кислоты:

Но, если проводить окисление концентрированной азотной кислотой альдозы с защищенной альдегидной группой, то после снятия защиты можно получить полиоксиальдегидокарбоновые или уроновые кислоты:
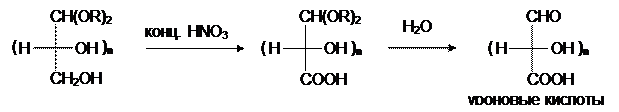
Уроновые кислоты образуются в живых организмах при окислении гликозидов и участвуют в процессах детоксикации у теплокровных (например, фенол выводится из организма в виде сложного эфира с глюкуроновой кислотой).
Окисление HJO4, характерное для вицинальных диолов, оксиальдегидов, оксикетонов и приводящее к смеси альдегидов или кислот, для моноз протекает так же и дает смесь формальдегида с муравьиной кислотой:
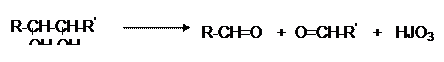
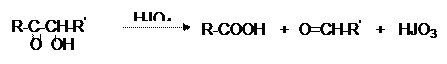
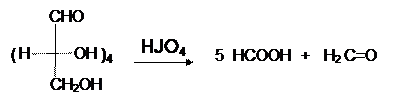
 Моносахариды восстанавливаются в соответствующие полиолы, называемые сахарными спиртами, под действием боргидрида натрия или водородом в присутствии катализаторов (Pt, Pd, Ni):
Моносахариды восстанавливаются в соответствующие полиолы, называемые сахарными спиртами, под действием боргидрида натрия или водородом в присутствии катализаторов (Pt, Pd, Ni):
Из глюкозы получается сорбит (гексит), из маннозы – маннит (гексит), из галактозы – дульцит (гексит), из ксилозы – ксилит (пентит) и т.п.
Ксилоза Ксилит
Следует иметь ввиду, что при восстановлении альдоз образуется один спирт, а при восстановлении кетоз получаются два стереомерных полиола. Так, при восстановлении фруктозы образуются сорбит и маннит.
Ксилит и дульцит используются вместо сахарозы в рационе диабетиков (они обладают сладким вкусом, но не вовлекаются в углеводный обмен и нетоксичны, как сахарин), а сорбит служит исходным веществом в синтезе аскорбиновой кислоты (см. ниже).
Если гидрирование проводить при нагревании, то это приводит к расщеплению углеродной цепи и образованию этиленгликоля, глицерина и других полиолов.
При действии на альдозы бензил- или этилмеркаптанов в кислой среде образуются соответствующие меркаптали (дитиоацетали), устойчивые в нейтральной, щелочной и слабокислой средах:
Получение меркапталей может быть использовано для защиты карбонильной группы при модификации гидроксильной. Тиоацетальные связи легко распадаются под действием брома в разбавленной уксусной кислоте.
Важное значение имеют реакции моносахаридов, в которых затрагивается не только карбонильная группа, но и гидроксил у ближнего атома углерода. К таким реакциям относится взаимодействие моносахаридов с фенилгидразином. Эта реакция протекает по механизму нуклеофильного присоединения по карбонильной группе и приводит к образованию фенилгидразона. При нагревании его с избытком фенилгидразина осуществляется перегруппировка, на первой стадии которой происходит дегидрирование соседней спиртовой группы и одновременно гидрогенолиз фенилгидразинной группировки до анилина и соответствующего имина. Последний, будучи a-иминокарбинольным соединением, реагирует с избытком фенилгидразина с выделением аммиака и воды и образованием бис-фенилгидразона соответствующего a-дикарбонильного соединения. Такие соединения называют озазонами:
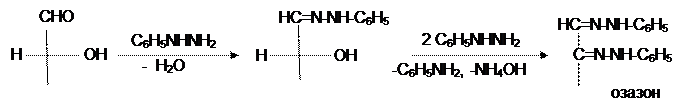
При этом на строение полученного озазона не влияет конфигурация у соседнего с бывшей карбонильной группой асимметрического атома углерода. Поэтому из маннозы и фруктозы можно получить тот же озазон, что и из глюкозы.
Если же полученный озазон подвергнуть кислотному гидролизу, а затем провести мягкое окисление, то из альдозы можно получить кетозу. Так, в промышленности из глюкозы через озазон получают фруктозу:
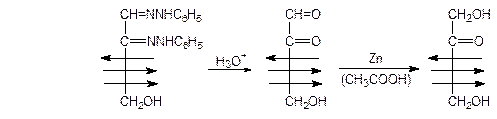
Кетоальдегид фруктоза
(озон)
Несмотря на большую реакционную способность карбонильной группы в молекуле моносахарида, возможно проведение реакций по первичноспиртовой группе. Так, при обработке трифенилхлорметаном (сокращенно тритилхлоридом) в присутствии пиридина первичные спиртовые группы всех моносахаридов образуют соответствующие трифенилметиловые (тритиловые) эфиры; в мягких условиях другие гидроксильные группы при этом не затрагиваются.
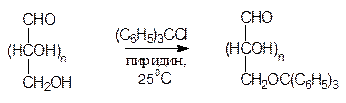
Эта реакция широко используется для защиты первичноспиртовых групп в молекулах моносахаридов при модификациях других фрагментов. Трифенилметильный радикал является хорошей защитной группой, поскольку трифенилметиловые эфиры устойчивы в нейтральной и щелочной средах и легко расщепляются в кислой среде (снятие защиты).
Б. Реакции циклических форм
Рассмотренные выше свойства моносахаридов не противоречат их строению как полиоксиальдегидов и полиоксикетонов. Однако ряд свойств пентоз и гексоз приведенные формулы объяснить не могли. Так, оказалось, что пентозы и гексозы в отличие от обычных альдегидов не образуют бисульфитных производных. Кроме того, полные метиловые эфиры, приготовленные из пентоз и гексоз действием диметилсульфата и щелочи (или иодистого метила в присутствии оксида серебра), не давали характерного осадка с реактивом Фелинга, а также реакции серебряного зеркала, типичных для альдегидов.
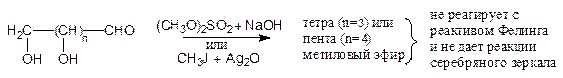
 В тоже время гидролиз этих эфиров разбавленным раствором кислоты, т.е. в условиях, в которых простые эфиры устойчивы, приводил к отщеплению одной метильной группы. Так, из тетраметилового эфира, приготовленного из пентоз, получался триметиловый эфир, а из пентаметилового, приготовленного из гексоз, – тетраметиловый:
В тоже время гидролиз этих эфиров разбавленным раствором кислоты, т.е. в условиях, в которых простые эфиры устойчивы, приводил к отщеплению одной метильной группы. Так, из тетраметилового эфира, приготовленного из пентоз, получался триметиловый эфир, а из пентаметилового, приготовленного из гексоз, – тетраметиловый:
Продукты такого «монодеметилирования» полных метиловых эфиров пентоз и гексоз уже давали реакцию серебряного зеркала.
Таким образом, было установлено, что какая-то одна из гидроксогрупп в молекулах пентоз и гексоз обладает особыми свойствами. Особые свойства этой гидроксогруппы явились следствием того, что она внутримолекулярно взаимодействует с карбонильной группой, образуя циклический полуацеталь (кольчато-цепная таутомерия). Эта гидроксогруппа также и называется, полуацетальной.
 С ее участием легко образуются метиловые эфиры. Для получения последних соответствующий моносахарид достаточно обработать метиловым спиртом в присутствии 3%-ного хлористого водорода:
С ее участием легко образуются метиловые эфиры. Для получения последних соответствующий моносахарид достаточно обработать метиловым спиртом в присутствии 3%-ного хлористого водорода:
Полученные таким образом производные пентоз и гексоз называют метилгликозидами; полуацетальный гидроксил, который легко замещается – гликозидным гидроксилом; атом углерода С1, у которого произошло замещение – гликозидным центром; вступающий заместитель – агликоном.
Легкость замещения гликозидного гидроксила используется для получения гликозидов самого разнообразного строения. Так, при обработке пентоз и гексоз аминами, не являющихся сильными основаниями (иначе пойдет эпимеризация), происходит образование соответствующих N-гликозидов. Например:
Фрагмент молекулы
моносахарида
Здесь агликонами являются аминная и фениламинная группы.
Остаток моносахарида сообщает связанному с ней агликону легкую растворимость в воде, делает его способным функционировать в живой (животной или растительной) клетке.
В связи с этим становится понятным чрезвычайно большая распространенность гликозидов в природе. Примерами могут служить компоненты нуклеиновых кислот – нуклеозиды; действующее начало горчичного масла – глюкоиберин, арбутин, используемые в цветной фотографии, и многие другие. В молекулы моносахаридов в качестве агликонов иногда вводят физиологически активные вещества, что облегчает их применение в медицине (усвояемость, возможность использования растворов).
Контрольные вопросы
1. Какими реакциями можно доказать наличие в молекуле глюкозы альдегидной и гидроксильных групп.
2. Что произойдет при нагревании пентаметилглюкозы и пентаацетилгалактозы при нагревании их с разбавленной серной кислотой.
3. Какие продукты образуются при окислении маннозы, при ее восстановлении, при взаимодействии с гидроксиламином, с избытком фенилгидразина.
4. Какиe два моносахарида дадут тот же озазон, что и L-галактоза.
5. Напишите схемы получения следующих гликозидов: а) метил-b-D-глюко-фуранозида; б) этил-a-D-галактопиранозида; в) изопропил-b-D-фруктопирано-зида, г) о-(оксиметил)фенил-b-D-глюкопиранозида (салицина), д) метил-b-D-рибофуранозида.
6. Нагревание пентоз с разбавленной серной кислотой приводит к образованию фурфурола. Напишите уравнение реакции.
7. Напишите проекционные формулы Фишера всех D-альдогексоз, которые при восстановлении образуют оптически неактивные многоатомные спирты.
8. Какой продукт получается при окислении азотной кислотой D-галактозы? Почему полученное соединение не обладает оптической активностью.
Тестовые задания
1. Какое из соединений является a-D-рибопиранозой?








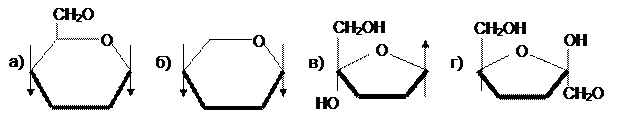
2. Образование соединения синего цвета при взаимодействии глюкозы (раствор) с гидроксидом меди (II) с образованием глюконата меди (II) обусловлено наличием в ее молекуле:
а) одной ОН-группы б) s- и p-связей
в) нескольких ОН-групп г) альдегидной группы
3. Какому моносахариду в открытой форме соответствует структура следующего циклического полуацеталя:

4. Углеводом, входящим в состав РНК, является:
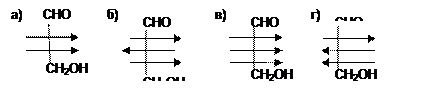
5. D-глюкоза и D-галактоза являются между собой:
а) эпимерами б) диастереомерами в) гомологами г) изомерами
6. Метилгликозид можно получить при взаимодействии:
а) глюкозы с ангидридом уксусной кислоты
б) галактозы с метиловым спиртом
в) крахмала с метилхлоридом
г) глюконовой кислоты с метанолом
7. Озазон – это продукт взаимодействия углевода с:
а) гидроксиамином б) гидразином в) вторичным амином г) HCN
8. Какая структура соответствует метил-a–D-глюкопиранозиду:
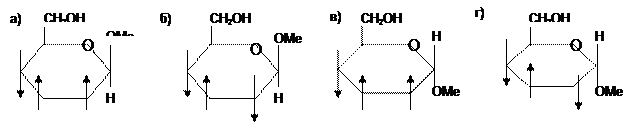
9. Какой из реагентов не вызывает ответной реакции у глюкозы?
а) NH2OH б) Cu(OH)2 в) NaHSO3 г) Ag(NH3)2OH
10. Какой из моносахаридов входит в состав нуклеиновых кислот?
а) a-D-глюкопираноза б) b-D-фруктофураноза
в) a-L-маннопираноза г) b-D-рибофураноза
11. Шестиатомный спирт сорбит образуется при взаимодействии глюкозы с?
а) уксусной кислотой б) Ag(NH3)2OH в) этанолом г) водородом
12. При растворении сахаров с течением времени происходит изменение угла вращения до определенной равновесной величины. Это явление называется:
а) поляризация б) конформационная изомерия
в) мутаротация г) ионизация
13. Как называются два оптических изомера по отношению друг к другу:

а) эпимеры б) цис-транс-изомеры
в) энантиомеры г) диастереомеры
14. Реакция с каким веществом используется для доказательства того, что глюкоза – пятиатомный спирт?
а) Cu(OH)2 б) CH3COOH в) Ag2O г) NaHSO3
15. Продуктом реакции является:


а) метил-a-D-галактопиранозид
б) метил-b-D-галактопиранозид
в) метил-2,3,4,6-тетра-О-метил-a-D-галактопиранозид
г) метил-2,3,4,6-тетра-О-метил-b-D-галактопиранозид
16. Названию 2,3,6-три-О-метил-a-D-глюкопиранозе соответствует структура:

17. Альдозу от изомерной ей кетозы можно отличить по реакции с:
а) Н2 б) NaHSO3 в) Ag(NH3)2OH г) C6H5NHNH2
18. Какое из приведенных соединений не является компонентом таутомерного равновесия D-рибозы:
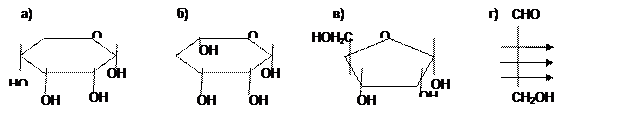
19. Фруктоза дает реакцию серебряного зеркала, так как:
а) возможна цикло-оксо-таутомерия б) возможна кето-енольная таутомерия в) содержится кето-группа г) содержится виц-диольный фрагмент
20. Фруктоза является:
а) кетогексозой б) кетопентозой в) альдогексозой г) дисахаридом
21. a– и b–глюкоза – это:
а) оптические изомеры б) структурные изомеры
в) олигосахариды г) цис-транс-изомеры
22. Какая функциональная группа присутствует в циклической форме глюкозы:
а) гидроксильная б) альдегидная в) карбоксильная г) карбонильная
23. Какая формула отвечает L-маннозе
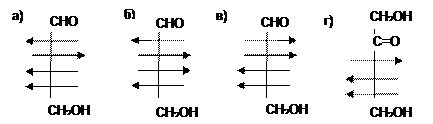
24. Изомерами являются:
а) 2-метилпропанол-1 и бутанол-1 б) D- и L-аланин
в) метанол и метаналь г) глюкоза и фруктоза
25. Какая характеристика не соответствует глюкозе:
а) имеет неразветвленный углеродный скелет
б) содержит кетонную группу
в) в циклической форме имеет 4 асимметрических центра
г) окисляется Cu(OH)2 при нагревании
26. Какая проекционная формула соответствует R-конфигурации глицеринового альдегида:
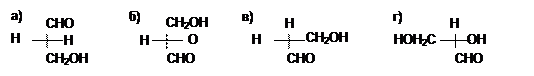
27. Конечным продуктом цепочки превращений является:
C6H5NHNH2 H2O Zn/CH3COOH


 D-глюкоза … ….
D-глюкоза … ….
(избыток) H+
а) крахмал б) фенилозазон D-глюкозы в) фруктоза г) сахароза
28. Какие схемы реакций показывают наличие в глюкозе альдегидной группы?
 а) С6Н12О6 + Cu(OH)2 (комн. t)
а) С6Н12О6 + Cu(OH)2 (комн. t)
 б) С6Н12О6 + HNO3
б) С6Н12О6 + HNO3
 в) С6Н12О6 + Ag(NH3)2OH
в) С6Н12О6 + Ag(NH3)2OH
 г) С6Н12О6 + Cu(OH)2 (высокая t)
г) С6Н12О6 + Cu(OH)2 (высокая t)
29. Какие моносахариды относятся к типу альдоз:
а) глюкоза б) рибоза в) дезоксирибоза г) сорбит
30. Сколько асимметрических атомов углерода в молекуле b-D-рибофуранозы:
а) один б) два в) три г) четыре



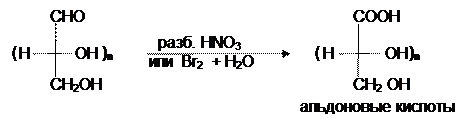

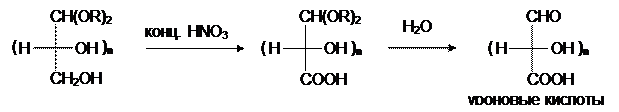
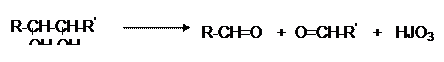
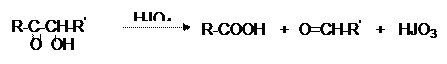
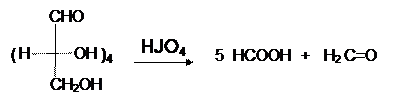
 Моносахариды восстанавливаются в соответствующие полиолы, называемые сахарными спиртами, под действием боргидрида натрия или водородом в присутствии катализаторов (Pt, Pd, Ni):
Моносахариды восстанавливаются в соответствующие полиолы, называемые сахарными спиртами, под действием боргидрида натрия или водородом в присутствии катализаторов (Pt, Pd, Ni):
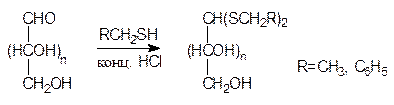
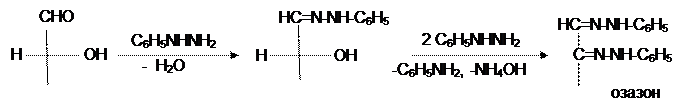
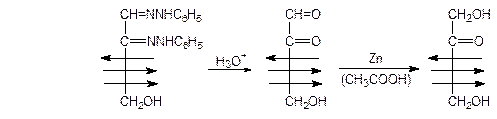
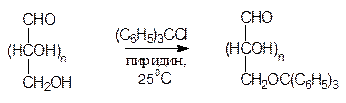
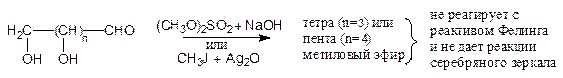
 В тоже время гидролиз этих эфиров разбавленным раствором кислоты, т.е. в условиях, в которых простые эфиры устойчивы, приводил к отщеплению одной метильной группы. Так, из тетраметилового эфира, приготовленного из пентоз, получался триметиловый эфир, а из пентаметилового, приготовленного из гексоз, – тетраметиловый:
В тоже время гидролиз этих эфиров разбавленным раствором кислоты, т.е. в условиях, в которых простые эфиры устойчивы, приводил к отщеплению одной метильной группы. Так, из тетраметилового эфира, приготовленного из пентоз, получался триметиловый эфир, а из пентаметилового, приготовленного из гексоз, – тетраметиловый: С ее участием легко образуются метиловые эфиры. Для получения последних соответствующий моносахарид достаточно обработать метиловым спиртом в присутствии 3%-ного хлористого водорода:
С ее участием легко образуются метиловые эфиры. Для получения последних соответствующий моносахарид достаточно обработать метиловым спиртом в присутствии 3%-ного хлористого водорода: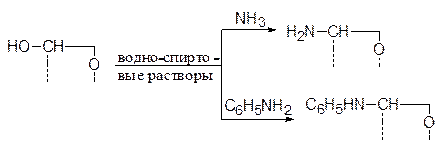




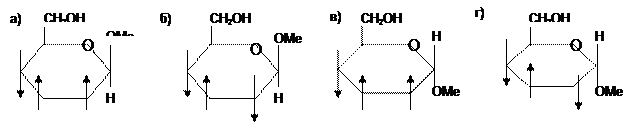
 а) эпимеры б) цис-транс-изомеры
а) эпимеры б) цис-транс-изомеры





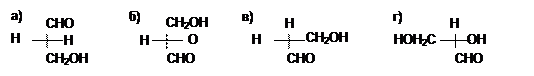


 D-глюкоза … ….
D-глюкоза … …. а) С6Н12О6 + Cu(OH)2 (комн. t)
а) С6Н12О6 + Cu(OH)2 (комн. t) б) С6Н12О6 + HNO3
б) С6Н12О6 + HNO3  в) С6Н12О6 + Ag(NH3)2OH
в) С6Н12О6 + Ag(NH3)2OH  г) С6Н12О6 + Cu(OH)2 (высокая t)
г) С6Н12О6 + Cu(OH)2 (высокая t)

