

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Материальный баланс РИВ
Реактор идеального вытеснения (РИВ) - такой реактор, в котором отсутствуют продольное и радиальное перемещение, а осуществляется только диффузия, концентрация реагентов изменяется в результате химического превращения.
Рассмотрим реакцию aA+ bB=cC+dD, за начальные условия примем V=const, zА°= const, хА=0, через некоторое время степень превращения в реакторе станет равной хА+dxA, тогда = V·zA°·(1-xA)·MA/22.4, где
GFPA - физический приход, кг/с; V-объем смеси, м³/с; 22.4-молярный объем, м³/кмоль; MA -молярная масса вещества А, кг/кмоль; zA°(1-xA) - концентрация оставшегося реагента, кг/кмоль.= V·zA°·(1-xA)dxA·MA/22.4 -физический расход, кг/с= U·dV·MA -количество вещества А, которое прореагировало в результате химической реакции, где U -скорость реакции, кмоль/ м³с; dV-изменение объема смеси, м³/с.
По закону сохранения действующих масс - приход равен расходу вещества в ходе реакции:= GFRA + GCRA, или·zA°/22.4 - V·zA°·хА /22.4 = U·dV + V·zA°/22.4 - V·zA°· хА/22.4 - V·zA° dхА/22.4,
сократим и получим уравнение материального баланса для реактора идеального вытеснения:·zA° dхА/22.4 = UdV.
Обозначим, что Vr- объем реактора, м³; тогда Vr = Vt, где V-расход смеси, м³/с; t-время, с.
Изменение объема реактора: dVr = Vdt, т.к. V=const, то zA° dxA/22.4 = Udt, преобразуем и получим /dt = U·22.4/ zA° - уравнение МБ в дифференциальной форме.
Время, необходимое для достижения заданной степени превращения найдем по формуле, отсюда следует, что чем больше скорость, тем меньше время:
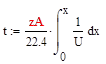
Тепловой баланс РИВ
Рассмотрим реакцию, протекающую без изменения числа молей:
+ bB = cC+dD,
Т0 - начальная температура на входе в реактор,град; хА=0 - начальная степень превращения, х-конечная степень превращения; Т-температура в реакторе, град; Т+dT- изменение температуры в ходе реакции, град; V=const - расход смеси считаем постоянным, м³/с; zA° - концентрация вещества А, кг/кмоль и удельная теплоемкость Cp, Дж/(м3·град), также постоянные величины, тогда
|
|
HFP-энергия, приносимая исходной газовой смесью в объем реактора, кДж/с:
= V·Cp·(T-273),
= V·Cp·(T+dT-273) - энергия(теплота) на выходе из реактора, кДж/с;СR = U·HUCR·dV -тепловой эффект химической реакции, кДж/с.скорость реакции, кмоль/м³·с; HUCR - удельный тепловой эффект реакции, кДж/кмоль; dV- изменение расхода смеси, м³/с.
Тогда теплота прихода равна: HP = HFP + HСR, кДж/с.
Теплота расхода будет равна: HR = HTO + HFR, кДж/с.
HTO = K·F·ΔT·dV - энергия теплообмена, кДж/с, где К-коэффициент теплопередачи, кДж/(м²·град·с); F- удельная поверхность в единице реакционного объема, м²/м³; ΔT- изменение температуры, град; dV- элементарный реакционный объем, м³.
По закону сохранения энергии: HP= HR, т.е энергия прихода равна энергии расхода, тогда·Cp·T - V·Cp·273 + U·HUCR·dV = V·Cp·T + V·Cp·dT - V·Cp·273 + K·F·dT·dV, сократив, получим:·HUCR·dV = V·Cp·dT + K·F·dT·dV - уравнение политермы, показывающее, что количество выделившейся теплоты равно изменению температуры и теплоте, отобранной холодильником. В адиабатическом режиме отсутствует теплообмен с окружающей средой, теплота идет на изменение теплосодержания химической смеси, значит:= 22.4·Cp·dT/zA°, кДж/кмоль;
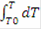
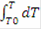 = zA°·HUCR/(22.4·Cp)
= zA°·HUCR/(22.4·Cp) 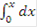
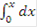 - уравнение адиабаты в интегральной форме, проинтегрируем и получим:
- уравнение адиабаты в интегральной форме, проинтегрируем и получим:
Т = Т0 ±  (zA°·HUCR/(22.4·Cp))x - уравнение адиабаты, здесь знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.= zA°·HUCR/(22.4·Cp) - адиабатический коэффициент, показывающий на сколько изменится температура реакции смешения, если ключевое вещество полностью прореагирует, град.
(zA°·HUCR/(22.4·Cp))x - уравнение адиабаты, здесь знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.= zA°·HUCR/(22.4·Cp) - адиабатический коэффициент, показывающий на сколько изменится температура реакции смешения, если ключевое вещество полностью прореагирует, град.
Подставив выражение для Ad в уравнение адиабаты, получим T = Т0 ± Ad·x. 
Система уравнений МБ и ТБ:
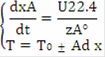
Решение системы позволит найти максимальное значение степени превращения, например, для реакции первого порядка, получим:= k·PA = k·P·zA = k·P·zA°·(1-x) - кинетическое уравнение реакции 1-го порядка
|
|
/dt= 22.4·k·P·(1-x),
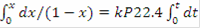
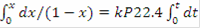 , после интегрирования получим:= 1-
, после интегрирования получим:= 1- 
 - уравнение степени превращения для необратимой реакции 1-го порядка.
- уравнение степени превращения для необратимой реакции 1-го порядка.
Материальный баланс РПС
Реактор полного смешения (РПС) - реактор, в котором вновь поступающая порция реагента быстро распространяется по всему объему реактора за счет перемешивания, и концентрация реагента остается постоянной в любой точке реактора.
Рассмотрим реакцию aA+ bB = cC+dD, примем V=const - объем смеси, zА° = const, хА = 0, хк - начальная и конечная степень превращения соответственно,Vr = const -объем реактора, тогда = V·zA°·xA·MA/22.4 - физический приход в реактор, кг/с; V - расход смеси, м³/с; zA° - концентрация реагента А, кг/кмоль; Vm = 22.4 - молярный объем, м³/кмоль.= V·zA°·(1-xA)·dxA·MA/22.4 -физический расход, кг/с= U·Vr·MA - прореагировало в реакторе в ходе химической реакции, кг/с, где Vr-объем реактора, м³.
По закону сохранения действующих масс - приход равен расходу вещества в ходе реакции:
= GFRA + GCRA, кг/с
·zA°/22.4 = V·zA°/22.4 - V·zA°·хк/22.4 + U·Vr, сократим:·zA°·хк/22.4 = U·Vr, учитывая, что Vr = Vt - объем реактора, м³, получим
хк/t = 22.4·U/zA° - уравнение материального баланса РПС.
Из уравнения МБ следует, что чем больше скорость реакции, тем ниже время ее протекания и объем реактора.
Тепловой баланс РПС
Рассмотрим реакцию экзотермическую без изменения числа молей:
+ bB=cC+dD
Т0 - начальная температура на входе в реактор,град; Тк - конечная температура на выходе из реактора, град; хА=0 - начальная степень превращения, хк -конечная степень превращения; Т-температура в реакторе, град; V=const - расход смеси считаем постоянным, м³/с; zA° -концентрация вещества А, кг/кмоль; Cp- удельная теплоемкость, Дж/моль град, также постоянные величины; F- поверхность теплообмена на всем объеме реактора, м²/м³; Cp- удельная теплоемкость, Дж/(моль град), тогда= V·Cp·(T0-273), кДж/с - теплота физического прихода;= V·Cp·(Tк -273) - энергия (теплота) физического расхода, кДж/с;СR = U·∆HUCR·Vr - тепловой эффект химической реакции, кДж/с;= K·F·∆T - энергия теплообмена, кДж/с.
По закону сохранения энергии составим уравнение теплового баланса:
HFP + HСR = HFR + HTO
·Cp·T0 - V·Cp·273 + U·∆HUCR·Vr = V·Cp·Tк - V·Cp·273 + K·F·∆T, сократим·HUCR·Vr = V·Cp·(Tк - T0) + K·F·∆T - уравнение политермы.= хк·zA°/(22.4·t) - скорость реакции, кмоль/(м³с), Vr = Vt - объем реактора, м³, подставим в уравнение политермы:
|
|
хк·zA°·Vt∆HUCR /(22.4·t) = V·Cp·(Tк - T0) + K·F·∆T
В данном случае режим адиабатический, значит теплообмен с окружающей средой отсутствует, и слагаемое K·F·∆T пропадает, тогда
хк·∆HUCR = 22.4·Cp·(Tк - T0)/ zA°, отсюдак = T0 ±  zA°·∆HUCR·хк/(22.4·Ср) - уравнение адиабаты РПС, где знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.
zA°·∆HUCR·хк/(22.4·Ср) - уравнение адиабаты РПС, где знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.
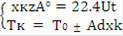
Совместное решение уравнений МБ и ТБ для РПС позволяет найти конечную степень превращения: 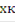
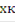 =
= 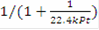
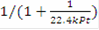
Рассмотрим необратимую реакцию первого порядка, тогда = k·PA = k·P·zA = k·P·zA°·(1 - x) -кинетическое уравнение реакции 1-го порядка, подставим в уравнение МБ и ТБ:
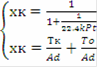
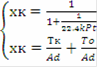
Для обратимой реакции первого порядка A ⇄ 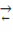 D: = k1·PA - k2·PD = k1·P·zA - k2·P·zD = k1·P·zA°·(1-xk) - k2·P·zA°·xk = k1·P·zA°·(1-(k2+k1)xk/k1)= 0 при условии равновесия, тогда k1 = (k1 + k2)·xr, значит U = k1·P·zA°·(1-xk/xr), выразив хк, получим: хк = xr·22.4·t·k1·P/(xr + 22.4·t·k1·P). Система уравнений МБ и ТБ для обратимой реакции примет вид:
D: = k1·PA - k2·PD = k1·P·zA - k2·P·zD = k1·P·zA°·(1-xk) - k2·P·zA°·xk = k1·P·zA°·(1-(k2+k1)xk/k1)= 0 при условии равновесия, тогда k1 = (k1 + k2)·xr, значит U = k1·P·zA°·(1-xk/xr), выразив хк, получим: хк = xr·22.4·t·k1·P/(xr + 22.4·t·k1·P). Система уравнений МБ и ТБ для обратимой реакции примет вид:


ПРОГРАММЫ
|
|
|

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!