ВВЕДЕНИЕ
Под технологией в широком значении этого слова понимают научное описание методов и средств производства в какой-то отрасли промышленности. Процессы механической технологии основаны преимущественно на механическом воздействии, изменяющем внешний вид или физические свойства обрабатываемых веществ, но не влияющем на их химический состав. Процессы химической технологии включают химическую переработку сырья, основанную на сложных по природе химических и физико-химических явлениях.
Таким образом, химическая технология - это наука о наиболее экономичных и экологически обоснованных методах химической переработки сырых природных материалов в предметы потребления и средства производства.
Современная химическая технология, используя достижения естественных и технических наук, изучает и разрабатывает совокупность физических и химических процессов, машин и аппаратов, оптимальные пути осуществления этих процессов и управления ими при промышленном производстве различных веществ, продуктов, материалов.
Химическая технология базируется на химических науках, таких, как физическая химия, химическая термодинамика и химическая кинетика, а также развивает закономерности этих наук в приложении к крупномасштабным промышленным процессам, она тесно связана с экономикой, физикой, математикой, кибернетикой, прикладной механикой, другими техническими науками.
По мере развития химической промышленности содержание химической технологии обогащалось новыми сведениями, закономерностями. Значительный прогресс науки в последние годы связан с применением современных вычислительных средств для решения теоретических и прикладных задач. Применение вычислительной техники не только позволило ставить и решать сложные задачи, но и обогатило химическую технологию новыми подходами к их решению, связанными с математическим моделированием и системными исследованиями, также развивается кибернетика химико-технологических процессов. Новые открытия тесно связывают науку с производством, что позволяет более рационально использовать сырье и топливно-энергетические ресурсы, создавать безотходные производства, где процессы протекают с высокими скоростями в оптимальных условиях с получением продуктов высокого качества.
Химическая технология играет важную роль в химической промышленности, которая является одной из ведущих отраслей народного хозяйства, ей принадлежит определяющая роль в ускорении научно-технического прогресса, повышении эффективности общественного производства и, материального и культурного уровня жизни людей.
Химическая технология является материальной базой химизации народного хозяйства. Цель химизации - интенсификация и повышение эффективности промышленного и сельскохозяйственного производства, улучшение условий труда и повышение уровня медицинского, культурного и бытового обслуживания населения. Химизация обеспечивает: совершенствование структуры сырьевого баланса, снижение затрат на производство и эксплуатацию изделий, совершенствование топливно-энергетической базы путем интенсификации процессов и комплексной переработки нефти, природного газа, сланцев и угля, использования теплоты реакций, усиление охраны окружающей среды.
Материальной основой всех химико-технологических процессов являются машины и аппараты химических производств. Эффективность химического производства обеспечивается за счет систематического повышения его технического уровня на основе использования мощных, непрерывных, малостадийных и менее энергоемких аппаратов. Так, выбор и расчет аппарата, ректификационной колонны, реактора является важным критерием, определяющим технологический процесс.
Химико-технологический процесс представляет собой совокупность операций, позволяющих получить целевой продукт из исходного сырья. Скорость всех этапов операций будет зависеть от температурного режима, наличия примесей, а самое главное - от гидромеханических, тепло- и массообменных, химических процессов, протекающих в аппарате. Анализ единичных процессов, их взаимного влияния позволяет разработать технологический режим и рассчитать аппараты, реакторы, необходимые для проведения этих процессов в оптимальных условиях (сочетание основных параметров - температуры, давления, состав исходной реакционной смеси, катализаторов), т.е. таких, которые позволяют получить наибольший выход продукта с высокой скоростью или обеспечить наименьшую себестоимость.
Разработка и построение рациональной технологической схемы, а соответственно и выбор реактора, аппарата - важная задача химической технологии.
Материальный баланс РИВ
Реактор идеального вытеснения (РИВ) - такой реактор, в котором отсутствуют продольное и радиальное перемещение, а осуществляется только диффузия, концентрация реагентов изменяется в результате химического превращения.
Рассмотрим реакцию aA+ bB=cC+dD, за начальные условия примем V=const, zА°= const, хА=0, через некоторое время степень превращения в реакторе станет равной хА+dxA, тогда = V·zA°·(1-xA)·MA/22.4, где
GFPA - физический приход, кг/с; V-объем смеси, м³/с; 22.4-молярный объем, м³/кмоль; MA -молярная масса вещества А, кг/кмоль; zA°(1-xA) - концентрация оставшегося реагента, кг/кмоль.= V·zA°·(1-xA)dxA·MA/22.4 -физический расход, кг/с= U·dV·MA -количество вещества А, которое прореагировало в результате химической реакции, где U -скорость реакции, кмоль/ м³с; dV-изменение объема смеси, м³/с.
По закону сохранения действующих масс - приход равен расходу вещества в ходе реакции:= GFRA + GCRA, или·zA°/22.4 - V·zA°·хА /22.4 = U·dV + V·zA°/22.4 - V·zA°· хА/22.4 - V·zA° dхА/22.4,
сократим и получим уравнение материального баланса для реактора идеального вытеснения:·zA° dхА/22.4 = UdV.
Обозначим, что Vr- объем реактора, м³; тогда Vr = Vt, где V-расход смеси, м³/с; t-время, с.
Изменение объема реактора: dVr = Vdt, т.к. V=const, то zA° dxA/22.4 = Udt, преобразуем и получим /dt = U·22.4/ zA° - уравнение МБ в дифференциальной форме.
Время, необходимое для достижения заданной степени превращения найдем по формуле, отсюда следует, что чем больше скорость, тем меньше время:
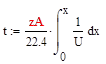
Тепловой баланс РИВ
Рассмотрим реакцию, протекающую без изменения числа молей:
+ bB = cC+dD,
Т0 - начальная температура на входе в реактор,град; хА=0 - начальная степень превращения, х-конечная степень превращения; Т-температура в реакторе, град; Т+dT- изменение температуры в ходе реакции, град; V=const - расход смеси считаем постоянным, м³/с; zA° - концентрация вещества А, кг/кмоль и удельная теплоемкость Cp, Дж/(м3·град), также постоянные величины, тогда
HFP-энергия, приносимая исходной газовой смесью в объем реактора, кДж/с:
= V·Cp·(T-273),
= V·Cp·(T+dT-273) - энергия(теплота) на выходе из реактора, кДж/с;СR = U·HUCR·dV -тепловой эффект химической реакции, кДж/с.скорость реакции, кмоль/м³·с; HUCR - удельный тепловой эффект реакции, кДж/кмоль; dV- изменение расхода смеси, м³/с.
Тогда теплота прихода равна: HP = HFP + HСR, кДж/с.
Теплота расхода будет равна: HR = HTO + HFR, кДж/с.
HTO = K·F·ΔT·dV - энергия теплообмена, кДж/с, где К-коэффициент теплопередачи, кДж/(м²·град·с); F- удельная поверхность в единице реакционного объема, м²/м³; ΔT- изменение температуры, град; dV- элементарный реакционный объем, м³.
По закону сохранения энергии: HP= HR, т.е энергия прихода равна энергии расхода, тогда·Cp·T - V·Cp·273 + U·HUCR·dV = V·Cp·T + V·Cp·dT - V·Cp·273 + K·F·dT·dV, сократив, получим:·HUCR·dV = V·Cp·dT + K·F·dT·dV - уравнение политермы, показывающее, что количество выделившейся теплоты равно изменению температуры и теплоте, отобранной холодильником. В адиабатическом режиме отсутствует теплообмен с окружающей средой, теплота идет на изменение теплосодержания химической смеси, значит:= 22.4·Cp·dT/zA°, кДж/кмоль;
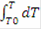
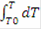 = zA°·HUCR/(22.4·Cp)
= zA°·HUCR/(22.4·Cp) 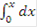
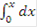 - уравнение адиабаты в интегральной форме, проинтегрируем и получим:
- уравнение адиабаты в интегральной форме, проинтегрируем и получим:
Т = Т0 ±  (zA°·HUCR/(22.4·Cp))x - уравнение адиабаты, здесь знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.= zA°·HUCR/(22.4·Cp) - адиабатический коэффициент, показывающий на сколько изменится температура реакции смешения, если ключевое вещество полностью прореагирует, град.
(zA°·HUCR/(22.4·Cp))x - уравнение адиабаты, здесь знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.= zA°·HUCR/(22.4·Cp) - адиабатический коэффициент, показывающий на сколько изменится температура реакции смешения, если ключевое вещество полностью прореагирует, град.
Подставив выражение для Ad в уравнение адиабаты, получим T = Т0 ± Ad·x. 
Система уравнений МБ и ТБ:
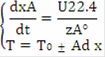
Решение системы позволит найти максимальное значение степени превращения, например, для реакции первого порядка, получим:= k·PA = k·P·zA = k·P·zA°·(1-x) - кинетическое уравнение реакции 1-го порядка
/dt= 22.4·k·P·(1-x),
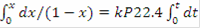
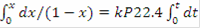 , после интегрирования получим:= 1-
, после интегрирования получим:= 1- 
 - уравнение степени превращения для необратимой реакции 1-го порядка.
- уравнение степени превращения для необратимой реакции 1-го порядка.
Материальный баланс РПС
Реактор полного смешения (РПС) - реактор, в котором вновь поступающая порция реагента быстро распространяется по всему объему реактора за счет перемешивания, и концентрация реагента остается постоянной в любой точке реактора.
Рассмотрим реакцию aA+ bB = cC+dD, примем V=const - объем смеси, zА° = const, хА = 0, хк - начальная и конечная степень превращения соответственно,Vr = const -объем реактора, тогда = V·zA°·xA·MA/22.4 - физический приход в реактор, кг/с; V - расход смеси, м³/с; zA° - концентрация реагента А, кг/кмоль; Vm = 22.4 - молярный объем, м³/кмоль.= V·zA°·(1-xA)·dxA·MA/22.4 -физический расход, кг/с= U·Vr·MA - прореагировало в реакторе в ходе химической реакции, кг/с, где Vr-объем реактора, м³.
По закону сохранения действующих масс - приход равен расходу вещества в ходе реакции:
= GFRA + GCRA, кг/с
·zA°/22.4 = V·zA°/22.4 - V·zA°·хк/22.4 + U·Vr, сократим:·zA°·хк/22.4 = U·Vr, учитывая, что Vr = Vt - объем реактора, м³, получим
хк/t = 22.4·U/zA° - уравнение материального баланса РПС.
Из уравнения МБ следует, что чем больше скорость реакции, тем ниже время ее протекания и объем реактора.
Тепловой баланс РПС
Рассмотрим реакцию экзотермическую без изменения числа молей:
+ bB=cC+dD
Т0 - начальная температура на входе в реактор,град; Тк - конечная температура на выходе из реактора, град; хА=0 - начальная степень превращения, хк -конечная степень превращения; Т-температура в реакторе, град; V=const - расход смеси считаем постоянным, м³/с; zA° -концентрация вещества А, кг/кмоль; Cp- удельная теплоемкость, Дж/моль град, также постоянные величины; F- поверхность теплообмена на всем объеме реактора, м²/м³; Cp- удельная теплоемкость, Дж/(моль град), тогда= V·Cp·(T0-273), кДж/с - теплота физического прихода;= V·Cp·(Tк -273) - энергия (теплота) физического расхода, кДж/с;СR = U·∆HUCR·Vr - тепловой эффект химической реакции, кДж/с;= K·F·∆T - энергия теплообмена, кДж/с.
По закону сохранения энергии составим уравнение теплового баланса:
HFP + HСR = HFR + HTO
·Cp·T0 - V·Cp·273 + U·∆HUCR·Vr = V·Cp·Tк - V·Cp·273 + K·F·∆T, сократим·HUCR·Vr = V·Cp·(Tк - T0) + K·F·∆T - уравнение политермы.= хк·zA°/(22.4·t) - скорость реакции, кмоль/(м³с), Vr = Vt - объем реактора, м³, подставим в уравнение политермы:
хк·zA°·Vt∆HUCR /(22.4·t) = V·Cp·(Tк - T0) + K·F·∆T
В данном случае режим адиабатический, значит теплообмен с окружающей средой отсутствует, и слагаемое K·F·∆T пропадает, тогда
хк·∆HUCR = 22.4·Cp·(Tк - T0)/ zA°, отсюдак = T0 ±  zA°·∆HUCR·хк/(22.4·Ср) - уравнение адиабаты РПС, где знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.
zA°·∆HUCR·хк/(22.4·Ср) - уравнение адиабаты РПС, где знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.
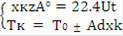
Совместное решение уравнений МБ и ТБ для РПС позволяет найти конечную степень превращения: 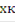
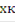 =
= 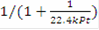
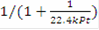
Рассмотрим необратимую реакцию первого порядка, тогда = k·PA = k·P·zA = k·P·zA°·(1 - x) -кинетическое уравнение реакции 1-го порядка, подставим в уравнение МБ и ТБ:
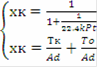
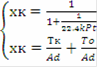
Для обратимой реакции первого порядка A ⇄  D: = k1·PA - k2·PD = k1·P·zA - k2·P·zD = k1·P·zA°·(1-xk) - k2·P·zA°·xk = k1·P·zA°·(1-(k2+k1)xk/k1)= 0 при условии равновесия, тогда k1 = (k1 + k2)·xr, значит U = k1·P·zA°·(1-xk/xr), выразив хк, получим: хк = xr·22.4·t·k1·P/(xr + 22.4·t·k1·P). Система уравнений МБ и ТБ для обратимой реакции примет вид:
D: = k1·PA - k2·PD = k1·P·zA - k2·P·zD = k1·P·zA°·(1-xk) - k2·P·zA°·xk = k1·P·zA°·(1-(k2+k1)xk/k1)= 0 при условии равновесия, тогда k1 = (k1 + k2)·xr, значит U = k1·P·zA°·(1-xk/xr), выразив хк, получим: хк = xr·22.4·t·k1·P/(xr + 22.4·t·k1·P). Система уравнений МБ и ТБ для обратимой реакции примет вид:


ПРОГРАММЫ
СПИСОК ЛИТЕРАТУРЫ
сера диоксид окисление кинетика
1. Васильев Б.Т., Отвагина М.И. Технология серной кислоты - М.: Химия, 1985г.
. Мухленов И.П., Кузнецов Д.А., Авербух А.Я., Тумаркина Е.С., Фурмер И.Э. Общая химическая технология - М.: Высшая шк., 1970 г.
. Барон Н.М., Пономарёва А.М., Равель А.А., Тимофеева З.Н. Краткий справочник физико-химических величин. Издание 10-е, испр. и дополн. СПб: ”Иван Фёдоров”, 2002 г.
ВВЕДЕНИЕ
Под технологией в широком значении этого слова понимают научное описание методов и средств производства в какой-то отрасли промышленности. Процессы механической технологии основаны преимущественно на механическом воздействии, изменяющем внешний вид или физические свойства обрабатываемых веществ, но не влияющем на их химический состав. Процессы химической технологии включают химическую переработку сырья, основанную на сложных по природе химических и физико-химических явлениях.
Таким образом, химическая технология - это наука о наиболее экономичных и экологически обоснованных методах химической переработки сырых природных материалов в предметы потребления и средства производства.
Современная химическая технология, используя достижения естественных и технических наук, изучает и разрабатывает совокупность физических и химических процессов, машин и аппаратов, оптимальные пути осуществления этих процессов и управления ими при промышленном производстве различных веществ, продуктов, материалов.
Химическая технология базируется на химических науках, таких, как физическая химия, химическая термодинамика и химическая кинетика, а также развивает закономерности этих наук в приложении к крупномасштабным промышленным процессам, она тесно связана с экономикой, физикой, математикой, кибернетикой, прикладной механикой, другими техническими науками.
По мере развития химической промышленности содержание химической технологии обогащалось новыми сведениями, закономерностями. Значительный прогресс науки в последние годы связан с применением современных вычислительных средств для решения теоретических и прикладных задач. Применение вычислительной техники не только позволило ставить и решать сложные задачи, но и обогатило химическую технологию новыми подходами к их решению, связанными с математическим моделированием и системными исследованиями, также развивается кибернетика химико-технологических процессов. Новые открытия тесно связывают науку с производством, что позволяет более рационально использовать сырье и топливно-энергетические ресурсы, создавать безотходные производства, где процессы протекают с высокими скоростями в оптимальных условиях с получением продуктов высокого качества.
Химическая технология играет важную роль в химической промышленности, которая является одной из ведущих отраслей народного хозяйства, ей принадлежит определяющая роль в ускорении научно-технического прогресса, повышении эффективности общественного производства и, материального и культурного уровня жизни людей.
Химическая технология является материальной базой химизации народного хозяйства. Цель химизации - интенсификация и повышение эффективности промышленного и сельскохозяйственного производства, улучшение условий труда и повышение уровня медицинского, культурного и бытового обслуживания населения. Химизация обеспечивает: совершенствование структуры сырьевого баланса, снижение затрат на производство и эксплуатацию изделий, совершенствование топливно-энергетической базы путем интенсификации процессов и комплексной переработки нефти, природного газа, сланцев и угля, использования теплоты реакций, усиление охраны окружающей среды.
Материальной основой всех химико-технологических процессов являются машины и аппараты химических производств. Эффективность химического производства обеспечивается за счет систематического повышения его технического уровня на основе использования мощных, непрерывных, малостадийных и менее энергоемких аппаратов. Так, выбор и расчет аппарата, ректификационной колонны, реактора является важным критерием, определяющим технологический процесс.
Химико-технологический процесс представляет собой совокупность операций, позволяющих получить целевой продукт из исходного сырья. Скорость всех этапов операций будет зависеть от температурного режима, наличия примесей, а самое главное - от гидромеханических, тепло- и массообменных, химических процессов, протекающих в аппарате. Анализ единичных процессов, их взаимного влияния позволяет разработать технологический режим и рассчитать аппараты, реакторы, необходимые для проведения этих процессов в оптимальных условиях (сочетание основных параметров - температуры, давления, состав исходной реакционной смеси, катализаторов), т.е. таких, которые позволяют получить наибольший выход продукта с высокой скоростью или обеспечить наименьшую себестоимость.
Разработка и построение рациональной технологической схемы, а соответственно и выбор реактора, аппарата - важная задача химической технологии.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОКИСЛЕНИЯ ДИОКСИДА СЕРЫ



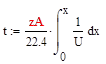
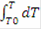
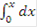
 (zA°·HUCR/(22.4·Cp))x - уравнение адиабаты, здесь знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.= zA°·HUCR/(22.4·Cp) - адиабатический коэффициент, показывающий на сколько изменится температура реакции смешения, если ключевое вещество полностью прореагирует, град.
(zA°·HUCR/(22.4·Cp))x - уравнение адиабаты, здесь знак «+» для реакции экзотермической, знак «-» для эндотермической реакции.= zA°·HUCR/(22.4·Cp) - адиабатический коэффициент, показывающий на сколько изменится температура реакции смешения, если ключевое вещество полностью прореагирует, град.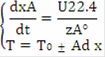
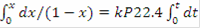

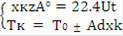
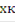
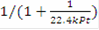
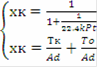
 D: = k1·PA - k2·PD = k1·P·zA - k2·P·zD = k1·P·zA°·(1-xk) - k2·P·zA°·xk = k1·P·zA°·(1-(k2+k1)xk/k1)= 0 при условии равновесия, тогда k1 = (k1 + k2)·xr, значит U = k1·P·zA°·(1-xk/xr), выразив хк, получим: хк = xr·22.4·t·k1·P/(xr + 22.4·t·k1·P). Система уравнений МБ и ТБ для обратимой реакции примет вид:
D: = k1·PA - k2·PD = k1·P·zA - k2·P·zD = k1·P·zA°·(1-xk) - k2·P·zA°·xk = k1·P·zA°·(1-(k2+k1)xk/k1)= 0 при условии равновесия, тогда k1 = (k1 + k2)·xr, значит U = k1·P·zA°·(1-xk/xr), выразив хк, получим: хк = xr·22.4·t·k1·P/(xr + 22.4·t·k1·P). Система уравнений МБ и ТБ для обратимой реакции примет вид:


