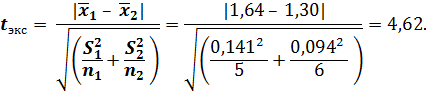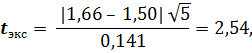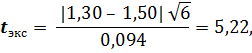Результаты количественных определений химического состава различных технологических и природных объектов имеют смысл, если они выполнены с погрешностью, допустимой для данного конкретного случая. При выборе методики анализа для объекта исследования, а также при оценке результатов определения решающее значение имеют метрологические характеристики. К ним, прежде всего, относятся интервалы определяемых содержаний и минимально определяемое содержание компонента, правильность и воспроизводимость полученных результатов. Интервал определяемых содержаний компонента – это область значений определяемых содержаний (массы, молярной концентрации и др.), которые предусмотрены данной методикой. Нижняя граница определяемых содержаний, т.е. наименьшее содержание компонента, определяемое по данной методике, является минимально определяемым содержанием.
Правильность и воспроизводимость результатов связаны с погрешностями, которые сопровождают большинство аналитических определений. Источники погрешностей очень многочисленны, а характер их разнообразен. Например, погрешности возникают при взвешивании, измерении объемов, перенесении вещества из бюкса в колбу, при измерении на приборах и других операциях.
Погрешности, которые встречаются при аналитических определениях, можно разделить на систематические и случайные. К систематическим относятся погрешности, повторяющиеся при проведении многих определений без изменения величины и знака. Например, при использовании неправильно откалиброванной мерной посуды, раствора с неправильно установленной концентрацией или неисправного прибора, в случае присутствия в анализируемом растворе примесей, мешающих определению анализируемого компонента. Систематические погрешности трудно заметить, так как они постоянны и не проявляются при повторных определениях. Параллельные определения при наличии систематической погрешности обычно дают хорошо сходящиеся результаты.
Убедиться в отсутствии систематических погрешностей можно только при изменении всех условий, которые могут влиять на результат анализа. Например, проверить концентрацию стандартного раствора или вместимость мерной посуды, а лучше всего провести определение другим независимым методом.
Случайные погрешности обусловлены причинами случайного характера и зависят от многих не выявленных причин, учесть которые невозможно. Избежать случайных погрешностей нельзя. Случайные погрешности легко выявляются при проведении параллельных определений. Основным признаком случайных погрешностей является разброс результатов параллельных определений при их повторе.
Таким образом, систематические погрешности трудно выявить, но довольно легко оценить (например, введением поправок). Случайные погрешности легко выявить, но трудно оценить. Так как они случайно изменяются по знаку и величине. В подавляющем большинстве случаев имеют место малые случайные погрешности, поэтому результаты параллельных определений бывают достаточно близкими. Большие случайные погрешности – промахи (неправильно записаны результаты измерений на приборе или взята проба вещества) сразу заметны, так как при них получаются сильно отличающиеся результаты. Такие погрешности бывают редко и соответствующие результаты отбрасываются.
Задачами количественного определения являются нахождение наиболее вероятного значения определяемой величины и оценка воспроизводимости и правильности полученного результата. Под правильностью понимают близость результата определения х к истинному значению µ. Правильность результата определения характеризуется погрешностью.
Абсолютная погрешность представляет собой разность между найденным значением х и истинным значением µ и имеет размерность измеряемых величин (г, %. г/л, моль/л и т.д.):
Δабс . = х – µ.
Относительная погрешность – это отношение абсолютной погрешности к истинной величине и выражают в процентах:
Δотн. = (х – µ) . 100/ µ, %.
Так как истинное значение известным не бывает, при расчете погрешности определения используют действительное значение а. За действительное значение принимают экспериментально найденное или расчетное значение, которое настолько близко к истинному,что может быть принято вместо него:
Δабс . = х – a и Δотн. = (х – a) . 100/ a, %.
Под воспроизводимостью понимают близость друг к другу результатов анализа при повторных определениях, т.е. рассеяние единичных результатов относительно среднего значения. Воспроизводимость используется для оценки разброса результатов и характеризует вероятность получения близких результатов. Хорошая воспроизводимость результатов определения может быть получена при недостаточной правильности, если есть систематические погрешности. Воспроизводимость обусловлена наличием случайных погрешностей, в то время как правильный результат может быть получен только при отсутствии систематических погрешностей.
2.1.1 Оценка воспроизводимости результатов определения
Воспроизводимость результатов химического анализа характеризуется стандартным отклонением, дисперсией и относительным стандартным отклонением.
При ограниченном числе измерений, характерном для количественного анализа, проводят следующие расчеты. Например, имеются отдельные значения результатов измерений х1, х2, х3, ….хп из объема выборки п (число повторных измерений, полученных по одной методике).
Среднее арифметическое значение вычисляют по формуле
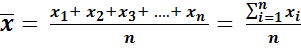 .
.
Стандартное отклонение – мера разброса значений измеряемой величины относительно среднего
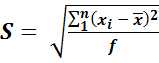 ,
,
где xi – единичное измерение, f – число степеней свободы, 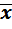 – среднее арифметическое из всех измерений.
– среднее арифметическое из всех измерений.
Число степеней свободы f = n – 1 показывает число контрольных измерений, соответствующих первому результату. Расчет воспроизводимости результатов на основе только одного измерения невозможен, так как при n – 1 = 0 стандартное отклонение будет равно бесконечности.
Стандартное отклонение S характеризует случайную погрешность методики определения. Квадрат этой величины называется дисперсией и обозначается V. 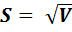 .
.
Относительное стандартное отклонение – отношение стандартного отклонения к среднему значению. Величина 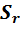 может быть выражена в процентах.
может быть выражена в процентах.
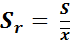 .
.
Если один или несколько результатов, составляющих выборку, отличаются от среднего значения более чем на 2 S, то есть если | 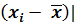 > 2 S, то эти результаты исключаются как ошибочные. После исключения ошибочных результатов заново проводят расчеты
> 2 S, то эти результаты исключаются как ошибочные. После исключения ошибочных результатов заново проводят расчеты 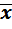 , f, V, S и
, f, V, S и 
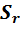 . Таким образом, исключают грубые погрешности.
. Таким образом, исключают грубые погрешности.
Если для анализа взята не одна, а несколько проб (m), и анализ каждой пробы выполнен п раз, то расчет стандартного отклонения проводят по формуле
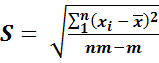 .
.
Воспроизводимость результатов определения характеризуется стандартным отклонением, то есть случайной погрешностью определения, а сами результаты определения характеризуются доверительным интервалом среднего значения. Математической обработкой результатов можно установить пределы области среднего 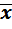 , внутри которой с заданной степенью вероятности может находиться истинное значение µ. Эти пределы представляют собой доверительный интервал – это интервал вокруг среднего значения, в котором с заданной вероятностью Р находится истинное значение при отсутствии систематической погрешности. Доверительный интервал составляет
, внутри которой с заданной степенью вероятности может находиться истинное значение µ. Эти пределы представляют собой доверительный интервал – это интервал вокруг среднего значения, в котором с заданной вероятностью Р находится истинное значение при отсутствии систематической погрешности. Доверительный интервал составляет 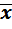 ± δ.
± δ.
Наиболее вероятная погрешность определения при данной доверительной вероятности δ вычисляется по формуле
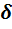
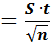 ,
,
где S – стандартное отклонение, n – число параллельных определений,
t – критерий Стьюдента, который находят по таблице в зависимости от уровня доверительной вероятности Р и числа степеней свободы f. В аналитической практике принимают Р = 0,95; это означает, что вероятность нахождения истинного значения в пределах доверительного интервала составляет 95%.
Результат определения представляется в виде интервала 
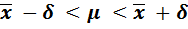 .
.
Необходимо помнить, что доверительный интервал характеризует погрешность результатов определения только в том случае, если отсутствуют систематические погрешности, так как расчет величины 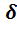 осуществлен на основе математических методов, учитывающих лишь случайные погрешности.
осуществлен на основе математических методов, учитывающих лишь случайные погрешности.
Округление результата определения 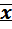 ± δ выполняют на последней стадии обработки результатов и начинают с округления значения погрешности δ, а не среднего значения.
± δ выполняют на последней стадии обработки результатов и начинают с округления значения погрешности δ, а не среднего значения.
Погрешность результата определения δ принято записывать одной или двумя значащими цифрами:
– однойцифрой, если первая цифра погрешности равна 3 или более.
– двумяцифрами, если первая из них равна 1 или 2.
Например, δ = 0,1456 ≈ 0,15; δ = 0,2612 ≈ 0,26; δ = 0,444 ≈ 0,4.
Результат определения 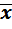 должен заканчиваться цифрой того же разряда, что и последняя значащая цифра погрешности.
должен заканчиваться цифрой того же разряда, что и последняя значащая цифра погрешности.
Например, если 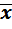 = 20,461 и δ = 0,444, то
= 20,461 и δ = 0,444, то 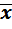 ± δ = 20,5 ± 0,4;
± δ = 20,5 ± 0,4;
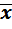 = 0,22362и δ = 0,00148,
= 0,22362и δ = 0,00148, 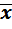 ± δ = 0,2236 ± 0, 0015;
± δ = 0,2236 ± 0, 0015;
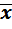 = 100,461и δ =2,044,
= 100,461и δ =2,044, 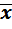 ± δ = 100,5 ± 2,0.
± δ = 100,5 ± 2,0.
Рекомендуется результаты определения представить в виде таблицы 2, указывая единицы измерения.
Таблица 2 – Математическая обработка результатов определения
| n
| 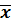
| S
| Sr, %
| 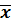 ± δ ± δ
|
|
|
|
|
|
|
2.1.2 Проверка правильности результатов определения
С целью проверки правильности результатов определений необходимо убедиться в отсутствии систематических погрешностей. Для этого используют в основном два метода.
Первый метод заключается в проверке используемой методики определения на стандартном образце или стандартном растворе, содержание определяемого компонента в которых известно. Стандартные образцы для различных методов выпускаются промышленностью. Стандартные растворы химик-аналитик готовит сам. Наиболее простым и надежным способом приготовления стандартного раствора является весовой метод. Навеску определяемого соединения взвешивают на аналитических весах и растворяют в мерной колбе. В этом случае определяемое соединение должно удовлетворять требованиям, которые предъявляют к установочным веществам в титриметрических методах.
Если определяемое вещество не соответствует этим требованиям, то приготавливают раствор приблизительной концентрации. Точную концентрацию раствора определяют по установочному веществу так же, как в титриметрических методах или с использованием каких-нибудь других методов. При этом следует быть уверенным, что этот метод не дает систематических погрешностей, а случайные погрешности меньше, чем погрешности, которые удовлетворяют требованиям анализа производственного раствора.
В производственных условиях состав технологического раствора может значительно отличаться от состава стандартного раствора. В этом случае используемую методику проверяют не на стандартном растворе, а на модельном. Модельный раствор содержит известное количество определяемого компонента. А также приблизительные количества всех других компонентов технологического раствора. Модельный раствор также готовят весовым методом или устанавливают концентрацию определяемого компонента каким-либо другим независимым методом.
Затем определяют содержание анализируемого вещества в стандартном (или модельном) растворе по используемой методике, и результат представляют в виде доверительного интервала 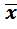 ± δ. Если действительное значение содержание анализируемого вещества в стандартном растворе а попадает в доверительный интервал, то в первом приближении можно считать, что систематические погрешности отсутствуют.
± δ. Если действительное значение содержание анализируемого вещества в стандартном растворе а попадает в доверительный интервал, то в первом приближении можно считать, что систематические погрешности отсутствуют.
Более строгую проверку правильности результатов определения проводят по t – критерию Стьюдента, значение которого рассчитывается по формуле
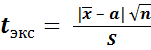 .
.
Рассчитанное значение критерия Стьюдента t экс сравнивают с табличным значением t –критерия, найденным при Р = 0,95 и f = n – 1. Если t экс < t табл, то расхождение между средним и действительным значениями незначимо, т.е. обусловлено случайной погрешностью, и результат считается правильным. В случае t экс > t табл расхождение значимо и обусловлено не только случайной, но и систематической погрешностями.
Второй метод проверки правильности результатов определения представляет сопоставление результатов определения, полученных двумя независимыми методами. Один из этих двух методов называют контролируемым (его проверяют), а другой контрольным. Результаты определения двух методов первоначально сравнивают по воспроизводимости, применяя F –критерий Фишера:
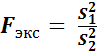 ; (S 12 > S 22).
; (S 12 > S 22).
F –критерий находят по таблице при заданных степенях свободы f 1 и f 2, соответствующих выбранной доверительной вероятности Р = 0,95 и сравнивают с экспериментально найденным значением.
Если различие в дисперсиях двух методов так велико, что F экс > F табл, то это указывает на преимущество второго метода, имеющего соответственно меньшую дисперсию S 2 и меньшее стандартное отклонение, но сравнение средних значений 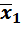 и
и 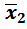 далее не проводят.
далее не проводят.
Если экспериментальная величина F экс меньше F табл, то расхождение между двумя дисперсиями, а, следовательно, и между воспроизводимостями двух методов считается незначимым.
Если разница в воспроизводимости двух методов признана незначимой, то для проверки правильности результатов определения в первом приближении можно сравнить доверительные интервалы результатов определения по двум методам. Если доверительные интервалы перекрываются, то делают вывод об отсутствии систематических ошибок. В противном случае требуется дополнительная проверка.
Проверить правильность результатов по двум методам более строго можно также путем расчета критерия Стьюдента по формуле
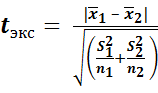 ,
,
где 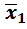 и
и 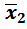 –результаты определений как средние арифметические из параллельных определений двумя методами;
–результаты определений как средние арифметические из параллельных определений двумя методами;
S 1 2 и S 2 2 – дисперсии двух методов;
n 1 и n 2 – число параллельных определений двумя методами.
По таблице при Р = 0,95 находят t – критерий. Число степеней свободы расcчитывают по формуле
f = n 1 + n 2 – 2.
Если t экс < t табл, то расхождение между результатами определения двумя методами незначимо. Это свидетельствует об отсутствии систематических погрешностей и правильности результатов. В случае выполнения t экс > t табл расхождение между результатами определения двумя методами значимо и обусловлено наличием как случайных, так и систематических погрешностей.
Сопоставить результаты определения по F и t – критериям можно и в том случае, если эти результаты получены по одной методике, но относятся к разным пробам, анализ которых выполнен одним или разными химиками-аналитиками.
Примеры математической обработки результатов количественных определений
2.2.1 Оценка воспроизводимости и правильности результатов определения содержания карбоната натрия
Каждый студент проводит от 4 до 6 параллельных определений концентрации С, г/л карбоната натрия в растворе одной пробы. Рассчитывает среднее значение содержания карбоната натрия 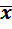 (
(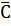 ), стандартное отклонение S, относительное стандартное отклонение Sr и доверительный интервал определяемой величины
), стандартное отклонение S, относительное стандартное отклонение Sr и доверительный интервал определяемой величины 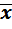 ± δ.
± δ.
Рассмотрим пример обработки результатов шести параллельных определений (n = 6). Содержание карбоната натрия по результатам шести титрований составляет:
x 1 = 0,2798 г/л x 4 = 0,2714 г/л
x 2 = 0,2720 г/л x 5 = 0,2734 г/л
x 3 = 0,2719 г/л x 6 = 0,2735 г/л.
Находим среднее значение концентрации карбоната натрия по формуле
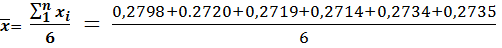 = 0,2737г/л.
= 0,2737г/л.
Чтобы рассчитать стандартное отклонение, предварительно рассчитывают 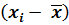 ,
, 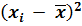 и сумму
и сумму 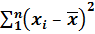 . Результаты этих расчетов вносят в таблицу 1, образец которой приведен ниже. Для упрощения проведения расчетов данные xi представляют в виде целого числа с указанием его порядка. Например: 0,2798 = 2798 . 10–4.
. Результаты этих расчетов вносят в таблицу 1, образец которой приведен ниже. Для упрощения проведения расчетов данные xi представляют в виде целого числа с указанием его порядка. Например: 0,2798 = 2798 . 10–4.
Таблица 3 – Результаты промежуточных расчетов
| №
| 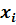 , г/л , г/л
| 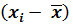 ∙ 104, г/л ∙ 104, г/л
| 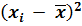 ∙ 108 , г/л ∙ 108 , г/л
|
| 1
| 0,2798
| 61
| 3721
|
| 2
| 0.2720
| 17
| 289
|
| 3
| 0.2719
| 18
| 324
|
| 4
| 0.2714
| 13
| 169
|
| 5
| 0.2734
| 3
| 9
|
| 6
| 0.2735
| 2
| 4
|
Стандартное отклонение рассчитывают по формуле

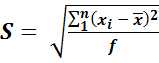 ,
,
где f – число степеней свободы, f = n – 1. f = 6 – 1 = 5.
В данном примере
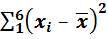 = 4516. 10–8,
= 4516. 10–8,
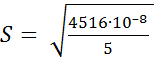 = 0,0030 г/л.
= 0,0030 г/л.
Стандартное отклонение имеет ту же размерность, что и результаты определения (г. %, г/л).
Следует выяснить, есть ли в рассматриваемой выборке из шести результатов ошибочные (промахи), сравнив | 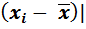 с 2 S. Результаты считаются ошибочными и их исключают, если |
с 2 S. Результаты считаются ошибочными и их исключают, если | 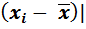 > 2 S. В данной выборке первый результат оказался неправильным, так как
> 2 S. В данной выборке первый результат оказался неправильным, так как
| 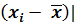 = 0,2798 – 0,2737 = 0, 0061;
= 0,2798 – 0,2737 = 0, 0061;
2 S = 2 . 0,0030 = 0,0060; 0,0061 > 0,0060.
Следовательно, первый результат следует отбросить и заново провести расчеты с оставшимися пятью параллельными результатами (см. таблицу 4).
Таблица 4 – Результаты промежуточных расчетов после исключения промахов
| №
| 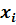 , г/л , г/л
| 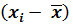 ∙ 104, г/л ∙ 104, г/л
| 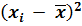 ∙ 108 , г/л ∙ 108 , г/л
|
| 1
| 0.2720
| 17
| 289
|
| 2
| 0.2719
| 18
| 324
|
| 3
| 0.2714
| 13
| 169
|
| 4
| 0.2734
| 3
| 9
|
| 5
| 0.2735
| 2
| 4
|
n = 5; 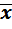 = 0,2724;
= 0,2724; 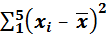 = 362. 10–8.
= 362. 10–8.
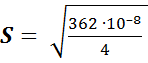 = 0,00095 ≈ 0,0010 г/л.
= 0,00095 ≈ 0,0010 г/л.
В данном расчете для всех пяти результатов | 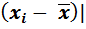
 2 S, поэтому можно продолжать расчеты. Кроме стандартного отклонения S рассчитывают относительное стандартное отклонение S r.
2 S, поэтому можно продолжать расчеты. Кроме стандартного отклонения S рассчитывают относительное стандартное отклонение S r.
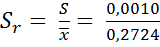 = 0,0037.
= 0,0037.
S r не имеет размерности, но может быть выражено в процентах:
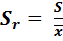 . 100 = 0,0037. 100 = 0,37%.
. 100 = 0,0037. 100 = 0,37%.
Воспроизводимость результатов характеризуется как стандартным отклонением S, так и относительным стандартным отклонением S r.
Для установления доверительного интервала рассчитывают величину δ на основе стандартного отклонения S, числа определений n и коэффициента Стьюдента t:
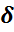
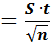 ,
,
где t находят по справочнику (см. приложение 2) в зависимости от доверительной вероятности Р (обычно принимают Р = 0,95) и числа степеней свободы f = n – 1.
В рассматриваемом примере при Р = 0,95и f = 5– 1= 4 находим t = 2,78 и рассчитываем δ:
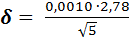 = 0,00124 ≈ 0,0012 г/л.
= 0,00124 ≈ 0,0012 г/л.
В данном случае в числе δ = 0,00124 первая значащая цифра равна единице, поэтому значение δ округляют до двух значащих цифр. Нули, стоящие впереди, не являются значащими и лишь указывают на порядок числа.
Число значащих цифр для среднего результата 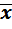 определяется порядком значащих цифр в значении δ. Так как
определяется порядком значащих цифр в значении δ. Так как 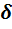 = 0,0012 г/л, то в значении
= 0,0012 г/л, то в значении 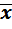 оставляют четыре цифры после запятой
оставляют четыре цифры после запятой 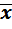 = 0,2724.
= 0,2724.
Доверительный интервал, внутри которого с вероятностью 0,95 находится истинное значение содержания карбоната натрия 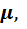 при отсутствии систематических ошибок, составляет:
при отсутствии систематических ошибок, составляет:
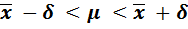 ;
;
0,2724 – 0,0012 ˂ 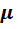 ˂ 0,2724 + 0,0012;
˂ 0,2724 + 0,0012;
0,2712 ˂ 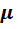 ˂ 0,2736.
˂ 0,2736.
Все основные результаты математической обработки следует свести в таблицу 5.
Таблица 5 – Математическая обработка результатов определения Na2CO3
| n
| 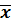 , г/л , г/л
| S, г/л
| S r, %
| 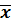 ± δ, г/л ± δ, г/л
|
| 5
| 0,2724
| 0,0010
| 0,37
| 0,2724 ± 0,0012
|
Определение содержания карбоната натрия студент проводит в стандартном растворе. Для оценки правильности результатов определения сравнивают доверительный интервал с действительным значением а. За а принимается содержание карбоната натрия в стандартном растворе. Действительное значение студент узнает у преподавателя после проведения математической обработки результатов определения. При оценке правильности найденного значения следует выяснить, обусловлено ли различие между 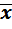 и а случайной погрешностью или имеет место и систематическая погрешность. Отклонение
и а случайной погрешностью или имеет место и систематическая погрешность. Отклонение 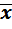 от действительного значения а не должно превышать рассчитанную величину δ. В данном случае а = 0,2750 г/л.
от действительного значения а не должно превышать рассчитанную величину δ. В данном случае а = 0,2750 г/л.
| 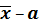 | = | 0,2724 – 0,2750 | = 0,0026 > 0,0012.
| = | 0,2724 – 0,2750 | = 0,0026 > 0,0012.
Таким образом, действительное значение а = 0,2750 г/л не попадает в доверительный интервал 0,2712 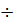 0,2736. Следует сделать вывод, что при определении содержания карбоната натрия имеют место случайная и систематическая составляющие погрешности.
0,2736. Следует сделать вывод, что при определении содержания карбоната натрия имеют место случайная и систематическая составляющие погрешности.
2.2.2 Оценка правильности результатов определения содержания ионов железа(lll), полученных по двум методикам
В качестве примера в таблице 6 даны результаты определения содержания ионов железа (lll) (значения n, 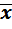 ± δ, S) методом прямой фотометрии с использованием двух различных аналитических реагентов:
± δ, S) методом прямой фотометрии с использованием двух различных аналитических реагентов:
1– сульфосалициловой кислоты, 2 – роданида калия.
Таблица 6 – Результаты определения содержания ионов Fe (lll)
| Метод
| n
| 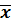 ± δ, мг/л ± δ, мг/л
| S,
мг/л
| F экс
| F табл
| t экс
| t табл
|
| 1
| 5
| 1,64 ± 0,15
| 0,141
| 2,25
| 5,2
| 4,62
| 2,26
|
| 2
| 6
| 1,30 ± 0,10
| 0,094
|
Для сравнения воспроизводимости двух методов пользуются F –критерием. С этой целью рассчитываютзначение F как отношение двух дисперсий V 1 и V 2, найденных при определении ионов Fe(lll) с сульфосалициловой кислотой и роданидом калия:
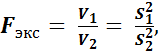 (S 12 > S 22).
(S 12 > S 22).
В рассматриваемом примере
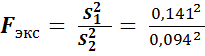 = 2,25.
= 2,25.
По таблице приложения 3 находят значение F –критерия (при соответствующих степенях свободы f 1 и f 2 и заданной доверительной вероятности Р = 0,95) и сравнивают его с рассчитанным значением F экс.
В приложении 3 при Р = 0,95, f 1 = 5 – 1 = 4, f 2 = 6 –1 = 5 находят значение F табл = 5,2. Так как F табл > F экс (5,2 > 2,25), то расхождение между дисперсиями V 1 и V 2 (или стандартными отклонениями S 1 и S 2), а следовательно, между воспроизводимостью результатов двух сравниваемых методов незначимо. Из этого следует, что расхождение между случайными погрешностями результатов двух методов не обнаружено. Таким образом, при определении ионов железа как с использованием сульфосалициловой кислоты, так и роданида калия преимущества одного метода над другим по воспроизводимости в данном случае не найдено.
Для оценки правильности результатов определения, полученных двумя методами, разница в воспроизводимости результатов которых признана незначимой, в первом приближении достаточно сравнить доверительные интервалы результатов определения. Если наблюдается перекрывание одного доверительного интервала другим, можно допустить, что отличие в средних значениях содержания ионов Fe(lll), определяемых двумя методами, объясняется случайными, а не систематическими погрешностями и полученные результаты считают правильными.
Для более строгой оценки правильности результатов следует рассчитать значение t –критерия и сопоставить с табличным значением.
В данном примере
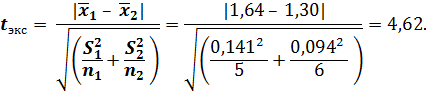
В приложении 2 находят значение критерия Стьюдента t табл = 2,26 при Р = 0,95 и f = n 1 + n 2 – 2 = 5 + 6 – 2 = 9.
Сопоставление показывает, что t табл < t экс (2,26 < 4,62). Следовательно, расхождение между результатами определения двумя методами значимо и обусловлено наличием не только случайных, но и систематических погрешностей. В этом случае данные обоих методов нельзя объединять в одну выборку, чтобы рассчитать среднее значение содержания ионов Fe(lll). Значения F – и t –критериев заносят в таблицу 5.
Оценить правильность полученных результатов можно, проверив методики на стандартных растворах. В нашем примере действительное содержание ионов Fe(lll) в анализируемом растворе а = 1,50 мг/л.
Рассчитывают значение t –критерия для каждого метода по формуле
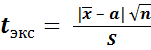 .
.
1) При определении с сульфосалициловой кислотой
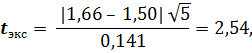
значение t табл = 2,78 при Р = 0,95 и f 1 = 4. Получается t табл > t экс (2,78 > 2,54).
2) При определении с роданидом калия
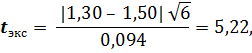
t табл = 2,57 при Р = 0,95 и f 2 = 5. Следовательно, t табл < t экс (2,57 <5,22).
Сопоставление табличного и расчетного значений t –критерия показало, что правильными следует признать результаты определения содержания железа, найденные по 1-й методике с сульфосалициловой кислотой, так как t табл > t экс. Во втором случае расчетное значение t –критерия больше табличного, что говорит о наличии систематической ошибки при определении железа данным методом.
ЛИТЕРАТУРА
1. Быкова Л.Н., Новиков А.В., Чеснокова О.Я. Аналитическая химия. / Под ред. Л.Н. Быковой. – М.: МГТУ им. А.Н. Косыгина, 2002. – 411 с.
2. Гридина Н.Н., Новиков А.В., Баранов О.В. Физико-химические методы анализа. Часть 1. Электрохимические методы анализа: учебное пособие. – М.: РГУ им. А.Н. Косыгина, 2015. – 68 с.
3. Гридина Н.Н., Новиков А.В., Баранов О.В. Физико-химические методы анализа. Часть 2. Спектральные методы анализа. Атомная спектроскопия: учебное пособие. – М.: РГУ им. А.Н. Косыгина, 2016. – 52 с.
4. Гридина Н.Н., Новиков А.В., Баранов О.В. Физико-химические методы анализа. Часть 3. Спектральные методы анализа. Молекулярная спектроскопия: учебное пособие. – М.:РГУ им. А.Н. Косыгина, 2017. – 76 с.
П РИЛОЖЕНИЕ
ПРИЛОЖЕНИЕ 1
Титульный лист отчета по УИР
|
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМ. А.Н.КОСЫГИНА
(ТЕХНОЛОГИИ. ДИЗАЙН. ИСКУССТВО)
Факультет химической технологии и промышленной экологии
Кафедра химии и технологии полимерных материалов и нанокомпозитов
УЧЕБНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА
по дисциплине “Физико-химические методы анализа»
(название темы)
_________________________________________________________________________
Выполнил:
Студент группы ______ _________________
Руководитель: доц. ________________
Москва 20__ г.
|
ПРИЛОЖЕНИЕ 2
Значения t –критерия Стьюдента
| Число
степеней свободы
F = n - 1
| Доверительная вероятность Р
|
| 0,90
| 0,95
| 0,99
|
| 1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
20
25
30
40
60
∞
| 6,31
2,92
2,35
2,13
2,01
1,94
1,89ё
1,86
1,83
1,81
1,80
1,78
1,77
1,76
1,75
1,72
1,71
1,70
1,68
1,67
1,65
| 12,71
4,30
3,18
2,78
2,57
2,45
2,37
2,31
2,26
2,23
2,20
2,18
2,16
2,15
2,13
2,09
2,06
2,04
2,02
2,00
1,96
| 63,66
9,93
5,84
4.60
4,03
3.71
3,50
3,35
3,25
3,17
3,11
3,05
3.01
2,98
2,95
2,85
2,79
2,75
2,70
2,66
2,58
|
ПРИЛОЖЕНИЕ 3
Значения F –критерия Фишера
|
f 2
| f 1 при Р = 0,95
|
| 1
| 2
< |



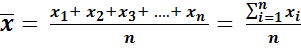 .
.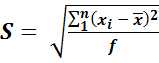 ,
,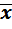 – среднее арифметическое из всех измерений.
– среднее арифметическое из всех измерений.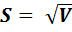 .
. может быть выражена в процентах.
может быть выражена в процентах.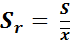 .
.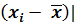 > 2 S, то эти результаты исключаются как ошибочные. После исключения ошибочных результатов заново проводят расчеты
> 2 S, то эти результаты исключаются как ошибочные. После исключения ошибочных результатов заново проводят расчеты 
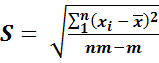 .
.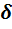
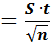 ,
,
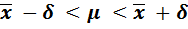 .
. осуществлен на основе математических методов, учитывающих лишь случайные погрешности.
осуществлен на основе математических методов, учитывающих лишь случайные погрешности. ± δ выполняют на последней стадии обработки результатов и начинают с округления значения погрешности δ, а не среднего значения.
± δ выполняют на последней стадии обработки результатов и начинают с округления значения погрешности δ, а не среднего значения. 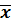
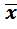 ± δ. Если действительное значение содержание анализируемого вещества в стандартном растворе а попадает в доверительный интервал, то в первом приближении можно считать, что систематические погрешности отсутствуют.
± δ. Если действительное значение содержание анализируемого вещества в стандартном растворе а попадает в доверительный интервал, то в первом приближении можно считать, что систематические погрешности отсутствуют.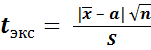 .
.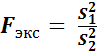 ; (S 12 > S 22).
; (S 12 > S 22).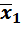 и
и 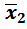 далее не проводят.
далее не проводят.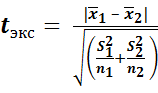 ,
,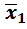 и
и 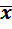 (
(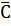 ), стандартное отклонение S, относительное стандартное отклонение Sr и доверительный интервал определяемой величины
), стандартное отклонение S, относительное стандартное отклонение Sr и доверительный интервал определяемой величины 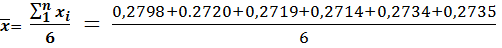 = 0,2737г/л.
= 0,2737г/л.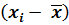 ,
, 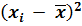 и сумму
и сумму 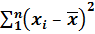 . Результаты этих расчетов вносят в таблицу 1, образец которой приведен ниже. Для упрощения проведения расчетов данные xi представляют в виде целого числа с указанием его порядка. Например: 0,2798 = 2798 . 10–4.
. Результаты этих расчетов вносят в таблицу 1, образец которой приведен ниже. Для упрощения проведения расчетов данные xi представляют в виде целого числа с указанием его порядка. Например: 0,2798 = 2798 . 10–4. , г/л
, г/л
 ∙ 104, г/л
∙ 104, г/л

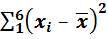 = 4516. 10–8,
= 4516. 10–8,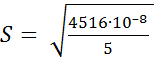 = 0,0030 г/л.
= 0,0030 г/л.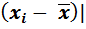 с 2 S. Результаты считаются ошибочными и их исключают, если |
с 2 S. Результаты считаются ошибочными и их исключают, если | 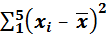 = 362. 10–8.
= 362. 10–8.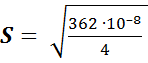 = 0,00095 ≈ 0,0010 г/л.
= 0,00095 ≈ 0,0010 г/л. 2 S, поэтому можно продолжать расчеты. Кроме стандартного отклонения S рассчитывают относительное стандартное отклонение S r.
2 S, поэтому можно продолжать расчеты. Кроме стандартного отклонения S рассчитывают относительное стандартное отклонение S r.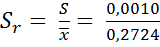 = 0,0037.
= 0,0037.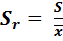 . 100 = 0,0037. 100 = 0,37%.
. 100 = 0,0037. 100 = 0,37%.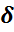
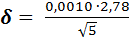 = 0,00124 ≈ 0,0012 г/л.
= 0,00124 ≈ 0,0012 г/л.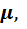 при отсутствии систематических ошибок, составляет:
при отсутствии систематических ошибок, составляет: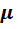 ˂ 0,2724 + 0,0012;
˂ 0,2724 + 0,0012;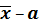 | = | 0,2724 – 0,2750 | = 0,0026 > 0,0012.
| = | 0,2724 – 0,2750 | = 0,0026 > 0,0012.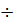 0,2736. Следует сделать вывод, что при определении содержания карбоната натрия имеют место случайная и систематическая составляющие погрешности.
0,2736. Следует сделать вывод, что при определении содержания карбоната натрия имеют место случайная и систематическая составляющие погрешности.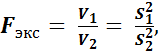 (S 12 > S 22).
(S 12 > S 22).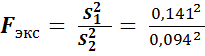 = 2,25.
= 2,25.