МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Пермский государственный национальный
исследовательский университет»
Колледж профессионального образования
C АМОСТОЯТЕЛЬНАЯ РАБОТА
СТУДЕНТОВ ПО ОРГАНИЧЕСКОЙ ХИМИИ
Методические указания
для студентов Колледжа профессионального образования
специальности
09.02.07 Информационные системы и програмирование ТОП 50
09.02.06 Сетевое и системное администрирование ТОП 50
Пермь
Составители: Тетерина Н. М.- кандидат химических наук, преподаватель ФГБОУ ПГНИУ
Введение
Данное учебное пособие предназначено для изучения основ органической химии. Учебное пособие рекомендовано для организации самостоятельной работы по курсу органической химии (в объеме общей химии).
Систематическая или номенклатура IUPAC
Название молекулы органического соединения состоит из нескольких частей:
Общее название по систематической номенклатуре составляют по схеме:
Корень
Суффикс
| | Все заместители в едином алфавитном порядке (кроме старшей группы)
| Определяет название главной ациклической или циклической цепи
| + степень насыщенно-сти: -ан, -ен, -ин
| Старшая функциональная группа
|
| | | | |
Локанты – цифры или буквы, показывающие положение углеводородной или функциональной группы, а также кратных связей. В русской номенклатурной практике принято ставить цифры, указывающие положение префиксов перед ними, а указывающие положение суффиксов, характер связей – после них.
Умножающие префиксы указывают число одинаковых структурных элементов в формуле. Например: «ди» - два, «три»- три, «тетра»- четыре, «пента»- пять, «гекса»- шесть и.т.д.
Построениеназвания органического соединения состоит из нескольких этапов: 1. Выбирают главную обычно длинную цепь, содержащую:
- старшую функциональную группу
- двойную или тройную связи,
-максимальное число заместителей.
2. Главную цепь нумеруют с того конца, к которому ближе старшая функциональная группа, двойная или тройная связь, заместители.
3. В префиксе (приставке) в едином алфавитном порядке перечисляют заместители (табл.3) с учетом умножающих префиксов и с указанием их местоположения.
4. Дают название главной цепи (корень названия) с учетом степени насыщенности:- ан – для насыщенной углеводородной цепи
- ен – при наличии двойной связи,
- ин – при наличии тройной связи
5. В суффиксе дают название старшей функциональной группе(табл. 3). Она определяет класс органического соединения.
Таблица
Порядок старшинства классов органических соединений и названий характеристических групп
| Класс
| Функциональная
группа
| Название групп
|
| в префиксах
| в суффиксах
|
| Карбоновые к-ты
| - СООН
| -
| карбоновая кислота
|
| Альдегиды
| -CHO
| оксо
| аль
|
| Кетоны
| -С=О
| оксо
| он
|
| Спирты
| -ОН
| гидрокси
| ол
|
| Амины
| -NH2
| амино
| амин
|
| Галогенпроизводные
| -F
-Cl
-Br
-I
| фтор
хлор
бром
йод
| -
-
-
-
|
Примеры упражнений
Упражнение №1. Дать название по систематической номенклатуре соединению
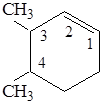
1. Определяют главную углеводородную цепь. Она имеет циклическое строение.
2. Нумеруют атомы углерода цепи, начиная с двойной связи, так, чтобы заместители получили наименьшие номера.
3. Перечисляют заместители в префиксе с указанием местоположения (для нескольких одинаковых заместителей указывают умножающий префикс).
4. Корень названия - циклогекс ен с учетомстепени насыщенности, после указывают локант двойной связи.
Название соединения 3,4-диметилциклогексен-1
Упражнение №2. Дать название по систематической номенклатуре соединению
1.
Из двух функциональных групп старшей является карбоксильная группа (-СООН). Ее называют в суффиксе:
овая кислота.
2. Нумеруют атомы углерода цепи от старшей функциональной группы.
3. В префиксе перечисляют заместители в алфавитном порядке с указанием местоположения.
4. Поскольку в главной цепи четыре атома углерода, корень названия бутан с учетом степени насыщенности.
Название соединения 2-амино-3-метилбутановая кислота.
Упражнение №3. Написать структурную формулу соединения 3,3-диметилгексен-1
1. Изображают углеводородные атомы главной цепи по названию корня.
2. Нумеруют цепь углеводородных атомов.
3. Располагают заместители и двойную связь в соответствии со значением локантов.
4. Завершают структуру молекулы, добавляя атомы водорода к углеводородным атомам цепи, имеющим свободные связи.
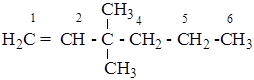
Глава 2. Углеводороды
Алканы
Алканы образованы неполярными и малополярными связями, поэтому на них не действуют полярные кислоты и щелочи (при обычных условиях). Алканы растворимы в органических растворителях («подобное в подобном»).
Химические свойства
Для алканов характерны реакции замещения S, разложения (пиролиза, крекинга), изомеризации, окисления.
Реакции
замещения (SR) используются для получения нитро-, сульфо- (алкилсульфонаты R-CH
2-CH
2-SO
3Na - моющие средства) и галогеналканов (фреоны-CFH
3, CF
2H
2 и др.; растворители – CH
2Cl-CH
2Cl и др; пестициды – CH
2Br
2, C
2Cl
6).
 Издавна алканы используются в качестве источника энергии – в результате реакции горения (полного окисления) выделяется большое количество тепла: СН4 + О2 СО2 + Н2О + Q
Издавна алканы используются в качестве источника энергии – в результате реакции горения (полного окисления) выделяется большое количество тепла: СН4 + О2 СО2 + Н2О + Q
Благодаря каталитическому окислению (неполному окислению) получают кислородсодержащие органические соединения:

При термическом разложении и каталитическом дегидрировании (крекинге, пиролизе) получают другие классы углеводородов: циклоалканы, алкены, арены:

С
4Н
10 СН
2 = СН
2-СН
2-СН
3 + Н
2


Важное значение имеют реакции изомеризации, например, для получения бензина с высоким октановым числом:

Классификация спиртов
| По типу углеводородного радикала
| По числу гидроксильных групп
| По типу атома углерода, связанного с группой - ОН
|
| Предельные
пропанол-2 (изопропиловый спирт)
| Одноатомные
пропанол-1
| Первичные
бутанол-1
|
| Непредельные
пропен-2-ол-1
(аллиловый спирт)
| Двухатомные
этандиол-1,2
(этиленгликоль)
| Вторичные
бутанол-2 (вторичный бутиловый спирт)
|
| Ароматические
Фенилметанол (бензиловый спирт)
| Трехатомные
пропантриол-1,2,3 (глицерин)
| Третичные
2 метилпропанол-2
(трет. бутиловый спирт)
|
|
| Многоатомные
Гексангексаол-1,2,3,4,5,6 (сорбит)
|
|
Реакция окисления
а) горение С2Н5ОН+О2® 2СО2+ 3Н2О+ 1370 кДж\моль
б) Окисление сильными окислителями (K2Cr2O7, KMnO4):
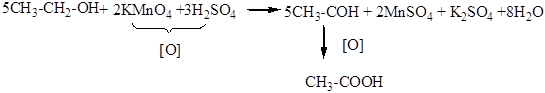
Многоатомные спирты
Этиленгликоль (двухатомный спирт). Сильный яд. Растворы этого вещества имеют низкую температуру замерзания, поэтому он используется при изготовлении антифризов. Антифризы – это охлаждающие жидкости, применяемые для отвода теплоты в двигателях внутреннего сгорания в зимних условиях.
Глицерин (трехатомный спирт) - обладает гигроскопичными свойствами, поэтому широко используется в парфюмерии (в кремах, помадах); пищевой промышленности (входит в состав жиров), в производстве пластмасс (в качестве пластификатора).
Многоатомные спирты: сорбит (Е420) - С6Н6(ОН)6, ксилит (Е967) - С6Н7(ОН)5, маннит (Е421) - С6Н6(ОН)6 изомер сорбита обычно используют в качестве подсластителей и заменителей сахара. Сорбит окисляется в организме до фруктозы, поэтому используется при приготовлении диетических плодоовощных консервов, кондитерских изделий, и безалкогольных напитков, а также входит в состав жевательных резинок. Ксилит применяется вместо сахара в производстве изделий для больных диабетом и ожирением. Он быстро усваивается и не оказывает влияния на уровень сахара в крови.
Фенолы – это кислородсодержащие производные ароматических углеводородов, у которых одна или несколько гидроксильных групп связаны непосредственно с бензольным ядром.
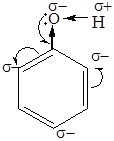
Реакции по бензольному кольцу: галогенирование, сульфирование, нитрование (см. арены)
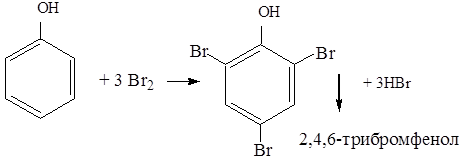
Кислотные свойства (разрыв О – Н). Фенол в отличие от алифатических спиртов проявляет более сильные кислотные свойства (реагирует не только с активными металлами, но и с щелочами):

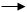 2C6H5OH + 2Na 2C6H5ONa + H2
2C6H5OH + 2Na 2C6H5ONa + H2
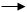 C6H5OH + NaOH C6H5ONa +H2O
C6H5OH + NaOH C6H5ONa +H2O
Качественная реакция на фенол:
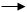 C6H5OH + FeCl3 (C6H5O)3Fe +3HCl
C6H5OH + FeCl3 (C6H5O)3Fe +3HCl
Производные фенола проявили себя как антиокислители – соединения, проявляющие сильные восстановительные свойства и препятствующие окислению веществ. Они вводятся в пищевые продукты для продления сроков их хранения. Антиокислители прерывают реакцию самоокисления компонентов продуктов питания, протекающую при контакте пищевых продуктов с кислородом воздуха.
Наиболее распространенными антиокслителями фенольного типа являются соединения:
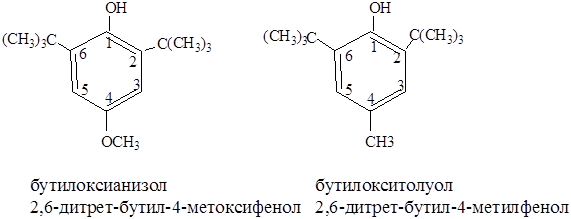
Эти антиокислители используют для замедления окисления животных топленых жиров, соленого шпика, жевательных резинок.
Реакции восстановления
[H] - восстановление водородом в присутствии катализаторов:Pt, Ni, Pd или сильными восстановителями, например – NaBH4.
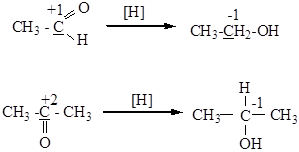
Физические свойства
Низшие предельные монокарбоновые кислоты (С1-С9)-представляют собой жидкости, а высшие и ароматические – твердые вещества. Молекулы карбоновых кислот дифильны, т.е состоят из гидрофобной части (углеводородного радикала) и гидрофильного фрагмента (карбоксильной группы), поэтому с ростом углеводородного радикала растворимость кислот уменьшается (начиная с С10 – практически не растворимы). Соли карбоновых кислот также ограниченно растворимы.
Химические свойства:
Кислотные свойства
Наличием сильного положительного центра на атоме водорода в карбоксильной группе объясняется диссоциация низших карбоновых кислот (взаимодействие с водой): R-COOH Û RCOO- +H+
 Растворы карбоновых кислот относят к слабым кислотам, поэтому они взаимодействуют:
Растворы карбоновых кислот относят к слабым кислотам, поэтому они взаимодействуют:
а) с активными металлами 2СН3-СООН+2К= 2СН3-СООК + Н2
б) с оксидами металлов 2СН
3-СООН+МgO = (CH
3COO)
2Mg+H
2O
в) c щелочами СН
3-СООН+ NaOH=CH
3COONa+H
2O
г) с солями СН3-СООН+ NaHCO3= CH3COONa+H2O+CO2
Образовавшиеся соли подвергаются гидролизу, поэтому смеси карбоновых кислот с их солями образуют буферные растворы.
Реакция этерификации (со спиртами)
| метилацетат (метилметаноат)
| |
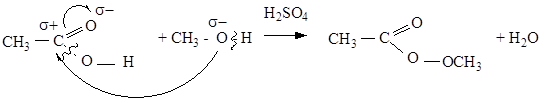
Органические кислоты добавляют в пищевые продукты для придания им приятного кислого вкуса, а также для консервирования.
Консерванты – этовещества, которые добавляются в пищевые продукты для их сохранения, предотвращения порчи.
Уксусная кислота – наиболее распространенная консервирующая пищевая добавка (Е260), применяемая в производстве маринованных изделий, овощных заготовок и консервов. Для получения пищевой уксусной кислоты используют уксуснокислое брожение спирта под действием бактерий (одноклеточные микроорганизмы):

 СН3–СН2ОН СН3СООН +Н2О
СН3–СН2ОН СН3СООН +Н2О
Её действие основано на снижении рН консервированного продукта и направлено против болезнетворных (патогенных) бактерий. В промышленном масштабе уксусную кислоту производят путем окисления ацетальдегида, полученного из этилового спирта окисляющими реагентами или путем гидратации ацетилена по реакции Кучерова.
Муравьиная кислота (Е236) обладает также антимикробным действием. Её применяют для консервирования фруктовых соков, дезинфекции пищевых емкостей.
Пропионовая (пропановая) кислота (Е280) обладает антимикробным действием. В пищевой промышленности используют главным образом натриевые и кальцевые соли пропионовой кислоты. Они применяются в сыроделии и хлебопечении.
Ароматические кислоты
Важнейшим представителем ароматических карбоновых кислот является бензойная кислота (Е210). Бензойная кислота входит в состав некоторых ягод (брусники, клюквы) и является распространенным природным консервантом. Ее применяют в органическом синтезе для получения лекарственных препаратов, душистых веществ, красителей. В пищевой промышленности в качестве консерванта используют ее соль – бензоат натрия.
Химические свойства
1. Гидролиз жиров (кислотный, т.е. в присутствии кислоты)
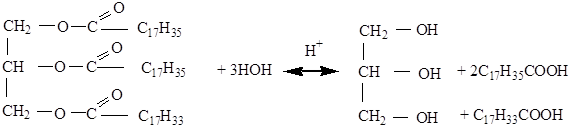
Дистеаролеат глицерина
2. Щелочной гидролиз (омыление)
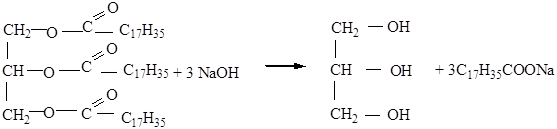
Тристеарат глицерина
С17Н35СООН – мыло (моющее средство)
3. Гидрирование жиров. Реакции присоединения Н2 в присутствии катализатора. При этом жидкое масло превращается в твердый жир. Твердые растительные масла используют в пищевой промышленности для производства маргарина.
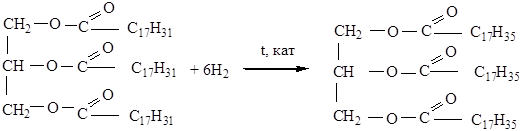

Данная реакция позволяет отличить маргарин от сливочного масла.
КОНТРОЛЬНОЕ ЗАДАНИЕ №2
Вариант1
а) Определите класс указанных веществ. Приведите примеры химических взаимодействий для указанных веществ (напишите реакции по:а) функциональной группе; б)по углеводородному радикалу)
- Фенол, стеариновая кислота. Указать значение данных веществ в промышленности, медицине, сельском хозяйстве или в других сферах.
б) Какие вещества относятся к консервантам? На чем основано их действие? Привести примеры.
Вариант2
а) Определите класс указанных веществ. Приведите примеры химических взаимодействий для указанных веществ (напишите реакции по:а) функциональной группе; б)по углеводородному радикалу)
- Этаналь, олеиновая кислота. Указать значение данных веществ в промышленности, медицине, сельском хозяйстве или в других сферах.
в)Какую роль выполняют пищевые кислоты. Приведите примеры.
Вариант3
а) Определите класс указанных веществ. Приведите примеры химических взаимодействий для указанных веществ (напишите реакции по:а) функциональной группе; б)по углеводородному радикалу)
- Метиловый спирт, пальметиновая кислота. Указать значение данных веществ в промышленности, медицине, сельском хозяйстве или в других сферах.
б) Какие группы ароматизаторов используют в производстве продуктов питания. Охарактеризуйте каждую группу. Приведите известные примеры. Определите класс органического соединения
Вариант4
а) Определите класс указанных веществ. Приведите примеры химических взаимодействий для указанных веществ (напишите реакции по:а) функциональной группе; б)по углеводородному радикалу)
- Глицерин, акриловая кислота. Указать значение данных веществ в промышленности, медицине, сельском хозяйстве или в других сферах.
б) Как можно отличить растительные жиры от животных. Какие масла легче окисляются? Почему?
Вариант5
а) Определите класс указанных веществ. Приведите примеры химических взаимодействий для указанных веществ (напишите реакции по:а) функциональной группе; б)по углеводородному радикалу)
- Метанол, бензойная кислота. Указать значение данных веществ в промышленности, медицине, сельском хозяйстве или в других сферах.
б) Что такое эмульгатор? Для чего используют эмульгаторы в пищевой промышленности?
Вариант6
а) Определите класс указанных веществ. Приведите примеры химических взаимодействий для указанных веществ (напишите реакции по:а) функциональной группе; б)по углеводородному радикалу)
- Метаналь(формальдегид), акриловая кислота. Указать значение данных веществ в промышленности, медицине, сельском хозяйстве или в других сферах.
б) Почему мыло является ПАВ (поверхностно активным веществом) Представьте механизм моющего действия.
Вариант 7
а) Закончите уравнения возможных реакций:а)гидроксид калия + этанол, б) акриловая кислота+ водород, в) уксусная кислоты +гидроксид натрия,г)пропанол +гидроксид натрия, д)олеиновая кислота+водород
б) Жиры. Приведите схему получения жиров. Какие виды жиров существуют. Чем они отличаются.
Вариант8
а) С каким из перечисленных ниже веществ будет взаимодействовать: а) фенол б) олеиновая кислота: азотная кислота, гидроксид калия, водород, натрий, бром. Напишите уравнения соответствующих реакций.
б) Как распознать триолеатглицерина и тристеоратглицерина: а)физическим свойствам,
б)химическим свойствам
Вариант 9
а) С каким из перечисленных ниже веществ будет взаимодействовать: а) акриловая кислота б) этиленгликоль (этандиол):гидроксид калия, водород, карбонат натрия, бром. Напишите уравнения соответствующих реакций.
б) Жиры. Приведите схему получения жиров. Какие виды жиров существуют. Чем они отличаются.
Какие жиры можно использовать для производства мыла?
Вариант 10
А) Закончите уравнения возможных реакций: а) гицерин+натрий, оксид кальция+ бензойная кислота, в) акриловая кислота +этанол г)уксусная кислота + водород, д)олеиновая кислота + бром
б) Какие группы ароматизаторов используют в производстве продуктов питания. Охарактеризуйте каждую группу. Приведите известные примеры. Определите класс органического соединения.
Глава 4. Углеводы
Углеводы – кислородсодержащие органические вещества, содержащие в своем составе карбонильную и гидроксильные группы. Для большинства случаев общая формула углеводов – Сn(Н2О)m (n, m >3).
Углеводы образуются растениями в процессе фотосинтеза:
 хСО2+ уН2О+солнечная энергия Сх(Н2О)у+ хО2
хСО2+ уН2О+солнечная энергия Сх(Н2О)у+ хО2
Растения на 85-90% состоят из углеводов (семена, клубни, корни).
Номенклатура. В основном используются тривиальные названия, но можно назвать по систематической номенклатуре: С6Н12О6 – глюкоза (2,3,4,5,6 – пентагидроксигексаналь)
Классификация углеводов:
1. Моносахариды
2. Дисахариды (при гидролизе образуют 2 моносахаридных остатка)
3. Полисахариды – высокомолекулярные соединения, содержащие сотни и тысячи моносахаридных остатков.
Моносахариды – гетерофункциональные соединения, содержащие в молекуле одну оксо- и несколько гидроксильных групп.
Моносахариды, содержащие старшую альдегидную группу, называются альдозами, кетонную группу – кетозами.


В зависимости от длины углеводородной цепи (3-10 атомов С) моносахариды делятся на триозы, тетрозы, пентозы, и.т.д. Наиболее распространены пентозы и гексозы:
Окисление моносахаридов
Окисление альдегидной и первичной спиртовой группы в зависимости от окислителя:
а) Окисление альдегидной группы:

б) Окисление альдегидной и первичной спиртовой группы

Дисахариды
Молекулы дисахаридов образованы остатками моносахаридов, находящимися в циклических формах.
Распространенные дисахариды:
Сахароза- углевод образован из двух остатков глюкозы и фруктозы
Мальтоза (солодовый сахар - проросшее зерно) состоит из глюкозыдвух остатков
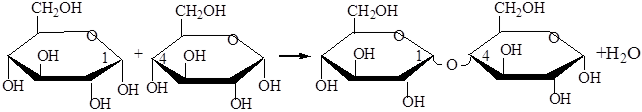
Лактоза (молочный сахар) состоит из остатков галактозы и глюкозы Содержится в молоке 4-5%.
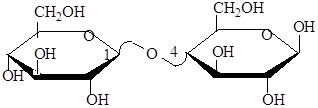
Дисахариды гидролизуются в кислой среде с образованием моносахаридов.
 С12Н22О11 + Н2О (Н+) 2C6Н12О6
С12Н22О11 + Н2О (Н+) 2C6Н12О6
Полисахариды – высокомолекулярные углеводы. Важнейшие полисахариды: крахмал, гликоген, целлюлоза – представляют собой гомополисахариды, т.к. состоят из остатков одного моносахарида (глюкозы).
Крахмал - природный полимер растительного происхождения, построенный из остатков -глюкозы, Молекулярная формула (-С6Н10О5-) n

Крахмал образуется в растениях (60-80% - в рисе, 60-70% - в пшенице, 12-22% - в картофеле) в процессе фотосинтеза. Особенностью данного природного полимера является то, что он представляет собой смесь двух полисахаридов: амилозы (10-20%) и амилопектина (80-90%). Это определяет его физические свойства: нерастворим в холодной и набухает (частично растворяется) в горячей воде.
Гликоген (животный крахмал) по составу и структуре макромолекул близок к амилопектину, только имеет еще большее разветвление (через 6-12 звеньев). Он содержится в печени, в мышцах, выполняет резервную энергетическую функцию: источник глюкозы в организме. Сильное разветвление полимера обеспечивает быстрое отщепление нужного количества молекул глюкозы при гидролизе.
Целлюлоза (клетчатка) состоит из остатков глюкозы (но другова пространственного строения.
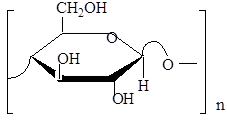
Полимер имеет линейное строение, не растворим в воде. Гидролизуется только в среде сильных кислот. Целлюлоза самый распространенный растительный полисахарид. Она составляет 95% хлопкового волокна, в льне - до 90%, в древесине - 40%.
Целлюлоза образует сложные эфиры:
Первый полимер используют в производстве пленки, а растворы полимера в органических растворителях используют в качестве лаков.
Второй полимер имеет линейное (нитевидное) строение, поэтому является искусственным волокном, используется в производстве ацетатного шелка, а также в производстве пленки, органического стекла.
Биологические функции углеводов. Полисахариды, прежде всего крахмал и некоторые дисахариды, являются важными компонентами питания. В организме (кишечнике) они расщепляются до моносахаридов, которые затем всасываются слизистой кишечника. Транспортной формой углеводов в крови является глюкоза. Глюкоза поступает в клетки организма, где используется в качестве клеточного «топлива» или превращается в другие метаболиты (природные соединения), например, в гликоген.
Полисахариды служат также строительным материалом, например, в растениях эту функцию выполняет целлюлоза. В животных организмах полимерные углеводы часто встречаются в ковалентно связанном виде с липидами (гликолипиды) и белками (гликопротеины), входящими в состав клеточных мембран.
Глава 5 Аминокислоты Белки
Аминокислотами называются соединения, в молекулах которых содержатся одновременно амино- и карбоксильные группы.
Для названий аминокислот используют тривиальные названия (глицин, аланин, валин и т. д).
В состав аминокислот могут входить другие функциональные группы.
Общее число встречающихся природных аминокислот достигает 150. Среди них выделяется группа из 20 наиболее важных, которые образуют белки животного и растительного происхождения.
Природные аминокислоты – это a-аминокислоты, которые могут быть получены при гидролизе белковых веществ животного и растительного происхождения. Основным источником a-аминокислот для живого организма служат пищевые белки. Многие a-аминокислоты синтезируются в организме, другие должны поступать извне, последние называются незаменимыми - валин, лейцин, изолейцин, лизин и др.
Особенностью строения аминокислот является наличие в их молекулах двух функциональных групп, определяющих противоположные свойства: аминогруппа определяет основные свойства, карбоксильная - кислотные свойства.
Биологические функции аминокислот. Аминокислоты – важнейшие компоненты питания – участники обмена веществ в организме.
Аминокислоты является структурным элементом белка, некоторые из них являются медиаторами или гормонами, другие входят в состав ферментов, т.е. специфических белков, которые находятся в клетках организма и играют роль катализаторов биохимических процессов. Аминокислоты используют также в качестве лекарственных средств, например, глицин - улучшает химические процессы в тканях мозга.
Физические свойства. Аминокислоты – кристаллические вещества, хорошо растворимые в воде.
Химические свойства
Аминокислоты – амфотерные соединения, содержащие кислотную (СООН) и основную (-NH
2) группы. Поэтому аминокислоты реагируют как со щелочами, так и с кислотами:
Пептиды - продукты поликонденсации a-аминокислот, в которых они соединены между собой пептидными группами -CO-NH-.
Например,
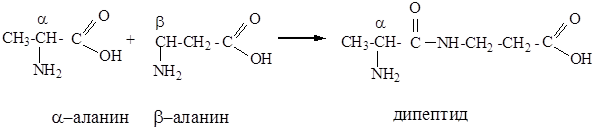
Многие пептиды являются гормонами, которые регулируют биохимические процессы в организме, например, инсулин (содержит 51-остаток аминокислот).
Белки
Растения синтезируют белки из СО2 и Н2О за счет фотосинтеза, усваивая остальные элементы белков (N, P,S Fe, Mg) из растворимых солей, находящихся в почве. Животные организмы в основном получают готовые аминокислоты с пищей и на их базе строят белки своего организма.
Белки представляют собой биополимеры a -аминокислот. Если при гидролизе белковые вещества распадаются до соответствующих аминокислот, то такие белковые вещества относят к простым белкам, или протеинам.
Белки имеют большую молекулярную массу макромолекул 104-107. В воде образуют, как правило, коллоидные растворы. Коллоидные растворы – дисперсные системы, занимающие промежуточное положение между растворами низкомолекулярных веществ и грубодисперсными системами (суспензиями, эмульсиями). Размер (диаметр) коллоидной частицы составляет 10-7 – 10- 9 м.
При описании состава и структуры белка используют понятия первичная, вторичная, третичная и четвертичная структуры.
Первичная структура белка определяется составом и последовательностью аминокислотных остатков его цепи. При написании формул белков указывают порядок следования друг за другом аминокислотных остатков, используя их краткое обозначение по первым трём буквам названия, начиная с N-конца.
Например, последовательность аминокислотных остатков из аминокислот глицина – лейцина – серина –-аспаргиновая кислота обозначают Гли –Лей -Сер –Асп.
Вторичная структура характеризует форму полипептидной цепи. В спиралевидной цепи (a-структура) витки спирали скреплены водородными связями между -NH и -O=C группами. Складчатая форма (b-структура) формируется из большого числа параллельных вытянутых полипептидных цепей макромолекул, также связанных между собой водородными связями.
Когда белковая цепь укладывается в спираль, углеводородные радикалы (неполярные части) находятся внутри спирали, а полярные группы аминокислот вывернуты наружу, в таком виде они могут взаимодействовать между собой, образуя третичную структуру.
Третичная структура - полипептидные цепи свернуты в клубок – глобулу за счет водородных, дисульфидных (-S-S-), солевых (-N +H3-COO-), сложноэфирных мостиков. Клубок из аминокислотной последовательности образован строго по плану. Замена любого углеводородного радикала кислоты приводит к образованию другого белка.
Несколько клубков белковых молекул соединяются вместе, образуя четвертичную структуру.
Белки в организме работают только в третичной и четвертичной структуре.
Денатурация белка – разрушение вторичной и третичной структуры под действием радиации, нагревания, солей тяжелых металлов и некоторых других химических веществ.
Физические свойства белков определяются составом и формой белковой молекулы (табл.).
Таблица
Классификация белков
По составу
| Простые
|
Сложные
|
| Только из a-аминокислот
| Содержат белковую и небелковую часть: углеводы, липиды, остаток фосфорной кислоты, нуклеиновые кислоты:
Гликопротеиды (белок+ углеводы)
Липопротеиды(белок + липиды)
Фосфопротеиды(белок +остаток Н3РО4)
Нуклеопротеиды(белок + нуклеиновые кислоты)
|
|
Форма молекул
|
| Глобулярная (шаровидная)
Молекулы свернуты в компактные глобулы сферической или эллипсоидной формы. Характерна a- структура.
Растворимы в воде, или в растворах солей, или образуют коллоидные растворы.
Примеры: Аьбумин, глобулин (яйцо)
| Фибриллярная (нитевидная)
Молекулы образуют длинные волокна. Характерна b- структура.
Не растворимы в воде.
Примеры: b-кератин (волосы, роговая ткань), коллаген (кожа, костная ткань)
|
| | | |
Функции белков
1.Структурная. Белки являются строительным материалом всего живого. Например, печень на 57%, кожа на 63%, мышцы на 80% состоят из белков: кератина, коллагена, эластина, альбумина и др. белков.
2.Транспортная. Перенос низкомолекулярных веществ в виде комплексов с белками (гемоглобин).
3. Двигательная. Мышечное сокращение за счет белков актина и миозина.
4. Защитная. g- глобулины (антитела) распознают попавшие в организм бактерии, вирусы или чужеродные белки и нейтрализуют их. Интерферон – белок угнетающий размножение вирусов.
5. Ферментативная. Ферментами или энзимами принято называть биологические катализаторы. Все известные катализаторы химических превращений в организме – белковые вещества.
6. Регуляторная.Гормоны-белки оказывают регулирующее влияние на биохимический процесс.Например, инсулин регулирует содержание глюкозы в крови.
7. Энергетическая. Например, 1 г белка при расщеплении дает 17,6 КДж (яичный альбумин, казеин молока, гладин пшеницы).
Получение белков осуществляют микробиологическим путем с использованием микроорганизмов.
Качественные реакции белков.
 1. Биуретовая реакция: белок + Cu(OH)2 фиолетовое окрашивание – характерна для всех белков.
1. Биуретовая реакция: белок + Cu(OH)2 фиолетовое окрашивание – характерна для всех белков.
КОНТРОЛЬНОЕ ЗАДАНИЕ №3
Вариант 1
1.Фруктоза, глюкоза, сахароза, лактоза, крахмал, целлюлоза, гликоген определите к какому классу углеводов относится каждое вещество.
2.Перечислите известные вам области применения и биологическое значение целлюлозы
3. Напишите получение дипептида из глицина (аминоуксусная кислота). Какой тип реакции лежит в основе синтеза белка? В чем заключаются амфотерные свойства аминоуксусной кислоты. Подтвердить уравнением химической реакции.
Вариант 2
1.Фруктоза, глюкоза, сахароза, лактоза, крахмал, целлюлоза, гликоген определите к какому классу углеводов относится каждое вещество.
2.Перечислите известные вам области применения и биологическое значение сахарозы
3. Напиши




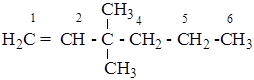
 Издавна алканы используются в качестве источника энергии – в результате реакции горения (полного окисления) выделяется большое количество тепла: СН4 + О2 СО2 + Н2О + Q
Издавна алканы используются в качестве источника энергии – в результате реакции горения (полного окисления) выделяется большое количество тепла: СН4 + О2 СО2 + Н2О + Q




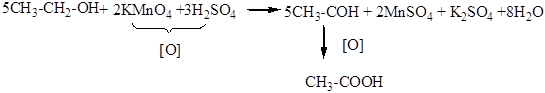
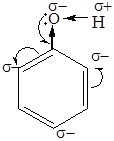
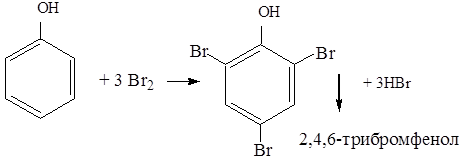

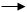 2C6H5OH + 2Na 2C6H5ONa + H2
2C6H5OH + 2Na 2C6H5ONa + H2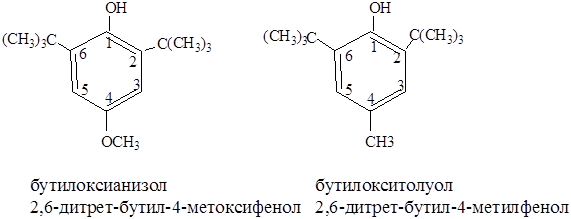
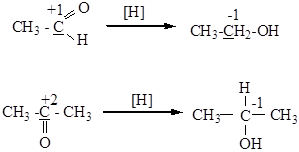
 Растворы карбоновых кислот относят к слабым кислотам, поэтому они взаимодействуют:
Растворы карбоновых кислот относят к слабым кислотам, поэтому они взаимодействуют:
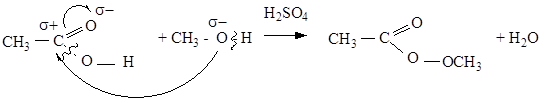

 СН3–СН2ОН СН3СООН +Н2О
СН3–СН2ОН СН3СООН +Н2О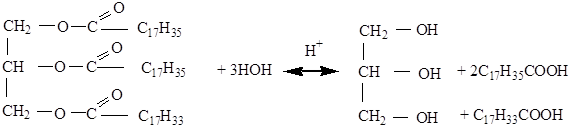
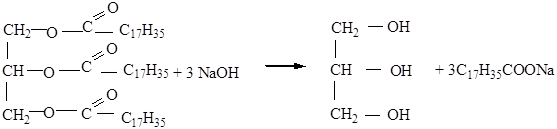
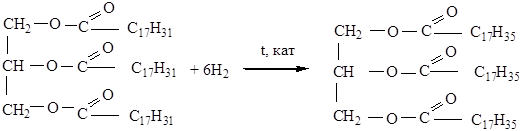

 хСО2+ уН2О+солнечная энергия Сх(Н2О)у+ хО2
хСО2+ уН2О+солнечная энергия Сх(Н2О)у+ хО2



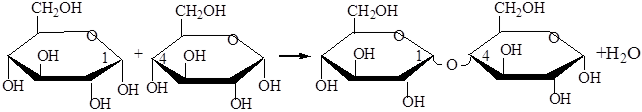
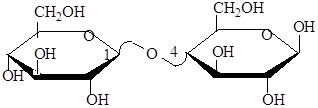
 С12Н22О11 + Н2О (Н+) 2C6Н12О6
С12Н22О11 + Н2О (Н+) 2C6Н12О6
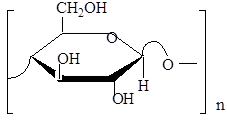




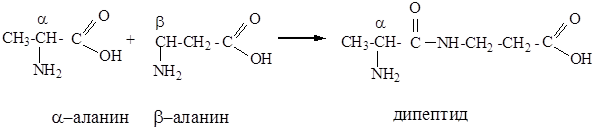
 1. Биуретовая реакция: белок + Cu(OH)2 фиолетовое окрашивание – характерна для всех белков.
1. Биуретовая реакция: белок + Cu(OH)2 фиолетовое окрашивание – характерна для всех белков.


