

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
Топ:
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Принцип метода. Показателем активности фермента является убыль крахмала, расщепляемого под действием сывороточной амилазы.
Для построения стандартной кривой в 5 мерных колбочек емкостью 50 мл наливают по 30–40 мл воды, переносят по 0,5; 1.0; 2,0; 3,0; 4,0 мл раствора крахмала, добавляют по 0,5 мл раствора соляной кислоты, по 0,1 мл раствора йода, доводят водой до метки и перемешивают. Колориметрируют через 5 мин на ФЭКе с красным светофильтром относительно воды в кюветах с расстоянием 1 см между рабочими гранями.
Ход работы. В 2 центрифужные пробирки наливают по 0,5 смеси растворов крахмала и хлорида натрия и по 0,3 мл фосфатной буферной смеси. В пробирку 1 (опыт) добавляют 0,1 мл сыворотки крови, в пробирку 2 (контроль) – 0,1 мл дистиллированной воды. Обе пробирки инкубируются в термостате (37 °С) в течение 30 мин. Затем в обе пробирки добавляют по 0,1 мл 1 н. раствора соляной кислоты и центрифугируют в течение 10 мин при 1500 об/мин. В мерные колбы (50 мл) наливают по 30–40 мл воды, переносят по 0,2 мл центрифугата и проводят цветную реакцию, как это описано для построения стандартной кривой.
Активность амилазы (Е) выражают количеством крахмала (мг), которое может расщепить за 30 мин фермент, содержащийся в 100 мл сыворотки. Расчет ведут по формуле:
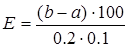 , (11)
, (11)
где Е – активность амилазы;
а – количество крахмала в опытной пробирке, найденное по стандартной кривой, мг;
b – количество крахмала в контрольной пробирке, найденное по стандартной кривой, мг;
100 – пересчет на 100 мл сыворотки;
0,1 –количество сыворотки, взятое для исследования, мл;
0,2 – количество центрифугата, взятое для цветной реакции, мл.
Материалы и реактивы. 1 %–ный раствор крахмала; 0,5 М раствор хлорида натрия; смесь 1 %–ного раствора крахмала с 0,5 М раствором хлорида натрия (4:1); фосфатный буфер, рН 7,2; сыворотка крови свежая без признаков гемолиза; 1 н. раствор соляной кислоты; 0,3 %–ный раствор йода в 3 %–ном растворе иодистого калия (см. Приложение 1, п. 2).
|
|
Оборудование. Штатив с центрифужными пробирками; пипетки; микропипетки (0,1 мл); термостат (37 °С); центрифуга; мерные колбы (50 мл); фотоэлектроколориметр.
Протеазы
Протеазы или протеолитические ферменты – это группа ферментов, относящаяся к классу гидролаз и подклассу пептид–гидролаз.
Пептид–гидролазы – ускоряют гидролиз пептидных связей в белках и пептидах.
В зависимости от характера действия протеазы делятся на протеиназы и пептидазы.
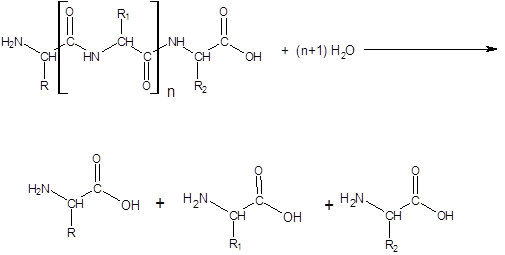 |
Пептидазы катализируют гидролиз пептидных связей в пептидах с образованием свободных аминокислот (экзопептидазы). Пептидазы могут отщеплять от пептида аминокислоту, имеющую свободную аминогруппу (¾NН2) – это аминопептидазы, либо аминокислоту, имеющую свободную карбоксильную группу (¾СООН) –карбоксипептидазы.
Очень важной особенностью протеаз является выборочный (селективный) характер их действия на пептидные связи в белковой молекуле. Так, пепсин избирательно ускоряет гидролиз пептидных связей, образованных аминокислотами Фен и Лей; трипсин – Арг и Лиз; химотрипсин – ароматическими аминокислотами Фен, Трп, Тир; папаин – Арг, Лиз, Фен и т. д. (см. рисунок5)
Причина избирательного действия пептид–гидролаз заключается в том, что радикал аминокислоты, по соседству с которым гидролизуется пептидная связь, служит для образования фермент–субстратного комплекса.
Механизм действия пептидгидролаз рассмотрен на примере действия химотрипсина (см. рисунок 6).
Фрагменты единой полипептидной цепи молекулы фермента условно показаны слева и справа изогнутой линией, в их составе отмечены остатки сер и гис с их функциональными группами. В активном центре фермента точно против остатков сер и гис размещается пептидная связь гидролизуемого белка, образованная остатком фен ( или
|
|

1 – лейцинаминопептидаза
2 – пепсин
3 – трипсин
4 – химотрипсин
5 – карбоксипептидаза А
Рисунок 5 – Точки приложения действия протеолитических ферментов на пептидные связи
в белковой молекуле
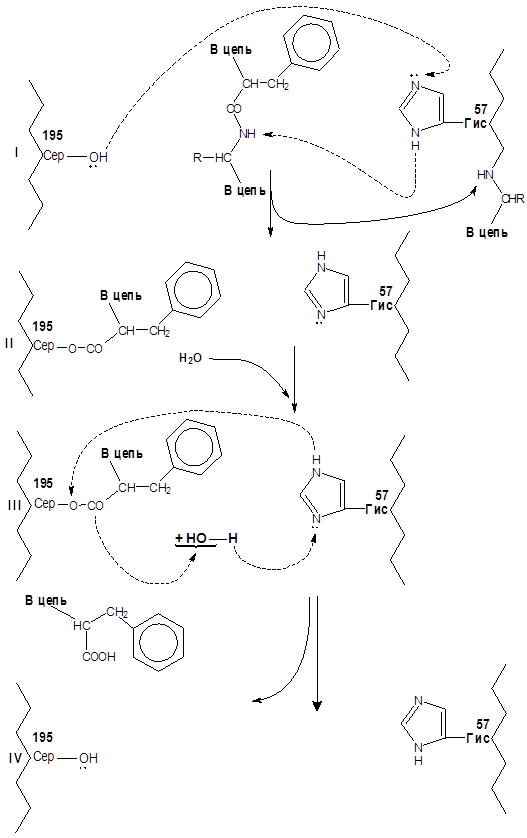 |
тир, три, лей), благодаря контакту радикала фен (или тир, три, лей) с субстратным центром, фермента, который на рисунке не показан. Вследствие того, что электронная пара кислорода гидроксильной группы радикала сер акцептируется карбонильной группой пептидной связи, создаются условия для миграции протона от гидроксила сер к имидазольному радикалу остатка гис для ацилирования радикала сер с одновременным разрывом пептидной связи. Одновременно протон от имидазольного ядра радикала гис перемещается к NН – групп деструктируемой пептидной связи (I). После ацилирования радикала сер (II) в активный центр фермента входит молекула воды, инициирующая распад ацильного производного фермента (III) и восстановлении исходного состояния активного центра (IV), готового принять новую молекулу субстрата или атаковать пептидную связь, образованную остатками фен, тир, три или лей в том же субстрате.
Ферментативный гидролиз белков находит практическое использование при определении первичной структуры белков, для регуляции обмена веществ, т.к. многие продукты селективного гидролиза белков обладают высочайшей биологической активностью: именно этим путем из проферментов образуются ферменты, из предшественников гормонов – гормоны и рилизинг – факторы.
Важным этапом технологии многих пищевых производств являются биохимические превращения белков, происходящие под действием протеолитических ферментов. Повышенная активность протеаз наблюдается в прорастающем зерне пшеницы, ржи, что приводит к снижению хлебопекарных достоинств муки из такого зерна. На пивоваренных заводах ячмень проращивают с целью накопления ферментов, в том числе и протеолитических, для осуществления гидролиза белковых веществ при приготовлении пивного сусла.
|
|
Протеолитические ферменты входят в состав ферментных препаратов грибного и растительного происхождения, широко применяемы для интенсификации технологических процессов производства различных пищевых продуктов и улучшения их качества.
|
|
|

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!