

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ФЕРМЕНТЫ-ГИДРОЛАЗЫ
Методические указания к лабораторному практикуму по дисциплине "Биохимия"
для студентов специальностей Т.18.01., Т.18.02., Т.18.03.
Часть II. «Витамины и ферменты»
"Ферменты" (раздел 1).
Могилев 2000
УДК 557.1
Методические указания рассмотрены и утверждены на заседании кафедры ХТВМС.
Протокол №__ от____2000г.
Составители: доц. О.Н.Макасеева
асс. Л.М.Ткаченко
доц. О.М.Баранов
(графическая часть и оформление)
Научный редактор: профессор Б.Э.Геллер
Рецензенты профессор Г.Н.Роганов
доцент Т.Н.Шингарева
© Могилевский технологический институт
Содержание
С.
Введение...................................................................................................................... 4
1. Классификация и номенклатура............................................................................ 5
2. Определение активности ферментов..................................................................... 6
2.1. Единицы ферментативной активности............................................................. 6
3. Общие свойства ферментов................................................................................... 8
3.1. Специфичность действия ферментов............................................................... 8
3.2. Влияние температуры и рН на активность ферментов................................. 11
3.3. Активирование и ингибирование ферментов................................................ 14
4. Гидролазы............................................................................................................ 15
4.1. Глюкозидазы................................................................................................... 16
4.1.1. Выделение a– и b– амилаз солода.......................................................... 16
4.1.2. Определение декстринирующей способности a–амилазы...................... 19
4.1.3. Влияние температуры на осахаривающую способность b–амилазы..... 20
|
|
4.1.4. Определение активности амилолитических ферментов........................... 23
4.1.5. Определение активности амилазы (сывороточная амилаза крови)........ 25
4.2. Протеазы......................................................................................................... 26
4.2.1. Гидролитическое расщепление казеина под действием пепсина............ 30
4.2.2. Определение активности протеаз по методу Ансона.............................. 31
4.2.3. Определение активности протеолитических ферментов......................... 33
4.2.4. Определение протеолитической способности (ПС)................................. 36
4.2.5. Определение протеолитической активности молокосвертывающих препаратов........................................................................................................... 38
4.3. Эстеразы......................................................................................................... 41
4.3.1. Гидролитическое расщепление жира под действием липазы................. 44
4.3.2. Определение активности липазы.............................................................. 45
Список использованных источников........................................................................ 57
Введение
Ферменты, или энзимы – это высокомолекулярный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций. Жизнь и многообразие ее проявлений – это сложная совокупность реакций, катализируемых специфическими ферментами.
Ферменты обеспечивают осуществление таких важнейших процессов жизнедеятельности, как экспрессия (реализация) наследственной информации, биоэнергетика, синтез и распад биомолекул (обмен веществ). По строению ферменты могут быть однокомпонентными – простыми белками, и двухкомпонентными – сложными белками, содержащими небелковый компонент – кофактор. Пептидную часть фермента называют – апоферментом. Молекула фермента характеризуется уникальностью структуры, которая и определяет уникальность ее функции.
Ферменты отличаются тремя уникальными свойствами. Во - первых, это самые эффективные из известных катализаторов, так как очень малые (микромолярные) количества ферментов способны в очень большой степени ускорять реакцию. Большинство реакций в клетке протекает примерно в миллион раз быстрее, чем, если бы они протекали в отсутствие ферментов.
|
|
Во-вторых, большинство ферментов отличаются специфичностью действия, практически каждая реакция превращения реагирующего вещества (называемого субстратом) в продукт осуществляется специальным ферментом. И в-третьих, действие большинства ферментов регулируется, т.е. они способны переходить от состояния с низкой активностью к состоянию с высокой активностью и обратно.
Индивидуальность живой клетки в большой степени определяется уникальным набором ферментов, который она генетически запрограммирована производить.
Отсутствие даже одного фермента или какой-нибудь его дефект могут иметь очень серьезные отрицательные последствия для организма.
Изучение ферментов имеет огромное значение для любой фундаментальной и прикладной области биологии, а также для многих практических отраслей (медицины, химической, фармацевтической), занятых приготовлением катализаторов, антибиотиков, витаминов и др. Ферменты играют важную роль и в пищевой промышленности. Превращение исходного сырья в готовые продукты в таких отраслях как виноделие, пивоварение, производство спирта, хлебопечение, сыроварение, консервирование, производство кисломолочных продуктов, осуществляемых при непосредственном участии ферментов, являются биотехнологическими. Ферменты могут способствовать протеканию необходимого технологического процесса или затруднить его протекание.
Наука о питании базируется на точных знаниях поэтапного расщепления питательных веществ под влиянием ферментов пищеварительного аппарата.
В данном методическом указании рассматриваются некоторые ферменты из класса гидролаз и оксидоредуктаз, участвующие в процессе пищеварения и пищевых технологиях.
Общие свойства ферментов
Гидролазы
Катализируют различные реакции гидролиза:
RIRII + HOH –––––> RIH + RIIOH
Значительная часть гидролаз представлена пищеварительными ферментами, с помощью которых полимеры, поступающие с пищей в организмы животных и человека, расщепляются до мономеров и реутилизируются для построения новых биополимеров по собственным наследственным программам.
|
|
Гидролиз полимеров помимо его значения для реутилизации важнейших мономеров, играет в живой природе еще две важные роли.
Во - первых, это уничтожение внутри клетки биополимеров, которые, выполнив свою функцию, становятся ненужными на последующем этапе жизнедеятельности. Известно, например, что у прокариот время жизни отдельных молекул мРНК невелико – выполнив свою функцию в производстве необходимых клетке белков, они гидролизуются до мономеров и повторно используются для создания новых молекул нуклеиновых кислот, необходимых для следующего этапа жизни.
Во - вторых, это осуществление так называемого процессинга белков и РНК. Многие белки и РНК синтезируются не в зрелом виде, а в виде предшественников, содержащих дополнительные фрагменты полипептидных и полинуклеотидных цепей. Эти фрагменты удаляются с помощью специальных гидролаз, и такая обработка предшественников с образованием зрелых молекул называется процессингом.
Гидролазы находят применение и в пищевых технологиях. В хлебопекарном и пивоваренном производствах используются амилазы для улучшения качества теста и осоложения крахмала. Протеиназы и целлюлазы оказываются полезными реагентами в виноделии и приготовлении соков. Протеиназы ускоряют процесс мягчения мяса, улучшающего консистенцию, а также применяются при производстве сыров.
Глюкозидазы
Выделение a– амилазы
10 мл солодовой вытяжки нагревают в пробирке при 70 °С в течение 15 минут, после чего раствор охлаждают и используют для исследования активности фермента. b–амилаза при этой температуре инактивируется.
Выделение b –амилазы
15 мл солодовой вытяжки вносят в стакан, добавляют 3 мл 0,1 н. раствора соляной кислоты и 12 мл воды до общего объема 30 мл (рН при этом должно быть 3,3) и оставляют в холодильнике на15 мин. Затем к раствору добавляют 6 мл 0,15 М раствора фосфорнокислого натрия (двухзамещенного) с целью доведения рН среды до 6,0. Раствор берут для определения осахаривающей способности b–амилазы, так как a– амилаза в кислой среде инактивирована.
Протеазы
Протеазы или протеолитические ферменты – это группа ферментов, относящаяся к классу гидролаз и подклассу пептид–гидролаз.
|
|
Пептид–гидролазы – ускоряют гидролиз пептидных связей в белках и пептидах.
В зависимости от характера действия протеазы делятся на протеиназы и пептидазы.
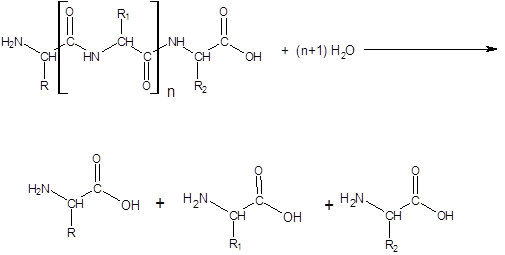 |
Пептидазы катализируют гидролиз пептидных связей в пептидах с образованием свободных аминокислот (экзопептидазы). Пептидазы могут отщеплять от пептида аминокислоту, имеющую свободную аминогруппу (¾NН2) – это аминопептидазы, либо аминокислоту, имеющую свободную карбоксильную группу (¾СООН) –карбоксипептидазы.
Очень важной особенностью протеаз является выборочный (селективный) характер их действия на пептидные связи в белковой молекуле. Так, пепсин избирательно ускоряет гидролиз пептидных связей, образованных аминокислотами Фен и Лей; трипсин – Арг и Лиз; химотрипсин – ароматическими аминокислотами Фен, Трп, Тир; папаин – Арг, Лиз, Фен и т. д. (см. рисунок5)
Причина избирательного действия пептид–гидролаз заключается в том, что радикал аминокислоты, по соседству с которым гидролизуется пептидная связь, служит для образования фермент–субстратного комплекса.
Механизм действия пептидгидролаз рассмотрен на примере действия химотрипсина (см. рисунок 6).
Фрагменты единой полипептидной цепи молекулы фермента условно показаны слева и справа изогнутой линией, в их составе отмечены остатки сер и гис с их функциональными группами. В активном центре фермента точно против остатков сер и гис размещается пептидная связь гидролизуемого белка, образованная остатком фен ( или

1 – лейцинаминопептидаза
2 – пепсин
3 – трипсин
4 – химотрипсин
5 – карбоксипептидаза А
Рисунок 5 – Точки приложения действия протеолитических ферментов на пептидные связи
в белковой молекуле
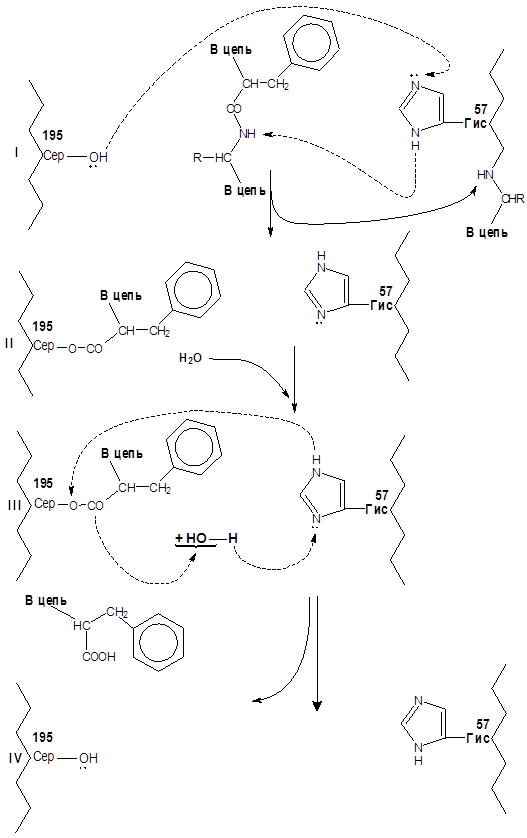 |
тир, три, лей), благодаря контакту радикала фен (или тир, три, лей) с субстратным центром, фермента, который на рисунке не показан. Вследствие того, что электронная пара кислорода гидроксильной группы радикала сер акцептируется карбонильной группой пептидной связи, создаются условия для миграции протона от гидроксила сер к имидазольному радикалу остатка гис для ацилирования радикала сер с одновременным разрывом пептидной связи. Одновременно протон от имидазольного ядра радикала гис перемещается к NН – групп деструктируемой пептидной связи (I). После ацилирования радикала сер (II) в активный центр фермента входит молекула воды, инициирующая распад ацильного производного фермента (III) и восстановлении исходного состояния активного центра (IV), готового принять новую молекулу субстрата или атаковать пептидную связь, образованную остатками фен, тир, три или лей в том же субстрате.
|
|
Ферментативный гидролиз белков находит практическое использование при определении первичной структуры белков, для регуляции обмена веществ, т.к. многие продукты селективного гидролиза белков обладают высочайшей биологической активностью: именно этим путем из проферментов образуются ферменты, из предшественников гормонов – гормоны и рилизинг – факторы.
Важным этапом технологии многих пищевых производств являются биохимические превращения белков, происходящие под действием протеолитических ферментов. Повышенная активность протеаз наблюдается в прорастающем зерне пшеницы, ржи, что приводит к снижению хлебопекарных достоинств муки из такого зерна. На пивоваренных заводах ячмень проращивают с целью накопления ферментов, в том числе и протеолитических, для осуществления гидролиза белковых веществ при приготовлении пивного сусла.
Протеолитические ферменты входят в состав ферментных препаратов грибного и растительного происхождения, широко применяемы для интенсификации технологических процессов производства различных пищевых продуктов и улучшения их качества.
Расчет полученных данных
Протеолитическая активность показыват, какое количество мг белка казеина переводится в растворимую форму одним миллиграммом ферментного препарата при 35 °С, рН 6,6, за определенный промежуток времени. Расчет протеолитической активности (Ер) производится по следующей формуле:
 (16)
(16)
где: Ер – протеолитическая активность ферментного препарата;
С – концентрация ферментного препарата, мг;
А – количество растворимых продуктов гидролиза казеина за определенный промежуток времени, мг
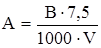 , (17)????
, (17)????
где: В – количество продуктов гидролиза казеина в соответствующе измеренной экстинкции;
7,5 – объем пробы (2 мл субстрата, 0,5 мл ферментного препарата, 5 мл раствора ТХУ);
V – количество раствора, взятого для колориметрирования, мл.
Материалы и реактивы. Казеин (см. Приложение 1, п.7); реактив А, В, С (см. Приложение 1, п.17); реактив Фолина (см. Приложение 1, п. 8); ферментные препараты; 1,125 М раствор ТХУ; 0,75 М раствор едкого натра.
Оборудование. Складчатый фильтр; пробирки; пипетки на 1 и 2 мл с ценой деления 0,05 мл; ФЭК–60 или ФЭК–56М.
Эстеразы
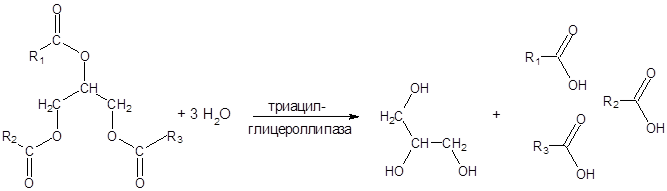 |
По существующей классификации ферментов липаза принадлежит к классу гидролаз и подклассу эстераз, действующих на сложноэфирные связи.
Как и в случае других гидролаз, радикал гис активного центра фермента служит для переноса протонов, радикал сер – для акцептирования ацильной группы, высвобождающейся в момент распада сложноэфирной связи в молекуле триглицерида. Радикал изолейцина взаимодействуют с углеводородным радикалом остатка высшей жирной кислоты и способствует закреплению молекулы триглицерида в активном центре фермента (см. рисунок 7).

Рисунок 9 – Механизм действия триацилглицероллипазы
Скорость расщепления зависит от длины цепи жирных кислот. Скорость реакции уменьшается в ряду: три–, ди–, и моноглицериды.
Источником для получения промышленных препаратов липазы являются поджелудочная железа, семена клещевины.
Активаторами липазы служат соли желчных кислот. Активирующий эффект основан на эмульгирующем действии.
рН–оптимум активности (и стабильности) у разных ферментных препаратов различен и зависит от источника фермента. Так, панкреатическая липаза имеет оптимум активности при рН = 8, липаза молока – при рН = 9, липаза из клещевины – при рН = 4,3, микробные липазы – при рН = 5–6. Из перечисленных липаз наиболее термостабильной является липаза молока.
Липазам принадлежит важная роль в технологии продуктов питания. В молоке слабая липазная активность способствует образованию аромати-зирующих веществ; липаза пшеницы и других злаковых культур способствуют порче муки. Наконец, микробные препараты липазы используются для гидролиза жира в тех случаях, когда необходимо омыление при сохранении биологически активных жирорастворимых веществ (например, токоферола).
ФЕРМЕНТЫ-ГИДРОЛАЗЫ
Методические указания к лабораторному практикуму по дисциплине "Биохимия"
для студентов специальностей Т.18.01., Т.18.02., Т.18.03.
Часть II. «Витамины и ферменты»
"Ферменты" (раздел 1).
Могилев 2000
УДК 557.1
Методические указания рассмотрены и утверждены на заседании кафедры ХТВМС.
Протокол №__ от____2000г.
Составители: доц. О.Н.Макасеева
асс. Л.М.Ткаченко
доц. О.М.Баранов
(графическая часть и оформление)
Научный редактор: профессор Б.Э.Геллер
Рецензенты профессор Г.Н.Роганов
доцент Т.Н.Шингарева
© Могилевский технологический институт
Содержание
С.
Введение...................................................................................................................... 4
1. Классификация и номенклатура............................................................................ 5
2. Определение активности ферментов..................................................................... 6
2.1. Единицы ферментативной активности............................................................. 6
3. Общие свойства ферментов................................................................................... 8
3.1. Специфичность действия ферментов............................................................... 8
3.2. Влияние температуры и рН на активность ферментов................................. 11
3.3. Активирование и ингибирование ферментов................................................ 14
4. Гидролазы............................................................................................................ 15
4.1. Глюкозидазы................................................................................................... 16
4.1.1. Выделение a– и b– амилаз солода.......................................................... 16
4.1.2. Определение декстринирующей способности a–амилазы...................... 19
4.1.3. Влияние температуры на осахаривающую способность b–амилазы..... 20
4.1.4. Определение активности амилолитических ферментов........................... 23
4.1.5. Определение активности амилазы (сывороточная амилаза крови)........ 25
4.2. Протеазы......................................................................................................... 26
4.2.1. Гидролитическое расщепление казеина под действием пепсина............ 30
4.2.2. Определение активности протеаз по методу Ансона.............................. 31
4.2.3. Определение активности протеолитических ферментов......................... 33
4.2.4. Определение протеолитической способности (ПС)................................. 36
4.2.5. Определение протеолитической активности молокосвертывающих препаратов........................................................................................................... 38
4.3. Эстеразы......................................................................................................... 41
4.3.1. Гидролитическое расщепление жира под действием липазы................. 44
4.3.2. Определение активности липазы.............................................................. 45
Список использованных источников........................................................................ 57
Введение
Ферменты, или энзимы – это высокомолекулярный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций. Жизнь и многообразие ее проявлений – это сложная совокупность реакций, катализируемых специфическими ферментами.
Ферменты обеспечивают осуществление таких важнейших процессов жизнедеятельности, как экспрессия (реализация) наследственной информации, биоэнергетика, синтез и распад биомолекул (обмен веществ). По строению ферменты могут быть однокомпонентными – простыми белками, и двухкомпонентными – сложными белками, содержащими небелковый компонент – кофактор. Пептидную часть фермента называют – апоферментом. Молекула фермента характеризуется уникальностью структуры, которая и определяет уникальность ее функции.
Ферменты отличаются тремя уникальными свойствами. Во - первых, это самые эффективные из известных катализаторов, так как очень малые (микромолярные) количества ферментов способны в очень большой степени ускорять реакцию. Большинство реакций в клетке протекает примерно в миллион раз быстрее, чем, если бы они протекали в отсутствие ферментов.
Во-вторых, большинство ферментов отличаются специфичностью действия, практически каждая реакция превращения реагирующего вещества (называемого субстратом) в продукт осуществляется специальным ферментом. И в-третьих, действие большинства ферментов регулируется, т.е. они способны переходить от состояния с низкой активностью к состоянию с высокой активностью и обратно.
Индивидуальность живой клетки в большой степени определяется уникальным набором ферментов, который она генетически запрограммирована производить.
Отсутствие даже одного фермента или какой-нибудь его дефект могут иметь очень серьезные отрицательные последствия для организма.
Изучение ферментов имеет огромное значение для любой фундаментальной и прикладной области биологии, а также для многих практических отраслей (медицины, химической, фармацевтической), занятых приготовлением катализаторов, антибиотиков, витаминов и др. Ферменты играют важную роль и в пищевой промышленности. Превращение исходного сырья в готовые продукты в таких отраслях как виноделие, пивоварение, производство спирта, хлебопечение, сыроварение, консервирование, производство кисломолочных продуктов, осуществляемых при непосредственном участии ферментов, являются биотехнологическими. Ферменты могут способствовать протеканию необходимого технологического процесса или затруднить его протекание.
Наука о питании базируется на точных знаниях поэтапного расщепления питательных веществ под влиянием ферментов пищеварительного аппарата.
В данном методическом указании рассматриваются некоторые ферменты из класса гидролаз и оксидоредуктаз, участвующие в процессе пищеварения и пищевых технологиях.
|
|
|

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!