

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...
Топ:
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Введение
Аналитической химией называют науку о методах анализа вещества. Наряду с общей, неорганической, органической, коллоидной и физической химией аналитическая химия является частью химической науки. Предметом аналитической химии как науки является теория и практика химического анализа.
Аналитическая химия решает общие проблемы теории химического анализа, относящиеся к существующим и вновь создаваемым методам.
Аналитическая химия теоретически обосновывает методы качественного и количественного анализа, с помощью которых можно судить о качественном составе вещества и устанавливать количественные соотношения элементов и химических соединений данного вещества.
Задачи аналитической химии можно сформулировать следующим образом:
· Развитие теории химических и физико-химических методов анализа, научное обоснование, разработка и совершенствование приёмов и методов исследования, в том числе автоматических.
· Разработка методов разделения веществ и методы концентрирования микропримесей.
· Совершенствование и разработка методов анализа природных веществ, окружающей среды и технических материалов и т. д.
· Обеспечение химико-аналитического контроля в процессе проведения разнообразных научно-исследовательских работ в области химии и смежных областей науки, промышленности и техники.
· Поддержание химико-технологических и физико-химических процессов производства на заданном оптимальном уровне на основе систематического химико-аналитического контроля всех звеньев промышленного производства.
· Создание методов автоматического контроля технологических процессов, сочетающихся с системами управления на основе использования электронных вычислительных, регистрирующих, сигнализирующих, блокирующих и управляющих машин, приборов и аппаратов.
|
|
Аналитическая химия в широком смысле понимания является наукой не только о качественных и количественных методах определения элементного и молекулярного состава вещества, но и наукой о методах химико-аналитического контроля физико-химических и химико-технологических процессов.
Аналитическая химия играет огромную роль в научном и техническом прогрессе, в значительной степени способствуя развитию многих естественных наук, например, геохимии, геологии, минералогии, физики, биологии, агрохимии, а также металлургии, медицины и т. п. Особое значение имеет аналитическая химия в развитии самой химической науки – одной из важнейших областей естествознания.
Аналитические определения необходимы для выполнения каждой научно-исследовательской работы по химии. Кроме того, к аналитическим методам исследования прибегают в процессе выполнения научно-исследовательских работ в области геохимии, геологии, минералогии, металлургии, медицины, биологии, агрохимии и др.
Особенно велико значение аналитической химии и химического анализа в производстве, где необходим постоянный контроль для предупреждения брака, причиной которого часто бывают нежелательные примеси в исходном сырье, промежуточных продуктах и готовой продукции.
Аналитическая химия играет решающую роль в деле научного обоснования и разработки современных методов автоматического контроля, без которых невозможно поддержание химико-технологических и физико-химических процессов производства на заданном оптимальном уровне и обеспечение системы автоматического управления производством.
На основании данных химического анализа геологами ведутся поиски полезных ископаемых. На основе многочисленных определений изотопного состава рудных свинцов и метеоритов установлен возраст земной коры (5∙109 лет) и солнечной системы (более 4∙109 – 4,5∙109 лет). По результатам анализа судят о той роли для питания растений и животных, которую играют входящие в состав почв и удобрений так называемые микроэлементы. По данным анализа крови врачи судят о состоянии здоровья человека.
|
|
Без современных методов анализа был бы невозможен синтез новых химических соединений. С другой стороны, новые методы производства требуют более современных методов анализа. Роль аналитической химии особенно существенно растёт в настоящее время, когда у нас решается грандиозная задача создания гигантской химической промышленности.
Химический анализ.
Анализ – это метод исследования, основанный на разложении данного вещества на боле простые составные части.
Анализ вещества может проводиться с целью установления качественного и количественного его состава. В соответствии с этим различают качественный и количественный анализ.
Качественный анализ позволяет установить, из каких химических элементов состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе.
Качественный химический анализ большей частью основывается на превращении анализируемого вещества в какое-нибудь новое соединение, обладающее характерными свойствами: цветом, определённым физическим состоянием, кристаллической или аморфной структурой, специфическим запахом и т. п. Химическое превращение, происходящее при этом, называют качественной аналитической реакцией, а вещества, вызывающие это превращение, называют реактивами (реагентами).
При анализе смеси нескольких веществ, близких по химическим свойствам, их предварительно разделяют и только затем проводят характерные реакции на отдельные вещества (или ионы), поэтому качественный анализ охватывает не только отдельные реакции обнаружения ионов, но и методы и разделения.
Количественный анализ позволяет установить количественные соотношения составных частей данного соединения или смеси веществ. В отличие от качественного анализа, количественный анализ даёт возможность определить содержание отдельных компонентов анализируемого вещества или общее содержание определяемого вещества в исследуемом продукте.
|
|
Методы качественного и количественного анализа, позволяющие определять в анализируемом веществе содержание отдельных элементов, называют элементарным анализом; индивидуальных химических соединений, характеризующихся определённым молекулярным весом, - молекулярным анализом; функциональных групп – функциональным анализом.
Совокупность разнообразных физических, химических и физико-химических методов разделения и определения отдельных структурных (фазовых) составляющих гетерогенных систем, различающихся по свойствам и физическому строению и ограниченных друг от друга поверхностями раздела, называют фазовым анализом.
Глава 1. Общие вопросы
1.1 Пробоподготовка
Анализируемую смесь солей внимательно осматривают, определяя её внешний вид, цвет, запах, степень измельчения, наличие кристаллических или аморфных фаз. Это позволяет установить, является ли смесь однородной, содержит ли она одну или несколько твёрдых фаз – кристаллических или аморфных, каковы размеры частиц.
По окраске анализируемой смеси можно высказать предположения о наличии или отсутствии в ней тех или иных катионов. Если смесь представляет собой бесцветную прозрачную или белую массу, то это указывает на отсутствие в ней значительных количеств окрашенных катионов – Cr3+ (сине-фиолетовый или тёмно-зелёный цвет), Mn2+ (светло-розовый), Fe3+ (жёлто-бурый), Со2+ (розовый), Ni2+ (зелёный), Cu2+ (голубой). Если смесь окрашена, то можно предположить содержание в ней одного или нескольких вышеуказанных катионов. При наличии в смеси нескольких различных окрашенных катионов её цвет может быть промежуточным между цветами индивидуальных окрашенных катионов, в зависимости от их относительного содержания и химической формы (соль, комплекс, оксид и т. д.).
Если смесь представляет собой однородное вещество, легко растворимое в воде, то его обычно растворяют в воде, не растирая в порошок. Если же смесь неоднородна и не очень легко растворяется в воде, то её растирают до однородной массы, состоящей из мелких частиц. Мелкие частицы легче перемешиваются и быстрее растворяются в воде.
|
|
После проведения тщательного осмотра сухую смесь растирают в порошок в агатовой, яшмовой или фарфоровой ступке.
Действие разбавленной серной кислоты. Разбавленная серная кислота вытесняет слабые кислоты из их солей – карбонатов, сульфитов, тиосульфатов, сульфидов, цианидов, нитритов, ацетатов. Выделяющиеся слабые кислоты, неустойчивые в кислой среде, либо улетучиваются, либо разлагаются с образованием газообразных продуктов. Некоторые из них обладают характерным цветом или запахом.
При наличии в смеси карбонатов выделяется газообразный диоксид углерода СО2 (бесцветный и без запаха). При наличии сульфитов и тиосульфатов выделяется диоксид серы SO2 c запахом горящей серы; при наличии сульфидов – сероводород H2S с запахом тухлых яиц; при наличии цианидов – пары синильной кислоты HCN с запахом горького миндаля; при наличии нитритов – бурые пары диоксида азота NO2; при наличии ацетатов – пары уксусной кислоты СН3СООН с запахом уксуса.
Для проведения теста отбирают немного смеси в пробирку и по каплям прибавляют разбавленную серную кислоту. Выделение газов указывает на присутствие в анализируемой смеси вышеуказанных анионов слабых, неустойчивых в кислой среде кислот.
Действие концентрированной серной кислоты на пробу. Концентрированная серная кислота при взаимодействии с анализируемым веществом может выделять газообразные продукты реакций также из фторидов, хлоридов, бромидов, иодидов, тиоцианатов, оксалатов, нитратов.
При наличии в анализируемом веществе фторидов выделяются пары фтороводорода HF; при наличии хлоридов – пары HCl и газообразный хлор; при наличии бромидов – пары HBr и газообразный жёлтый бром; при наличии иодидов – фиолетовые пары йода I2, при наличии тиоцианатов – газообразный диоксид серы, при наличии оксалатов – газообразные оксид СО и диоксид СО2 углерода.
Перевод анализируемого вещества в раствор. Предварительные наблюдения и испытания позволяют сделать предположения и выводы о наличии тех или иных катионов и анионов в анализируемой смеси. Дальнейшее подтверждение этих предположений, а также прямые доказательства присутствия катионов и анионов получают при проведении дробного или систематического анализа. Для этого анализируемую смесь сначала переводят в раствор, подбирая подходящий растворитель.
Растворение пробы в воде. Вначале проверяют растворимость в воде при комнатной температуре и (в случае необходимости) при нагревании. Для этого 2—3 мг анализируемого вещества вносят в пробирку, прибавляют ~1,5 мл дистиллированной воды и перемешивают смесь некоторое время. Если вещество при этом полностью растворилось в воде, то большую часть вещества, отобранную для анализа, растворяют в возможно минимальном объеме дистиллированной воды и полученный раствор анализируют далее. Небольшую часть исходной твердой анализируемой пробы оставляют для проведения повторных или проверочных тестов, если это окажется необходимым.
|
|
Анализируемое вещество может растворяться в воде неполностью. Для выяснения того, произошло ли частичное растворение пробы в воде, смесь анализируемого вещества (2—3 мг) с водой в пробирке тщательно перемешивают, центрифугируют, отбирают 2—3 капли центрифугата, наносят на часовое или предметное стекло и выпаривают досуха. Если после выпаривания на стекле образовался налет твердого вещества, то это означает, что часть твердой пробы растворилась в воде. В таком случае к большей части исходной пробы прибавляют дистиллированную воду, смесь тщательно перемешивают, центрифугируют и отделяют центрифугат от осадка. Последний промывают 3—4 раза небольшимобъемом дистиллированной воды, присоединяя промывные воды к центрифугату. Промывные воды и центрифугат, представляющие собой водную вытяжку растворившейся части пробы, подвергают дальнейшему анализу отдельно от осадка, который далее испытывают на растворимость в кислотах,
Растворение пробы в кислотах. Растворимость в растворах кислот испытывают в том случае, когда анализируемое вещество нерастворимо или частично растворимо в воде. В первом случае проверяют растворимость в кислотах проб (2—3 мг) исходного твердого анализируемого вещества, во втором — проб (2—3 мг) осадка, оставшегося после отделения водной вытяжки.
Отдельно в разных пробирках испытывают растворимость проб в разбавленной уксусной кислоте, разбавленных и концентрированных НСl и НNО3 при необходимости — также в царской водке (при комнатной температуре или при нагревании).
Для проведения теста в пробирки вносят по 2—3 мг анализируемой твердой фазы и прибавляют несколько капель соответствующей кислоты — разбавленной или концентрированной, наблюдая за тем, выделяются или не выделяются газообразные продукты реакций (СО2,SО2, Н2S, NО2). Если вещество не растворяется в кислоте при комнатной температуре, то испытывают его растворимость при нагревании.
При полном растворении пробы в той или иной кислоте для дальнейшего анализа используют полученный раствор.
В случае растворения пробы как в растворе НС1, так и в растворе НN03, для последующего анализа отбирают полученный азотнокислый раствор, так как нитраты менее летучи, чем хлориды, которые частично могут быть потеряны на дальнейших стадиях анализа.
Если проба частично растворяется в уксусной кислоте, то анализируемый образец обрабатывают уксусной кислотой, отделяют центрифугированием нерастворившийся остаток от раствора и уксуснокислый центрифугат подвергают дальнейшему анализу отдельно от осадка. Осадок же испытывают на растворимость в НСl, НNОз, в царской водке, каждый раз отбирая для дальнейшего анализа соответствующий раствор в случае частичного растворения пробы в той или иной кислоте.
Таким образом могут быть получены несколько растворов (водная вытяжка, растворы в разных кислотах), в которых предстоит открыть катионы и анионы. Это в целом облегчает ход анализа, так как уже на этапе растворения происходит частичное разделение некоторых катионов и анионов, которые могут мешать открытию друг друга, если они одновременно присутствуют в одном и том же растворе.
Когда анализируемая смесь содержит сульфаты свинца и катионов третьей аналитической группы, нерастворимые в кислотах, их можно перевести в растворимые в кислотах карбонаты кипячением с насыщенным водным раствором соды Na2СО3 и поташа К2СО3 или же сплавлением со смесью Nа2СО3 и К2СО3.
Классификации катионов
Классификация анионов
Аналитические классификации анионов основаны на их окислительно-восстановительных свойствах, способности образовывать с катионами малорастворимые соединения, а также на реакциях взаимодействия некоторых с кислотами, сопровождающихся выделением газообразных продуктов. В отличие от катионов, единой общепринятой классификации анионов, учитывающей все эти свойства, не существует.
Обнаружение катионов
Анализ смеси, состоящей из трёх неизвестных катионов, начали с проведения предварительных испытаний.
Изучили внешний вид исследуемой смеси. Она состояла из тёмно-зелёных, бесцветных и белых кристаллов. Тёмно-зелёные кристаллы указывают на возможное присутствие катионов хрома. Отсутствие розовых, синих и буро-жёлтых кристаллов говорит об отсутствии соответственно ионов Co2+, Cu2+ и Fe3+.
Измельчили смесь в фарфоровой ступке. Приготовили водную вытяжку: для этого часть исследуемой смеси растворили в воде при нагревании и тщательном перемешивании. При этом небольшое количество вещества осталось в осадке, что свидетельствует о наличии малорастворимого соединения. Также отсутствие в водной вытяжке студенистого осадка указывает на отсутствие в смеси легко гидролизующихся солей Sb3+ и Bi3+.
Провели дробный анализ. Проверили наличие ионов Cr3+: для этого к исследуемому раствору добавили 2М раствор NaOH и 3% Н2О2 и нагрели. Изменение зелёной окраски раствора (цвет аквакомплексов [Cr(H2O)6]3+) на жёлтую (цвет хромат-ионов CrO42-) говорит о присутствии в исследуемой смеси ионов Cr3+.
2[Cr(H2O)6]3+ + 3Н2О2 = 2CrO42- + 6SO42- + 14H+
Проверили наличие ионов Fe2+: к исследуемому раствору прилили раствор красной кровяной соли K3[Fe(CN)6]. Синий осадок не выпал, значит, отсутствуют ионы Fe2+.
Проверили наличие ионов Ni2+ : к анализируемому раствору прилили NH4OH (без избытка), амиловый спирт и диметилглиоксим (реактив Чугаева). Отсутствие малиновой окраски в слое органического растворителя говорит об отсутствии ионов Ni2+.
Проверили содержание в исследуемом растворе ионов аммония NH4+: к раствору прилили избыток щёлочи для растворения выпавших гидроокисей тяжёлых металлов и добавили избыток реактива Несслера (смесь раствора тетраиодомеркурата(II) калия K2[HgI4] с 2н КОН). Образовался красно-бурый осадок иодида меркураммония:
NH4+ + 2[HgI4]2- + 2ОН- = [OHg2NH2]I↓ + 7I- + 3H2O
Cостав осадка описывается формулой:
Провели систематический анализ. К исследуемому раствору добавили этиловый спирт и 2н HCl. Отсутствие осадка свидетельствует об отсутствии катионов I аналитической группы.
К анализируемой водной вытяжке прилили этиловый спирт и 2н H2SO4. осадок не выпал, значит, отсутствуют катионы II аналитической группы.
К исследуемому раствору добавили перекись водорода и 6н NaOH до полного осаждения, затем избыток щёлочи и нагрели при тщательном перемешивании стеклянной палочкой. Прокипятили на водяной бане для удаления избытка перекиси водорода. При этом катионы III аналитической группы остались в растворе, а катионы IV – V группы должны были выпасть в осадок, но этого не произошло, значит, в исследуемом растворе нет катионов IV – V группы.
Находящиеся в полученном растворе ионы CrO42- мешают открытию остальных катионов III аналитической группы, потому для открытия ионов Al3+ провели удаление этих ионов: к раствору добавили сухую соль NH4Cl и прокипятили до полного удаления аммиака (проба со влажной лакмусовой бумажкой). При этом в осадок выпали гидроксиды возможно содержащихся в растворе Al3+ и Sn2+, а в растворе остались ионы CrO42- и, возможно, ионы ZnO22-. Осадок отделили центрифугированием, промыли дистиллированной водой, растворили в 2н HCl и проверили наличие в этом растворе ионов Al3+: к раствору прилили 2н NH4OH до рН = 10-11 и ализарин (1,2 – диоксиантрахинон). Выпал красный осадок «алюминиевого лака», значит, в исследуемом растворе содержались ионы Al3+.
Al(OH)3 + → + H2O
Дальнейший систематический анализ катионов не имеет смысла, так как открыты все находящиеся в анализируемом растворе катионы.
Обнаружение анионов
Анализ раствора, содержащего три неизвестных аниона, начали с предварительных испытаний.
Испытали раствор на присутствие анионов слабых кислот: прибавили 2н раствор H2SO4 и нагрели. Отсутствие помутнения раствора и выделения газов, а также запаха свидетельствует об отсутствии сульфитов, карбонатов, тиосульфатов, нитритов, силикатов и ацетатов.
Испытали раствор на присутствие анионов I аналитической группы: прибавили BaCl2 в щелочной среде. Выпал белый осадок, значит, есть катионы I аналитической группы.
Испытали раствор на присутствие анионов II аналитической группы: к раствору прибавили 2М HNO3 и AgNO3, отсутствие осадка говорит об отсутствии анионов II аналитической группы.
Провели дробный анализ. Для открытия SO42- к раствору прилили BaCl2 и исследовали растворимость образовавшегося белого осадка в разбавленных кислотах. Осадок не растворим в кислотах, значит, это BaSO4 и в исследуемом растворе содержались сульфат-ионы.
Ba2+ + SO42- = BaSO4↓
Открыли ионы PO43-: при добавлении к раствору молибдата аммония (NH4)2MoO4 в азотнокислой среде при нагревании образовался жёлтый кристаллический осадок комплексной аммонийной соли фосфоромолибденовой гетерополикислоты – фосфоромолибдат аммония:
PO43- + 3NH4+ + 12MoO42- + 24H+ = (NH4)3[PO4(MoO3)12] + 12H2O
Добавили к анализируемому раствору раствор дифениламина в сернокислой среде. Раствор окрасился в синий цвет, значит, в нём могут содержаться нитрат- и/или нитрит-ионы. Так как было доказано отсутствие нитрит-ионов в предварительных испытаниях, то в исследуемом растворе содержались только нитрат-ионы.
Нитрат-ион при реакции с дифениламином в сернокислой среде переводит этот органический реагент в продукт его окисления – синий дифенилдифенохинондиимин («дифенилбензидиновый фиолетовый»). Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
2C6H5NHC6H5 → C6H5 – NH – C6H4 – C6H4 – NH – C6H5 + 2H+ + 2e-
Затем происходит обратимое окисление молекулы бензидина присутствующем окислителем до окрашенного в синий цвет дифенилдифенохинондиимина:
C6H5 – NH – C6H4 – C6H4 – NH – C6H5 ↔ C6H5 – N = = = N - C6H5 ++ 2H+ + 2e-
В результате раствор окрашивается в синий цвет. Образовавшийся синий продукт окисления дифениламина далее необратимо разрушается вначале до продуктов реакции бурого, а затем – жёлтого. В соответствии с этим при стоянии синей смеси её окраска постепенно изменяется сначала на бурую, а затем на жёлтую.
Титрование хрома(VI).
Выбор методики
Для анализа была выбрана методика окисления хрома (III) до хрома (VI) персульфатом и титрование полученного бихромата тиосульфатом натрия как наиболее точный и требующий меньших временных затрат.
Экспериментальная часть
Титриметрический метод
Реактивы:
· Na2S2O3, 0,05 М раствор
· AgNO3, 0,01 М раствор
· крахмал
· KI, 20%-й раствор
· H2SO4, 1М
· персульфат аммония
Навеску пробы растворили в 100 мл дистиллированной воды. Отобрали по 10 мл полученного раствора в три термоустойчивые колбы для титрования. В каждую добавили по 10 мл серной кислоты, 5 мл раствора AgNO3 и 1г персульфата аммония, взвешенного на технических весах. Перемешали и нагрели на плитке до кипения. Кипятили 20 мин до появления ярко-жёлтой окраски раствора. Затем остудили, добавили по 5 мл раствора KI. Выделившийся йод оттитровали тиосульфатом натрия с индикатором крахмалом, 5 капель которого добавили в конце титрования. Титровали до исчезновения синей окраски и превращения цвета раствора в молочно-зелёный.
Расчётная формула



Обработка результатов
Провели три титрования:
V1 = 11,9 мл
V2 = 11,8 мл Vср = 11,9 мл
V3 = 12,0 мл

mтеор(Cr) = 0,1027 мг
Ошибка: ε =  *100% = 0,38%
*100% = 0,38%
Электрохимический метод
Расчётная формула
m(Cr3+)= 
m(Cr3+)=  =0,1016 мг
=0,1016 мг
mтеор= 0,1027 мг
Ошибка: ε = 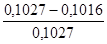 *100% = 1,1%
*100% = 1,1%
Вывод
В ходе данной работы был проведён качественный анализ смеси неизвестного состава и количественный анализ одного из компонентов по двум методикам.
Ошибки определения по титриметрическому и электрохимическому методу составили соответственно 0,38% и 1,1%.
Возможные причины ошибок:
· погрешности приборов;
· потери вещества при отборе аликвот;
· в электрохимическом методе при многократном разбавлении раствора;
· при приготовлении рабочих растворов из стандартных;
В случае присутствия в растворе кроме Cr3+ других обнаруженных ранее ионов, мешающее влияние оказал бы ион Cl-,дающий осадокAgCl при добавлении AgNO3 в качестве катализатора; и ион Al3+, образующий комплекс с ЭДТА.
Список литературы
1. Шарло Г. Методы аналитической химии. Количественный анализ неорганических соединений. Часть вторая.- М.: Химия, 1969.
2. Крешков А.П. Основы аналитической химии. Книга 2.- М.: Химия, 1965.
3. Алексеев В. Н. Количественный анализ. Под ред. д-ра хим. наук П. К. Агасяна. – М.: Химия, 1972.
4. Харитонов Ю.Я. Аналитическая химия (аналитика). Книга 2.- М.: Высшая школа, 2003.
5. Харитонов Ю.Я. Аналитическая химия (аналитика). Книга 1.- М.: Высшая школа, 2003.
Введение
Аналитической химией называют науку о методах анализа вещества. Наряду с общей, неорганической, органической, коллоидной и физической химией аналитическая химия является частью химической науки. Предметом аналитической химии как науки является теория и практика химического анализа.
Аналитическая химия решает общие проблемы теории химического анализа, относящиеся к существующим и вновь создаваемым методам.
Аналитическая химия теоретически обосновывает методы качественного и количественного анализа, с помощью которых можно судить о качественном составе вещества и устанавливать количественные соотношения элементов и химических соединений данного вещества.
Задачи аналитической химии можно сформулировать следующим образом:
· Развитие теории химических и физико-химических методов анализа, научное обоснование, разработка и совершенствование приёмов и методов исследования, в том числе автоматических.
· Разработка методов разделения веществ и методы концентрирования микропримесей.
· Совершенствование и разработка методов анализа природных веществ, окружающей среды и технических материалов и т. д.
· Обеспечение химико-аналитического контроля в процессе проведения разнообразных научно-исследовательских работ в области химии и смежных областей науки, промышленности и техники.
· Поддержание химико-технологических и физико-химических процессов производства на заданном оптимальном уровне на основе систематического химико-аналитического контроля всех звеньев промышленного производства.
· Создание методов автоматического контроля технологических процессов, сочетающихся с системами управления на основе использования электронных вычислительных, регистрирующих, сигнализирующих, блокирующих и управляющих машин, приборов и аппаратов.
Аналитическая химия в широком смысле понимания является наукой не только о качественных и количественных методах определения элементного и молекулярного состава вещества, но и наукой о методах химико-аналитического контроля физико-химических и химико-технологических процессов.
Аналитическая химия играет огромную роль в научном и техническом прогрессе, в значительной степени способствуя развитию многих естественных наук, например, геохимии, геологии, минералогии, физики, биологии, агрохимии, а также металлургии, медицины и т. п. Особое значение имеет аналитическая химия в развитии самой химической науки – одной из важнейших областей естествознания.
Аналитические определения необходимы для выполнения каждой научно-исследовательской работы по химии. Кроме того, к аналитическим методам исследования прибегают в процессе выполнения научно-исследовательских работ в области геохимии, геологии, минералогии, металлургии, медицины, биологии, агрохимии и др.
Особенно велико значение аналитической химии и химического анализа в производстве, где необходим постоянный контроль для предупреждения брака, причиной которого часто бывают нежелательные примеси в исходном сырье, промежуточных продуктах и готовой продукции.
Аналитическая химия играет решающую роль в деле научного обоснования и разработки современных методов автоматического контроля, без которых невозможно поддержание химико-технологических и физико-химических процессов производства на заданном оптимальном уровне и обеспечение системы автоматического управления производством.
На основании данных химического анализа геологами ведутся поиски полезных ископаемых. На основе многочисленных определений изотопного состава рудных свинцов и метеоритов установлен возраст земной коры (5∙109 лет) и солнечной системы (более 4∙109 – 4,5∙109 лет). По результатам анализа судят о той роли для питания растений и животных, которую играют входящие в состав почв и удобрений так называемые микроэлементы. По данным анализа крови врачи судят о состоянии здоровья человека.
Без современных методов анализа был бы невозможен синтез новых химических соединений. С другой стороны, новые методы производства требуют более современных методов анализа. Роль аналитической химии особенно существенно растёт в настоящее время, когда у нас решается грандиозная задача создания гигантской химической промышленности.
Химический анализ.
Анализ – это метод исследования, основанный на разложении данного вещества на боле простые составные части.
Анализ вещества может проводиться с целью установления качественного и количественного его состава. В соответствии с этим различают качественный и количественный анализ.
Качественный анализ позволяет установить, из каких химических элементов состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе.
Качественный химический анализ большей частью основывается на превращении анализируемого вещества в какое-нибудь новое соединение, обладающее характерными свойствами: цветом, определённым физическим состоянием, кристаллической или аморфной структурой, специфическим запахом и т. п. Химическое превращение, происходящее при этом, называют качественной аналитической реакцией, а вещества, вызывающие это превращение, называют реактивами (реагентами).
При анализе смеси нескольких веществ, близких по химическим свойствам, их предварительно разделяют и только затем проводят характерные реакции на отдельные вещества (или ионы), поэтому качественный анализ охватывает не только отдельные реакции обнаружения ионов, но и методы и разделения.
Количественный анализ позволяет установить количественные соотношения составных частей данного соединения или смеси веществ. В отличие от качественного анализа, количественный анализ даёт возможность определить содержание отдельных компонентов анализируемого вещества или общее содержание определяемого вещества в исследуемом продукте.
Методы качественного и количественного анализа, позволяющие определять в анализируемом веществе содержание отдельных элементов, называют элементарным анализом; индивидуальных химических соединений, характеризующихся определённым молекулярным весом, - молекулярным анализом; функциональных групп – функциональным анализом.
Совокупность разнообразных физических, химических и физико-химических методов разделения и определения отдельных структурных (фазовых) составляющих гетерогенных систем, различающихся по свойствам и физическому строению и ограниченных друг от друга поверхностями раздела, называют фазовым анализом.
Глава 1. Общие вопросы
1.1 Пробоподготовка
Анализируемую смесь солей внимательно осматривают, определяя её внешний вид, цвет, запах, степень измельчения, наличие кристаллических или аморфных фаз. Это позволяет установить, является ли смесь однородной, содержит ли она одну или несколько твёрдых фаз – кристаллических или аморфных, каковы размеры частиц.
По окраске анализируемой смеси можно высказать предположения о наличии или отсутствии в ней тех или иных катионов. Если смесь представляет собой бесцветную прозрачную или белую массу, то это указывает на отсутствие в ней значительных количеств окрашенных катионов – Cr3+ (сине-фиолетовый или тёмно-зелёный цвет), Mn2+ (светло-розовый), Fe3+ (жёлто-бурый), Со2+ (розовый), Ni2+ (зелёный), Cu2+ (голубой). Если смесь окрашена, то можно предположить содержание в ней одного или нескольких вышеуказанных катионов. При наличии в смеси нескольких различных окрашенных катионов её цвет может быть промежуточным между цветами индивидуальных окрашенных катионов, в зависимости от их относительного содержания и химической формы (соль, комплекс, оксид и т. д.).
Если смесь представляет собой однородное вещество, легко растворимое в воде, то его обычно растворяют в воде, не растирая в порошок. Если же смесь неоднородна и не очень легко растворяется в воде, то её растирают до однородной массы, состоящей из мелких частиц. Мелкие частицы легче перемешиваются и быстрее растворяются в воде.
После проведения тщательного осмотра сухую смесь растирают в порошок в агатовой, яшмовой или фарфоровой ступке.
Действие разбавленной серной кислоты. Разбавленная серная кислота вытесняет слабые кислоты из их солей – карбонатов, сульфитов, тиосульфатов, сульфидов, цианидов, нитритов, ацетатов. Выделяющиеся слабые кислоты, неустойчивые в кислой среде, либо улетучиваются, либо разлагаются с образованием газообразных продуктов. Некоторые из них обладают характерным цветом или запахом.
При наличии в смеси карбонатов выделяется газообразный диоксид углерода СО2 (бесцветный и без запаха). При наличии сульфитов и тиосульфатов выделяется диоксид серы SO2 c запахом горящей серы; при наличии сульфидов – сероводород H2S с запахом тухлых яиц; при наличии цианидов – пары синильной кислоты HCN с запахом горького миндаля; при наличии нитритов – бурые пары диоксида азота NO2; при наличии ацетатов – пары уксусной кислоты СН3СООН с запахом уксуса.
Для проведения теста отбирают немного смеси в пробирку и по каплям прибавляют разбавленную серную кислоту. Выделение газов указывает на присутствие в анализируемой смеси вышеуказанных анионов слабых, неустойчивых в кислой среде кислот.
Действие концентрированной серной кислоты на пробу. Концентрированная серная кислота при взаимодействии с анализируемым веществом может выделять газообразные продукты реакций также из фторидов, хлоридов, бромидов, иодидов, тиоцианатов, оксалатов, нитратов.
При наличии в анализируемом веществе фторидов выделяются пары фтороводорода HF; при наличии хлоридов – пары HCl и газообразный хлор; при наличии бромидов – пары HBr и газообразный жёлтый бром; при наличии иодидов – фиолетовые пары йода I2, при наличии тиоцианатов – газообразный диоксид серы, при наличии оксалатов – газообразные оксид СО и диоксид СО2 углерода.
Перевод анализируемого вещества в раствор. Предварительные наблюдения и испытания позволяют сделать предпол
|
|
|

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!