1) Составить формулы исходных веществ и возможных продуктов реакции.
2) Поставить коэффициенты в уравнении реакции.
3) Выделить слабые электролиты, т.е. вещества, которые плохо распадаются на ионы (малорастворимые вещества, слабые кислоты или основания, вода).
1) 4) Напишите полное ионное уравнение, записывая вместо формулы электролита ионы, на которые он распадается с учетом числа этих ионов в молекуле (индекса) и числа молекул этого вещества (коэффициента в уравнении). Слабые электролиты на ионы не расписывают.
5) Вычеркните ионы, которые повторяются в правой и левой части уравнения, а значит в процессе реакции участия не принимают.
6) Перепишите оставшиеся формулы отдельной строкой. Это будет называться сокращенным ионным уравнением.
Сокращенное ионное уравнение показывает суть процесса, происходящего между электролитами. Ионы, которые не принимают участия в реакции, в это уравнение не записывают.
10. Исследования диссоциации веществ со временем расширило представления о веществах, проявляющих кислотные и основные свойства. В 1923 году Бренстед и Лоури предложили протонную теорию кислот и оснований. Согласно этой теории, кислотами следует называть вещества, которые могут быть донорами протонов, а основаниями – вещества, способные присоединять протон (акцепторы протонов).
 А
А  В + Н+, где А- кислота, В- основание, сопряженное этой кислоте. По этой теории кислотами и основаниями могут быть не только нейтральные частицы, но и ионы.
В + Н+, где А- кислота, В- основание, сопряженное этой кислоте. По этой теории кислотами и основаниями могут быть не только нейтральные частицы, но и ионы.
НСl  H+ + Cl-
H+ + Cl-
NH4+  H+ + NH3
H+ + NH3
HCO3-  H+ + CO32-
H+ + CO32-
Протоны, которые отдает кислота, должны присоединяться к другим молекулам. А основание, чтобы присоединить протон тоже должен получить его от другой молекулы. Этим другим веществом может быть растворитель. Если растворитель не способен ни присоединять, ни отдавать протоны, то в нем вещество не может проявлять ни кислотных, ни основных свойств. Т.е. растворенное вещество и растворитель должны образовывать пару:
А1 + В2  В1 + А2
В1 + А2
Таким растворителем, который может и присоединять, и отдавать протон, является вода. При отсутствии воды многие из известных нам кислот вообще не проявляют кислотные свойства. И диссоциацию кислоты и основания в воде, согласно этой теории, надо записывать так:
НCl + H2O 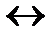 H3O+ + Cl- , где ион H3O+ называется ионом гидроксония.
H3O+ + Cl- , где ион H3O+ называется ионом гидроксония.
NH3 +H2O  NH4+ + OH-
NH4+ + OH-
Если электролит проявляет свойства и кислот, и оснований его называют амфотерным или амфолитом. Вода является очень слабым амфотерным электролитом, у кислот она принимает протон, а основаниям отдает его. Ее диссоциация идет по схеме:
H2O  H++ OH-
H++ OH-
Константа диссоциации воды очень малая величина
 , при 2980К
, при 2980К
Подставив в это уравнение равновесную концентрацию недиссоциированных молекул воды (число моль воды в 1 л [H2O] = 55,6 моль/л), получаем новую постоянную, которую в теории растворов называют ионным произведением воды:
КВ=К·[H2O]= [ H + ]· [ OH - ]  10-14моль/л
10-14моль/л
В чистой воде концентрации ионов водорода и гидроксила одинаковы, т.е. [H+] = [OH-]= 10-7 моль/л. Эти величины ([H+] и [OH-]) сопряженные, увеличение одной вызывает уменьшение другой. Следовательно, характер среды можно определять по содержанию одного из этих ионов, поэтому обычно говорят о концентрации только ионов водорода [H+].
При [ H + ] =10-7 моль/л – среда нейтральная, [H+] = [OH-]
при [ H + ] >10-7 моль/л – среда кислая, [H+] > [OH-]
при [ H + ] <10-7 моль/л – среда щелочная, [H+] < [OH-].
Поскольку работать с такими малыми величинами неудобно, с 1909 года пользуются шкалой рН. – Водородный показатель рН = - lg [ H + ], это еще один способ выражения концентрации ионов водорода. Т.е. можно сказать концентрация ионов водорода равна 10-3 моль/л ([H+] = 10-3 моль/л), а можно сказать, что водородный показатель раствора равен 3 (рН = 3). Смысл этих выражений один и тот же.
Прологарифмировав предыдущие выражения, получим:
При рН = 7 – среда нейтральная, при рH > 7 – среда щелочная, при рH <7 – среда кислая.
Под [H+] понимают равновесную концентрацию ионов водорода, т.е. величина рН – мера активной кислотности среды, она показывает реальную концентрацию ионов водорода в растворе. [H+] м.б. меньше общей кислотности. которая определяется начальной молярной концентрацией кислоты. Для сильных кислот в разбавленных растворах активная кислотность и общая кислотность совпадают, потому что все молекулы кислоты распались на ионы, т.е. концентрация ионов водорода равна начальной концентрации кислоты. Для слабых кислот – надо учитывать степень диссоциации.
11  *. Внутренние среды организма являются водными растворами. рН этих растворов оказывает влияние на жизнедеятельность клеток и организма в целом, потому что концентрация ионов водорода влияет на диссоциацию всех слабых электролитов в клетках и межклеточной жидкости, а значит и на концентрацию тех или других ионов. Ионы водорода участвуют в процессах окисления-восстановления, катализируют процессы этерификации и гидролиза, от них зависит процесс денатурации белков. Значения рН внутренних сред организма характеризуются значительным постоянством и устойчивостью, и это постоянство является основой гомеостаза. Например: рН слюны 6,35-6,85. Если кислотность слюны повышена – разрушается зубная эмаль, снижается активность пищеварительных ферментов. Для нормального пищеварения в желудке рН желудочного сока должна быть в норме 1,53-1,67. Повышенная кислотность (1,48 и меньше) провоцирует гастрит и язвенную болезнь, пониженная – ухудшает переваривание пищи, способствует процессам гниения в желудке и общей интоксикации организма. Секрет поджелудочной железы имеет слегка щелочную среду рН 7,50-8,00. А в тонком кишечнике она опять падает до 4,00. рН плазмы крови одна из самых жестких констант организма, в норме он составляет 7,36. При сдвиге рН плазмы всего на 0,1 в организме начинают протекать патологические процессы, а при сдвиге рН на 0, 2 может развиться коматозное состояние. Изменение рН крови меняет свойства белков, является причиной потери ими биологической активности. К белкам относятся многие жизненно важные БАВ, например, ферменты и гормоны.
*. Внутренние среды организма являются водными растворами. рН этих растворов оказывает влияние на жизнедеятельность клеток и организма в целом, потому что концентрация ионов водорода влияет на диссоциацию всех слабых электролитов в клетках и межклеточной жидкости, а значит и на концентрацию тех или других ионов. Ионы водорода участвуют в процессах окисления-восстановления, катализируют процессы этерификации и гидролиза, от них зависит процесс денатурации белков. Значения рН внутренних сред организма характеризуются значительным постоянством и устойчивостью, и это постоянство является основой гомеостаза. Например: рН слюны 6,35-6,85. Если кислотность слюны повышена – разрушается зубная эмаль, снижается активность пищеварительных ферментов. Для нормального пищеварения в желудке рН желудочного сока должна быть в норме 1,53-1,67. Повышенная кислотность (1,48 и меньше) провоцирует гастрит и язвенную болезнь, пониженная – ухудшает переваривание пищи, способствует процессам гниения в желудке и общей интоксикации организма. Секрет поджелудочной железы имеет слегка щелочную среду рН 7,50-8,00. А в тонком кишечнике она опять падает до 4,00. рН плазмы крови одна из самых жестких констант организма, в норме он составляет 7,36. При сдвиге рН плазмы всего на 0,1 в организме начинают протекать патологические процессы, а при сдвиге рН на 0, 2 может развиться коматозное состояние. Изменение рН крови меняет свойства белков, является причиной потери ими биологической активности. К белкам относятся многие жизненно важные БАВ, например, ферменты и гормоны.
12. Рассмотрим реакцию нейтрализации более детально. Напомним, нейтрализацией называется реакция между кислотой и основанием, в этой реакции образуется соль и вода. Например,
H2S + 2NaOH = Na2S + 2H2O или H3PO4 + 3KOH == K3PO4 + 3H2O
Реакции обмена между электролитами, в принципе, являются обратимыми процессами. Реакцию обратную реакции нейтрализации, т.е. взаимодействие соли с водой и образование соответствующей кислоты и основания, принято называть реакцией гидролиза. Равновесие в реакциях ионного обмена всегда сдвинуто в сторону образования наиболее слабого электролита. Вода – очень слабый электролит, К дис.= 10 -16. И если в реакцию вступают сильная кислота и сильное основание, то ясно что равновесие сдвинуто в сторону образования воды и процесс нейтрализации становится практически необратимым. Но если в реакции участвуют слабая кислота или слабое основание, или они оба очень слабые, то говорить о необратимости процесса нейтрализации уже нельзя. Наоборот, можно утверждать, что реакция соль с водой протекать будет. Можно сказать иначе: будет проходить гидролиз соли. Насколько обратимым будет процесс обмена ионами? Будет ли гидролиз преобладать над реакцией нейтрализации? Это зависит от многих факторов, прежде всего от К диссоциации слабой кислоты или слабого основания, которые участвуют в этой реакции.
Как доказать, что в растворе соли протекает процесс гидролиза? Мы знаем, что в растворах кислот, которые диссоциируют с образованием ионов водорода, среда кислая, а в растворах щелочей ионов гидроксида больше, чем ионов водорода, поэтому там среда щелочная. А какая среда в растворах солей?
1) Если соль образована сильным основанием и слабой кислотой
Na2CO3 + H2O 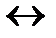 NaOH + HCO 3-
NaOH + HCO 3-
2Na+ + CO32- + H2O 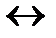 2Na+ + OH + HCO 3-
2Na+ + OH + HCO 3-
CO32- + H2O 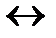 OH- + HCO 3-
OH- + HCO 3-
Ион водорода воды (Н-ОН) связывается анионом слабой кислоты, образуется слабый электролит и в растворе остается сильное основание, а значит будет избыток ОН-, среда щелочная.
2) если соль образована слабым основанием и сильной кислотой
FeCl3+ H2O 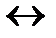 FeOH2+ + HCl,
FeOH2+ + HCl,
Fe3++ H2O 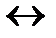 FeOH2+ + H+
FeOH2+ + H+
Ион ОН- воды (Н-ОН) связывается катионом слабого основания, образуется слабый электролит, в растворе остается сильная кислота, а значит будет избыток Н+, среда кислая.
3) если соль образована сильным основанием и сильной кислотой гидролиз не проходит
NaCl + H2O 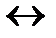 NaOH + HCl,
NaOH + HCl,
Na+ + Cl- + H2O 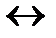 Na+ + OH- + H+ + Cl-,
Na+ + OH- + H+ + Cl-,
H2O 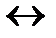 OH- + H+
OH- + H+
т.к. при обмене ионами между солью и водой образуются два сильных электролита, которые опять распадаются на ионы, и реакция среды не изменяется. [H+] = [OH-], среда нейтральная.
4) Если соль образована слабым основанием и слабой кислотой, гидролиз протекает и по катиону, и по аниону. Гидролиз становится необратимым, и соль разлагается на основание и кислоту.
Al2S3 + H2O 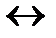 AlOH 2+ + HS -
AlOH 2+ + HS -
При этом в растворе не накапливаются ионы H+ или ОН-, рН раствора существенно не изменяется, незначительный сдвиг рН возможен, он зависит от константы диссоциации слабой кислоты и слабого основания. Т.е. растворы таких солей хранить нельзя.
Правила гидролиза:
1. Сильное побеждает слабое (т.е. среда раствора определяется сильным электролитом).
2. При повышении температуры гидролиз усиливается (по правилу Ле Шателье, т.к. гидролиз – реакция эндотермическая).
3. При повышении концентрации соли гидролиз уменьшается (опять по правилу Ле Шателье).
Вывод: растворы солей способных к гидролизу лучше хранить в концентрированном виде в холодном месте, если соль в значительной мере подвергается гидролизу, значит ее в виде растворов хранить нельзя. Реакция нейтрализации и реакция гидролиза солей – это два взаимообратных процесса. Куда будет сдвинуто равновесие и насколько оно сдвинуто, зависит от соотношения констант диссоциации кислоты и основания.
Если в реакции происходит обмен протонами между двумя частицами, такую реакцию называют протолитической. К протолитическим реакциям относятся также реакции диссоциации кислот и оснований в воде. Частицу, от которой отрывается протон называют кислотой Льюиса, частицу которая присоединяет протон называют основанием Льюиса.
В общем случае, гидролиз (гидро – вода, лизис – разложение) – это реакция вещества с водой, при которой исходное вещество распадается на два новых вещества. Многие биоорганические вещества (белки, полисахариды, жиры, нуклеиновые кислоты) подвергаются гидролизу (т.е. взаимодействуют с водой) под действием ферментов. Например, процессы гидролиза белков, полисахаридов и жиров, которые протекают при пищеварении. Очень важной для организма является реакция гидролиза АТФ, при которой освобождается энергия, необходимая для различных физиологических процессов.
13*. При метаболизме (в процессах окисления и др.) в клетках образуются различные кислоты. Большинство из них окисляется до конца и затем выделяется клетками в виде углекислого газа (а это тоже угольная кислота!), который при помощи фермента карбогидразы связывается в эритроцитах с гемоглобином и переносится в легкие. Кроме СО2, в процессе окисления образуются нелетучие кислоты (молочная, пировиноградная, уксусная и т.д.), за сутки – 1ммоль/л ионов водорода на 1 кг массы тела при нормальном питании. Это примерно 3 литра концентрированной соляной кислоты, и рН плазмы снизился бы до 2,7. Это привело бы к гибели живого организма. Поэтому живой организм вынужден все время нейтрализовать образующиеся кислоты, чтобы подержать определенную концентрацию ионов водорода в различных тканях и органах. Эту способность живых организмов поддерживать постоянство рН биологических жидкостей, тканей и органов называют кислотно-основным равновесием или гомеостазом. Кислотно-основный гомеостаз обеспечивается работой выделительных систем организма (почки, легкие) и наличием нескольких буферных систем, входящих в состав различных тканей.
Но прежде чем говорить о буферных системах организма, давайте разберемся: а что это такое - буферные растворы?
Растворы, содержащие смесь слабого электролита и его соли, сохраняющие характерные для него значения pH при разбавлении, добавлении сильных кислот или щелочей, называются буферными. Простейший буферный раствор - это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион (например, смесь уксусной кислоты СН3СООН и ацетата натрия СН3СООNa), либо смесь слабого основания и соли, имеющей с этим основанием общий катион (например, смесь гидроксида аммония NH4OH с хлоридом аммония NH4Cl).
Буферное действие раствора обусловлено смещением кислотно-основного равновесия в растворе слабого электролита за счет связывания добавляемых в раствор ионов Н+ и ОН-, в результате реакции этих ионов и компонентов буферной системы с образованием слабых электролитов. Однако буферные растворы сохраняют постоянство pH только до прибавления определенного количества сильной кислоты или щелочи, то есть буферные растворы обладают определенной «емкостью». Буферная емкость определяется количеством эквивалентов сильной кислоты или основания, которые необходимо добавить к 1 л буферного раствора, чтобы изменить его pH на единицу. Т. е. это величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении сильных кислот или сильных оснований.
Рабочий участок буферной системы, т. е. значения рН при которых буферная система способна противодействовать изменению рН при добавлении кислот и щелочей, имеет протяженность приблизительно одну единицу рН с каждой стороны от точки рН = р Ка. Вне этого интервала буферная емкость быстро падает до 0. Интервал рН = р Ка + 1 называется зоной буферного действия. Буферные растворы широко используются в медицине, для создания среды с определенным уровнем рН.
Буферные системы организма. Бикарбонатная – главная буферная система организма. Она состоит из двух кислотно-основных частей, находящихся в динамическом равновесии. Поэтому такая система имеет достаточно большую емкость и широкую зону буферного действия.
Н2О + СО2  Н2СО3
Н2СО3  Н+ + НСО3-
Н+ + НСО3-
Особенность бикарбонатной системы в том, что она открыта. Это означает, что она непосредственно связана с выделительными системами организма. Избыток ионов водорода связывается с бикарбонатом, образующийся углекислый газ стимулирует дыхательный центр, вентиляция легких повышается, и излишки углекислого газа удаляются при дыхании. Чем больше в клетках образуется ионов водорода, тем больше расход бикарбонатного буфера. На этом этапе метаболизма подключаются почки, которые выводят с мочой избыток ионов водорода, и синтезируют бикарбоната.
Активно функционируют в крови и внутри клеток небикарбонатные системы. К ним относится фосфатный буфер, который может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трех ионов водорода (трехосновная кислота!) и имеет три Кдис, поэтому буферная емкость фосфатного буфера достаточно велика и имеет широкую зону буферного действия. Наличие аминокислот и белков в клетках и межклеточной жидкости говорит о том, что там могут существовать и различные белковые буферные системы. В зависимости от рН биологической жидкости белковая буферная системы может связывать как гидроксильные группы, так и ионы водорода. Третья часть буферной емкости крови приходится на белок гемоглобин. Каждая молекула гемоглобина может нейтрализовать несколько ионов водорода. Когда кислород переходит из гемоглобина в ткани, способность гемоглобина связывать ионы водорода возрастает и наоборот: когда в легких происходит оксигенация гемоглобина, он теряет присоединенные ионы водорода. Освободившиеся Н+ реагируют с бикарбонатом, и в результате образуется углекислый газ и вода. Т.е. восстановление гемоглобинового буфера в организме идет за счет бикарбонатного.
Дисбаланс рН может проявляться повышенной концентрацией ионов Н+ - ацидоз, или пониженной – алкалоз. При алкалозе ЖКТ пища усваивается медленнее, токсины проникают из кишечника в кровь. Могут появиться проблемы с кожей и печенью. Появляется сильный и неприятный запах изо рта и от тела. Активизируются паразиты и бактерии в кишечнике. Но в большинстве случаев, и в ЖКТ и в других органах и тканях, мы имеем дело с ацидозом. В этом состоянии организм плохо усваивает минералы, от недостатка ионов натрия, калия, кальция и магния страдают жизненно важные органы. Появляются заболевания сердечно-сосудистой системы: спазм сосудов, гипоксия. Развивается ожирение и диабет; заболевания почек и мочевого пузыря; снижается иммунитет. Появляется хрупкость костей, вплоть до спонтанных переломов, боли в мышцах и суставах, связанные с накоплением молочной кислоты. Алкалоз обычно пояляется в результате перенесенных заболеваний. Ацидоз очень часто является метаболическим, ему способствуют вредные привычки человека.



 А
А  В + Н+, где А- кислота, В- основание, сопряженное этой кислоте. По этой теории кислотами и основаниями могут быть не только нейтральные частицы, но и ионы.
В + Н+, где А- кислота, В- основание, сопряженное этой кислоте. По этой теории кислотами и основаниями могут быть не только нейтральные частицы, но и ионы. H+ + Cl-
H+ + Cl- H+ + NH3
H+ + NH3 H+ + CO32-
H+ + CO32- В1 + А2
В1 + А2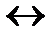 H3O+ + Cl- , где ион H3O+ называется ионом гидроксония.
H3O+ + Cl- , где ион H3O+ называется ионом гидроксония. NH4+ + OH-
NH4+ + OH- H++ OH-
H++ OH- , при 2980К
, при 2980К 10-14моль/л
10-14моль/л *. Внутренние среды организма являются водными растворами. рН этих растворов оказывает влияние на жизнедеятельность клеток и организма в целом, потому что концентрация ионов водорода влияет на диссоциацию всех слабых электролитов в клетках и межклеточной жидкости, а значит и на концентрацию тех или других ионов. Ионы водорода участвуют в процессах окисления-восстановления, катализируют процессы этерификации и гидролиза, от них зависит процесс денатурации белков. Значения рН внутренних сред организма характеризуются значительным постоянством и устойчивостью, и это постоянство является основой гомеостаза. Например: рН слюны 6,35-6,85. Если кислотность слюны повышена – разрушается зубная эмаль, снижается активность пищеварительных ферментов. Для нормального пищеварения в желудке рН желудочного сока должна быть в норме 1,53-1,67. Повышенная кислотность (1,48 и меньше) провоцирует гастрит и язвенную болезнь, пониженная – ухудшает переваривание пищи, способствует процессам гниения в желудке и общей интоксикации организма. Секрет поджелудочной железы имеет слегка щелочную среду рН 7,50-8,00. А в тонком кишечнике она опять падает до 4,00. рН плазмы крови одна из самых жестких констант организма, в норме он составляет 7,36. При сдвиге рН плазмы всего на 0,1 в организме начинают протекать патологические процессы, а при сдвиге рН на 0, 2 может развиться коматозное состояние. Изменение рН крови меняет свойства белков, является причиной потери ими биологической активности. К белкам относятся многие жизненно важные БАВ, например, ферменты и гормоны.
*. Внутренние среды организма являются водными растворами. рН этих растворов оказывает влияние на жизнедеятельность клеток и организма в целом, потому что концентрация ионов водорода влияет на диссоциацию всех слабых электролитов в клетках и межклеточной жидкости, а значит и на концентрацию тех или других ионов. Ионы водорода участвуют в процессах окисления-восстановления, катализируют процессы этерификации и гидролиза, от них зависит процесс денатурации белков. Значения рН внутренних сред организма характеризуются значительным постоянством и устойчивостью, и это постоянство является основой гомеостаза. Например: рН слюны 6,35-6,85. Если кислотность слюны повышена – разрушается зубная эмаль, снижается активность пищеварительных ферментов. Для нормального пищеварения в желудке рН желудочного сока должна быть в норме 1,53-1,67. Повышенная кислотность (1,48 и меньше) провоцирует гастрит и язвенную болезнь, пониженная – ухудшает переваривание пищи, способствует процессам гниения в желудке и общей интоксикации организма. Секрет поджелудочной железы имеет слегка щелочную среду рН 7,50-8,00. А в тонком кишечнике она опять падает до 4,00. рН плазмы крови одна из самых жестких констант организма, в норме он составляет 7,36. При сдвиге рН плазмы всего на 0,1 в организме начинают протекать патологические процессы, а при сдвиге рН на 0, 2 может развиться коматозное состояние. Изменение рН крови меняет свойства белков, является причиной потери ими биологической активности. К белкам относятся многие жизненно важные БАВ, например, ферменты и гормоны.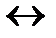 NaOH + HCO 3-
NaOH + HCO 3-  Н2СО3
Н2СО3  Н+ + НСО3-
Н+ + НСО3- 


