

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
1) Рассчитайте массу соли, которую необходимо взять для приготовления этого раствора.
2) Взвесьте на лабораторных весах рассчитанную массу соли.
3) Перенесите с помощью воронки эту соль в мерную колбу нужного объема.
4) Смойте водой остатки соли из стаканчика для взвешивания и полученный раствор вылейте в колбу.
5) Добавьте в колбу воды приблизительно до 1/3 объема и перемешайте до полного растворения.
6) Добавьте в колбу воду до метки. Будьте внимательны, последние порции добавляйте по каплям.
Например: Приготовить 500 мл 0,1 М раствор гидроксида натрия.
1) Рассчитаем массу соли, которую необходимо взять для приготовления этого раствора.
По формуле с = 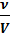
 найдем количество вещества, необходимое для приготовления 500 мл 0,1 М. (Не забудьте перевести мл в л!) ν = 0,1моль/л ∙0,5л = 0,05 моль. По формуле m = ν ∙M найдем массу вещества. М(NaOH)=40 г/моль m = 0,05 моль∙40 г/моль = 2 г
найдем количество вещества, необходимое для приготовления 500 мл 0,1 М. (Не забудьте перевести мл в л!) ν = 0,1моль/л ∙0,5л = 0,05 моль. По формуле m = ν ∙M найдем массу вещества. М(NaOH)=40 г/моль m = 0,05 моль∙40 г/моль = 2 г
2) Взвесим на лабораторных весах 2 г щелочи.
3) С помощью воронки высыпаем взвешенную соль в мерную колбу на 500 мл
4) Смоем водой остатки соли из стаканчика для взвешивания и полученный раствор выльем в колбу.
5) Добавим в колбу воды приблизительно до 1/3 объема и перемешаем до полного растворения.
6) Дольем дистиллированной водой колбу до метки.
Существуют и другие способы выражения содержания вещества в растворе.
Нормальность - число грамм-эквивалентов растворенного вещества в 1 л раствора.Грамм-эквивалент - число граммов химического элемента или соединения, равное массе его эквивалента химического. Грамм-эквивалент химического элемента численно равен частному от деления атомной массы элемента на его валентность: например, Грамм-эквивалент железа (атомная масса 55,847) 2-валентного равен 27,92 г, а 3-валентного 18,62 г. Грамм-эквивалент кислоты — количество её в граммах, содержащее один Грамм-эквивалент водорода, способного замещаться металлом с образованием соли. Т.е. надо молекулярную массу кислоты разделить на число атомов водорода, участвующих в реакции. Грамм-эквивалент основания — количество его в граммах, необходимое для полного взаимодействия с одним Грамм-эквивалент кислоты. Грамм-эквивалент соли — количество её в граммах, содержащее один Грамм-эквивалент металла. Понятие Грамм-эквивалент широко применяется в объёмном анализе (титровании).
|
|
Титр- число г растворенного вещества в 1 мл раствора.
Моляльность – число молей растворенного вещества в 1000 г растворителя.Для воды 1000 г – это 1 литр. Поэтому для водных растворов моляльность - это число молей вещества в 1 литре воды.
Свойства растворов, которые зависят от числа частиц в растворе, т.е. от концентрации, но не зависят от природы вещества, называются коллигативными. Это диффузия, осмотическое давление, упругость пара над растворителем, температура кипения и замерзания.
 Диффузия – это самопроизвольный процесс выравнивания концентрации растворенного вещества в результате хаотического теплового движения частиц раствора.
Диффузия – это самопроизвольный процесс выравнивания концентрации растворенного вещества в результате хаотического теплового движения частиц раствора.
Если к концентрированному раствору соли добавить воду, то молекулы соли будут проникать в воду, а молекулы воды в раствор соли, пока концентрация соли и воды по всему объему не станет одинаковой. Это и есть диффузия. Скорость диффузии будет зависеть от градиента концентрации (градиентом называют изменение концентрации  на единицу длины
на единицу длины  в направлении диффузии, т.е. разница концентраций в двух точках). Чем больше разница концентраций, тем больше скорость диффузии.
в направлении диффузии, т.е. разница концентраций в двух точках). Чем больше разница концентраций, тем больше скорость диффузии.
Перемещение веществ в клетку и из нее осуществляется разными способами. Один из них – диффузия.
Но проникновение ионов через мембрану клетки зависит не только от концентрационного, но и от электрического градиента мембраны. В связи с этим перенос ионов может осуществляться в направлении, противоположном концентрационному градиенту, при наличии противоположного направленного электрического градиента. Многие клеточные мембраны обладают свойством полупроницаемости, т.е. могут пропускать одни частицы и задерживать другие. Таким свойством обладают не только растительные и животные мембраны, но и искусственные (коллодий, целлофан и т.д.)
|
|

Осмос – явление самопроизвольного перехода растворителя в раствор, отделенный от него полупроницаемой мембраной (целлофан, коллодий). Можно сказать, что осмос - это односторонняя диффузия, т.е. одни молекулы (растворителя) могут свободно передвигаться по всему объему раствора, а другие могут находиться только с одной стороны мембраны. Частицы растворителя двигаются из области, где их больше (из чистого растворителя), туда, где их меньше (в раствор). Т.е. это обычная диффузия, но не растворенного вещества, а растворителя.
Сила, заставляющая растворитель переходить через полупроницаемую перегородку в раствор, имеет ту же природу, что и сила, заставляющая газ из сосуда, где он находился при большем давлении, переходить в сосуд с меньшим давлением. Вот почему для жидких растворов эту силу называют осмотическим давлением. Осмос не является свойством ни растворителя, ни растворенного вещества; это явление, которое возникает в системе, состоящей из 2-х растворов с различными концентрациями, разделенных полупроницаемой мембраной. Чем больше разница концентраций в растворах, тем выше осмотическое давление.
Величину осмотического давления определяют по закону Вант-Гоффа P=CRT, где P- осмотическое давление, C – молярная концентрация, R – 8,13 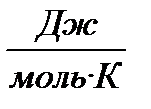 , T – температура Кельвина.
, T – температура Кельвина.
Осмотическое давление в растворах электролитов может быть очень большим, например:
-морская вода (≈ 3,5% раствор солей) - 28 атм.
- вода озера Сиваш - 200 атм.
- 6% р-р сахара – 0,6 атм.
- плазма крови человека 7,7 атм
Т.е. осмотическое давление крови у человека достаточно велико. Такое большое значение давления обусловлено наличием в крови большого числа ионов и молекул. Часть осмотического давления крови, которая обусловленна белками, называется онкотическим давлением. Оно составляет всего 0,5% от общего осмотического давления крови. Но изменение онкотического давления очень важный параметр гомеостаза, потому что его изменение говорит об изменении концентрации белков в крови.
|
|
Изотоническими называют растворы, которые имеют одинаковое осмотическое давление, в этих растворах одинаковая молярная концентрация частиц. Гипотоническим называют раствор, в котором осмотическое давление более низкое, а гипертоническим – более высокое чем в растворе сравнения. Если полупроницаемая мембрана разделяет изотонические растворы, то осмотическое давление отсутствует; если разное давление, то растворитель начинает проходить через мембрану из раствора с низким осмотическим давлением в раствор с более высоким давлением; если разность давлений велика, то возможно повреждение мембраны. При погружении клетки в гипертонический раствор наблюдается плазмолиз, клетка сжимается, уменьшается в объеме. В гипотонических растворах объем клетки увеличивается, и она может лопнуть.
Процесс осмоса в живых организмах сильно зависит от природы мембран. В одних случаях она проницаема только для молекул растворителя (воды), в других – через нее могут проходить молекулы определенных веществ, либо растворяющихся в ее липидах, либо взаимодействующих с ее компонентами. Причем проницаемость мембраны может регулироваться. Например, проницаемость почечной мембраны зависит от концентрации антидиуретического гормона (АДГ).
В норме внутри клетки всегда ионов больше, чем снаружи. Этим объясняется повышенное осмотическое давление клетки по сравнению с внеклеточной жидкостью. Это способствует поддержанию тургора клетки. При патологии, например, при понижении содержания белков в крови (голодание, болезнь почек…), уменьшается онкотическое давление, нарушается соответствие между давлениями внутри клетки и вне ее, вода переходит в клетки тканей, вызывая отеки.
В медицине применяются различные по составу физиологические растворы, изотоничные плазме крови. Их вводят при обезвоживании или потери крови. Ими обрабатывают раны. Гипертонические растворы используют при отеках и внутренних кровотечениях, а так же для лечения гнойных ран.
|
|
Над поверхностью жидкости в результате процесса испарения (диффузия) всегда есть какое –то количество молекул этой жидкости. Давление пара жидкости над раствором зависит от температуры и природы жидкости. Кипение жидкости начинается тогда, когда давление паров вещества над жидким веществом станет равно внешнему давлению. Изучая давление пара растворителя над разбавленными растворами нелетучих веществ, Рауль обнаружил, что оно пропорционально молярной доле растворителя. Т.е. давление пара над раствором меньше, чем над чистым растворителем. Это происходит потому, что часть поверхности жидкости в растворе занята молекулами нелетучего растворенного соединения, и процесс испарения жидкости затруднен.Снижение давления пара приводит к необходимости нагревать раствор до более высокой температуры, чтобы достигнуть давления, при которой закипает чистая жидкость. Т.е. растворы нелетучих веществ кипят при более высоких температурах, чем чистые растворители. Причем,  , где Е – эбуллиоскопическая константа, а m- моляльная концентрация, которую выражают
, где Е – эбуллиоскопическая константа, а m- моляльная концентрация, которую выражают 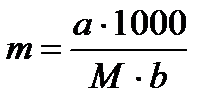 , где а –масса растворенного вещества, М – его молекулярная масса, b – масса растворителя.
, где а –масса растворенного вещества, М – его молекулярная масса, b – масса растворителя.
Аналогично, растворы нелетучих веществ замерзает при более низких температурах, чем чистые растворители. Причем, 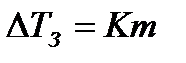 , где К- криоскопическая константа. Эта зависимость называется законом Рауля
, где К- криоскопическая константа. Эта зависимость называется законом Рауля
Криоскопия – метод исследования, который позволяет определять концентрацию раствора или молекулярную массу вещества по изменению температуры замерзания. Эбуллиоскопия - по изменению температуры кипения. Первый способ более употребителен, потому что температуру замерзания раствора легче измерить и при низких температурах не происходит изменений в структуре растворенных веществ и растворителя. В биологических и медицинских исследованиях понижение температуры замерзания растворов часто называют депрессией растворов. Измерение депрессии биологических жидкостей позволяет рассчитывать «осмотическую концентрацию», т.е. суммарную концентрацию всех частиц в растворе.
6. Но есть вещества, свойства растворов которых сильно отклоняются от изученных нами закономерностей. К таким веществам относятся соли, кислоты и щелочи. Для них осмотическое давление, изменение температуры кипения раствора и т.д. всегда больше, чем это следует из концентрации раствора. В 1887 году Аррениус высказал предположение, что в растворах молекулы этих веществ распадаются на более мелкие частицы, и число частиц в растворе возрастает. Этот процесс он назвал диссоциацией. К числу самых непримиримых противников Аррениуса принадлежал Д. И. Менделеев, сформировавший "химическую" теорию растворов - в отличие от "физической" теории Аррениуса. Менделеев считал, что в растворах происходят, по сути, химические взаимодействия между растворённым веществом и растворителем. Спор между сторонниками и противниками Аррениуса длился не один год. И, как это часто бывает в науке, в ожесточённом споре между приверженцами физической и химической теории правы оказались обе стороны. Очень сильное химическое взаимодействие между веществом и молекулами растворителя даёт ту энергию, которая нужна для разрушения кристаллической решётки веществ-электролитов, например, поваренной соли. В случае водных растворов эта энергия называется энергией гидратации, и эта энергия может иметь колоссальные значения. Так, энергия гидратации ионов Cl- равна 352 кДж/моль, ионов Na+ - 423 кДж/моль, ионов Н+ - 1109 кДж/моль, ионов Ca2+ - 1615 кДж/моль. Для сравнения: чтобы разорвать связь между атомами в молекуле хлора, требуется всего 242 кДж/моль. Чтобы разъединить катионы и анионы в кристаллах электролитов, тоже требуется затратить немало энергии (она называется энергией кристаллической решётки) - 788 кДж/моль для NaCl, 1044 кДж/моль для LiF, 2240 кДж/моль для CaCl2 и т. д. Если суммарная энергия гидратации катионов и анионов при образовании раствора больше энергии кристаллической решётки, то растворение будет сопровождаться нагреванием, а если меньше - охлаждением раствора. Именно поэтому при растворении в воде таких веществ, как LiCl, безводный CaCl2, и некоторых других раствор нагревается, а при растворении NH4NO3, KNO3, KCl, и некоторых других - охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, снаружи покрывается росой или даже примерзает к мокрому столу. Большая часть электролитов - соли, т. е. кристаллические вещества. В узлах этих кристаллических решеток располагаются положительные и отрицательные ионы (значит, молекула уже диссоциирована), и эти ионы совершают колебательные движения около положения равновесия. Примером такого соединения является хлорид натрия NaCl. Процесс растворения начинается при соприкосновении молекул воды с поверхностью кристалла, т. е. на границе раздела твердого тела (NaCl) и жидкости (H2O). Молекулы H2O приближаются к ионам Na+ и Cl-, расположенным в узлах поверхностного слоя кристаллической решетки, при этом они ориентируются атомом кислорода к иону натрия, а одним из атомов водорода к ионам хлора, происходит взаимодействие ионов Na+ и Cl- с молекулами воды, ионы отрываются от кристалла (решетка разрушается), переходят в жидкость (в воду); с этого момента жидкость состоит уже не только из молекул H2O, но и ионов Na+ и Cl- - так образуется водный раствор хлорида натрия. Процесс растворения закончится, когда молекулы воды полностью разрушат решетку кристалла. Когда ион отрывается от поверхности кристалла, его немедленно окружают молекулы воды, ион гидратируется, причем молекулы воды, которые ближе всех к иону, ведут себя иначе, чем те, что находятся в отдалении. Ведь ионы обладают электрическим зарядом, и молекулы воды, попадая в электрическое поле заряженного иона, испытывают воздействие с его стороны. Для разных ионов число таких молекул воды будет разным, оно зависит от размера иона и его заряда. Эти молекулы воды образуют гидратную оболочку иона в растворе.
|
|
Вещества с полярной связью тоже подвергаются диссоциации, но сначала молекулы воды поляризуют ковалентную связь, а уже потом молекула распадается на ионы. Т.к. этот процесс более сложен, у веществ с полярной связью не все молекулы распадаются на ионы.
7. Степень распада электролита на ионы называется степенью электролитической диссоциации  , где n – число распавшихся на ионы частиц, а N – общее число частиц, введенных в раствор. Если числитель равен знаменателю – степень диссоциации равна 1. Такой электролит называется сильным,он хорошо проводит ток, потому что в растворе много ионов. Если на ионы распалась только небольшая часть частиц, степень диссоциации будет много меньше 1,
, где n – число распавшихся на ионы частиц, а N – общее число частиц, введенных в раствор. Если числитель равен знаменателю – степень диссоциации равна 1. Такой электролит называется сильным,он хорошо проводит ток, потому что в растворе много ионов. Если на ионы распалась только небольшая часть частиц, степень диссоциации будет много меньше 1,  электролит будет называться слабыми его раствор будет плохо проводить электрический ток, т.к. концентрация ионов в растворе мала. К сильным электролитам относятся растворимые соли и основания (ионная связь) и некоторые кислоты (соляная, азотная, серная и др.). К слабым электролитам относится большинство органических кислот и оснований и некоторые неорганические кислоты (угольная, фосфорная, сероводородная, цианистая и др. кислоты), а также раствор аммиака). Т.е. степень диссоциации зависит, прежде всего, от природы вещества, а для слабых электролитов она зависит очень сильно и от концентрации.
электролит будет называться слабыми его раствор будет плохо проводить электрический ток, т.к. концентрация ионов в растворе мала. К сильным электролитам относятся растворимые соли и основания (ионная связь) и некоторые кислоты (соляная, азотная, серная и др.). К слабым электролитам относится большинство органических кислот и оснований и некоторые неорганические кислоты (угольная, фосфорная, сероводородная, цианистая и др. кислоты), а также раствор аммиака). Т.е. степень диссоциации зависит, прежде всего, от природы вещества, а для слабых электролитов она зависит очень сильно и от концентрации.
Если обозначить концентрацию электролита через С, а степень диссоциации через  , то концентрация каждого из ионов будет С·
, то концентрация каждого из ионов будет С·  , а концентрация нераспавшихся молекул будет С· (1-
, а концентрация нераспавшихся молекул будет С· (1-  ). И уравнение для константы диссоциации примет вид:
). И уравнение для константы диссоциации примет вид:  , это уравнение выражает закон разбавления Оствальда и дает возможность вычислять степень диссоциации при различных концентрациях, если известна степень диссоциации электролита. Для растворов очень слабых электролитов
, это уравнение выражает закон разбавления Оствальда и дает возможность вычислять степень диссоциации при различных концентрациях, если известна степень диссоциации электролита. Для растворов очень слабых электролитов  <<1, поэтому, пренебрегая этой величиной в знаменателе, мы получим
<<1, поэтому, пренебрегая этой величиной в знаменателе, мы получим  ·C
·C
И это уравнение наглядно показывает, что степень диссоциации возрастает при разбавлении растворов, т.е. чем меньше концентрация слабого электролита, тем больше степень диссоциации. Сильные электролиты в разбавленных водных растворах обычно полностью диссоциированы, образовавшиеся ионы будут двигаются независимо друг от друга. Но если это концентрированные растворы, то расстояние между ионами небольшое, а значит и взаимодействие велико. Например, в насыщенном растворе хлорида натрия расстояние между ионами всего в 2 раза больше, чем в кристаллической решетке. Перемещение ионов в концентрированных растворах происходит очень трудно: при своем движении они встречают большое сопротивление со стороны ионов с зарядом противоположного знака. При столкновениях часть ионов соединяется в молекулы, которые через некоторое время опять распадаются. Таким образом, число ионов, способных переносить электричество, всегда меньше общего числа ионов присутствующих в растворе при данной концентрации электролита. Благодаря взаимодействию между ионами, они не могут совершенно свободно двигаться, и свойства сильного электролита, зависящие от концентрации, проявляются так, словно степень диссоциации меньше 1. Для оценки состояния сильного электролита в растворе пользуются величиной называемой активностью или эффективной концентрацией: а = f· c где f – коэффициент активности. Чем более разбавлен раствор, тем ближе значение f к 1.
Активную роль в процессе диссоциации играет вода. Что определяет свойства воды как растворителя электролитов? Прежде всего, это полярный характер молекул воды. Кроме того, у воды большая диэлектрическая постоянная ε. ε - это характерная для данной среды величина, которая показывает, во сколько раз сила взаимодействия двух единичных зарядов на расстоянии, равном единице, в данной среде меньше такой же силы в вакууме.
Процесс диссоциации записывается с помощь уравнений. Здесь незаменимая шпаргалка – таблица растворимости. Например:
1) Al2(SO4)3 ó Al3+ + 3SO42-
2) MgCl2 ó Mg2+ + 2Cl-
3) Na3PO4 ó Na+ + PO43-
4) HCl ó H+ + Cl-
5) H2SO4 ó 2H+ + SO42-
6) NaOH ó Na+ + OH-
7) Ba(OH)2 ó Ba2+ + 2OH-
На какие ионы диссоциируют в растворах кислоты? Щелочи? Соли?
Как всякое химическое равновесие, равновесие в растворе электролита является динамическим и зависит от природы вещества и температуры. Для многоосновных кислот и оснований многовалентных металлов диссоциация происходит ступенчато. В растворах таких веществ устанавливаются несколько равновесий, в которых участвуют ионы с различными зарядами. Например:
H2CO3 = H+ + HCO3-
HCO3- = H+ + CO32-
К равновесию, которое устанавливается в растворах электролитов, можно применить законы химического равновесия. Константа, которая отвечает этому процессу, называется константой диссоциации. Выражение для константы диссоциации всегда можно записать по закону действующих масс. Например, для угольной кислоты первое равновесие характеризуется К1, а второе – К2. Причем всегда К1> К2.
Итак: Электролиты – это вещества, растворы которых проводят электрический ток. К ним относятся кислоты, основания и соли. Электролитическая диссоциация – процесс распада электролита на ионы. Ионы – заряженные частицы, на которые распадаются электролиты. Степень диссоциации – отношение числа распавшихся частиц к общему числу частиц, введенных в раствор. Слабые электролиты – это электролиты, которые распадаются в незначительной степени. Сильные – распадаются практически полностью. Степень диссоциации зависит от природы вещества и концентрации электролита. Константа диссоциации зависит только от природы электролита и характеризует равновесие, которое устанавливается в растворе электролита.
8*. Знание свойств сильных и слабых электролитов, умение определять концентрацию ионов в растворах необходимы медику и фармацевту. Жидкие среды организма содержат большое количество различных ионов: водорода, натрия, калия, хлора, кальция и т.д. От концентрации ионов зависит величина осмотического давления плазмы крови и др. биологических жидкостей. Природа возникающих в организме биопотенциалов имеет ионный характер. Клеточных мембраны имеют избирательную проницаемость, она определяется природой и состоянием ионов в растворах. От концентрации ионов зависит величина электродных потенциалов ионов; эти потенциалы определяют возможность и направление окислительно-восстановительных процессов в клетках. Особой биологической активностью обладают ионы водорода и гидроксид-ионы, которые определяют кислотность внутренних сред организма, влияют на активность ферментов и других БАВ. Постоянство концентраций различных ионов в биологических средах принято называть водно-солевым балансом. Нарушение водно-солевого баланса свидетельствует о различных патологиях. В нормальном состоянии водно-солевой баланс поддерживается на одном уровне в результате деятельности различных систем организма.
9. С точки зрения ТЭД свойства солей, кислот и оснований можно и нужно рассматривать как свойства ионов, которые находятся в их растворах. Т.е. во всех растворах кислот есть один общий ион – ион водорода. Все общие свойства кислот – это свойства именно этого иона. В растворах щелочей всегда есть гидроксид-ион. Значит все общие свойства щелочей - это свойства гидроксид-ионов. У солей нет общих ионов, и свойств общих у них нет. Для всех электролитов есть фактически одно общее химическое свойство, один тип реакций, в которые они все вступают, это реакции ионного обмена. Процесс обмена ионами между электролитами в принципе всегда обратим.
Kt*An* + Kt**An** ↔ Kt*An** + Kt**An*
Но если в результате обмена ионы связываются, а вновь не распадаются (потому что образовался слабый электролит, т.е. газ, вода, слабая кислота или щелочь, малорастворимое соединение), то реакция становится практически необратимой. Суть происходящего процесса показывают ионные уравнения:
1) Сa(NO3)2 + K2CO3 =>CaCO3â + 2KNO3
Ca2+ + 2NO3- + 2K+ + CO32- => CaCO3â +2K+ + 2NO32-
Ca2+ + CO32- => CaCO3â
2) K2CO3 + 2HNO3 = 2KNO3 + H2O + CO2á
2K+ + CO32- + 2H+ + 2NO3- = 2KNO3 + H2O + CO2á
2H+ + CO32- = H2O + CO2á
3) Cu(OH)2â + 2HCl = CuCl2 + 2H2O
Cu(OH)2â + 2H+ +2Cl- = Cu2+ + 2Cl- + 2H2O
Cu(OH)2â + 2H+ = Cu2+ + 2 H 2 O
Реакции ионного обмена широко используются для получения различных солей, кислот, оснований и для их анализа. Умение записывать общие и сокращенные ионные уравнения для реакций между электролитами - обязательное требование школьной программы.
|
|
|

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!