Атом – мельчайшая частица химического элемента, не имеющая заряда. Атом состоит из положительно заряженного ядра и электронной оболочки. В ядре атома содержатся протоны и нейтроны. Протон (p) – элементарная частица с массой приблизительно равной 1 а.е.м. и имеющая положительный заряд, равный заряду электрона по абсолютной величине. Нейтрон (n) – элементарная частица, не обладающая зарядом и имеющая массу, близкую к массе протона. Сумма протонов и нейтронов называется массовым числом атома. Число протонов определяет заряд ядра атома и его принадлежность к определенному химическому элементу. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Атомы одного элемента, отличающиеся числом нейтронов, называются изотопами. Обычно химический элемент представляет собой набор большего или меньшего числа изотопов Заряд ядра является важнейшей характеристикой атома и определяет его химические свойства. В химических реакциях ядро атома не изменяется, а меняется строение электронной оболочки.
Электронная оболочка атома состоит из электронов. Электрон (ē) – частица, обладающая единичным отрицательным зарядом и имеющая массу в 1837 раз меньше, чем масса протона. Условием электронейтральности атома является равное число протонов и электронов.
Было установлено, что заряд ядра атома, т.е. число протонов, равен порядковому номеру элемента в Периодической системе, значит порядковый номер совпадает и с числом электронов в атоме. А число нейтронов находится как разность между массовым числом и числом протонов.
Например: сколько протонов, нейтронов и электронов содержится в атоме брома (Br) с массовым числом 80? Порядковый номер брома – 35, значит в атоме брома будет 35 протонов и 35 электронов, а чтобы найти число нейтронов, нужно из массового числа вычесть число протонов, т.е. количество нейтронов равно 80 – 35 = 45.
Электрон обладает свойствами частицы и волны, ему присуще корпускулярно-волновая двойственность. Движение электрона в атоме носит вероятностный характер и может быть описано волновым уравнением. Та часть атомного пространства, в котором наиболее вероятно нахождение электрона, называется атомной орбиталью (АО) или электронным облаком. Атомная орбиталь характеризуется тремя квантовыми числами (n, l, m). Они определяют энергию и размер (n), форму (l) и ориентацию (m) АО в пространстве; n – главное квантовое число характеризует энергию электрона и его удаленность от ядра. Оно может принимать значения 1, 2, 3, 4, 5, 6, 7. Все электроны с одинаковым значением «n» образуют электронный слой. Электронная оболочка атома имеет слоистое строение. «l» — орбитальное квантовое число, определяет форму электронной орбитали; принимает целочисленные значения от 0 до (n-1). Орбиталь, для которой l=0 называют s-орбиталью, она имеет шарообразную форму; орбиталь, у которой l=1 называют p-орбиталью, она имеет форму объемной восьмерки; если l=2, орбиталь называют d-орбиталью и она имеет форму сдвоенной восьмерки (четырехлепестковая фигура). Ориентация орбитали в пространстве определяется магнитным квантовым числом (m). Это квантовое число изменяется в диапазоне от «-l» до «+l», принимая все целочисленные значения, включая 0. Число значений магнитного квантового числа равно числу орбиталей данного типа. Первый электронный слой (ближайший к ядру) состоит из одной s-орбитали, это записывается «1s». Второй электронный слой состоит из одной s-орбитали и трех p-орбиталей (2s2p), т.к. если n=2, то «l» может принимать значения 0 и 1, что соответствует «s» и «p» орбиталям. «s» орбиталь в любом слое может быть только одна, p-орбитали появляются во втором и последующих электронных слоях и их будет три, по числу возможных значений магнитного квантового числа. В третьем электронном слое имеются одна s-орбиталь, три p-орбитали и пять d-орбиталей (3s3p3d).
Для характеристики электрона используют еще одно квантовое число – спиновое, учитывающее не только перемещение электрона относительно ядра, но и вращение вокруг собственной оси. Направлений вращения может быть два, поэтому спиновое квантовое число принимает значения +1/2 и -1/2.
При описании электронной структуры многоэлектронных атомов важно знать закономерности заполнения электронами электронных слоев атома. В невозбужденном состоянии электроны заполняют прежде всего самые низкие по энергии орбитали, т.е. тот энергетический уровень, на котором они обладают наименьшей энергией – меньшая сумма n+l (правило Клечковского). В.Паули сформулировал положение, получившее название «принцип Паули». «В атоме не может быть двух электронов, обладающих одинаковым набором всех четырех квантовых чисел». Из этого следует, что на любой АО с заданными значениями n,l,m может находиться не более двух электронов, причем их спиновые квантовые числа должны быть противоположны. Исходя из принципа Паули, легко рассчитать, сколько электронов будет содержаться на том или ином подуровне: на s-орбитали может максимально находиться 2 электрона, на трех p-орбиталях 6 электронов, на пяти d-орбиталях 10 электронов. Последовательность заполнения орбиталей электронами определяет электронную конфигурацию атома. Число энергетических слоев (уровней) соответствует номеру периода, в котором находится данный элемент. Наиболее устойчивой конфигурацией на одном и том же подуровне является та, которая содержит наибольшее число неспаренных электронов (правило Гунда). Последовательность заполнения АО следующая:
1sg2sg2pg3sg3pg4sg3dg4pg5sg4dg5pg6sg5d1g4fg5dg6pg7s
Электронную конфигурацию атома принято записывать символами nlx, где n-главное квантовое число, l-побочное квантовое число (в буквенном обозначении), x-число электронов на данной орбитали.
Пример: напишите электронную конфигурацию элемента с порядковым номером 15
Число электронов в атоме элемента равно его порядковому номеру в Периодической таблице. Под номером 15 в Периодической таблице находится фосфор. Его электронная структура имеет вид:
15P 1s22s22p63s23p3. Эта запись говорит о том, у атома фосфора три электронных слоя (на это указывает максимальное значение главного квантового числа), фосфор находится в третьем периоде, самый удаленный (третий) электронный слой называется внешним или валентным. На нем находится 5 электронов: два на s-орбитали и три на p-орбитали. Последний электрон занял p-орбиталь, значит фосфор относится к p-семейству (является p-элементом). S- и p-элементы входят в состав главных подгрупп. Для s- и p-элементов число электронов на внешнем электронном слое равно номеру группы, следовательно фосфор находится в 5-ой группе. Таким образом, зная электронное строение атома можно определить его положение в Периодической таблице (период, группу, подгруппу) и предсказать его свойства.
Из принципа Паули следует, что число электронов в электронном слое ограничено. Это приводит к тому, что строение внешнего электронного слоя периодически повторяется. Атомы со сходными электронными структурами обладают сходными химическими свойствами. В этом смысл явления периодичности.
Химическая связь – это взаимодействие нескольких атомов, приводящее к образованию устойчивой многоатомной системы (молекулы). Существенной особенностью такого взаимодействия является то, что оно приводит к перестройке электронных оболочек связывающихся атомов. Важнейшей причиной образования молекул является понижение полной энергии системы при переходе от свободных атомов к молекуле. Различают три основных типа химической связи: ковалентную, ионную и металлическую.
Ковалентная связь – это связь между атомами, осуществляемая за счет образования общих электронных пар. Общая электронная пара образуется из неспаренных электронов взаимодействующих атомов. Одиночная валентная связь представляет собой двухэлектронное взаимодействие. Различают две разновидности ковалентной связи: полярную и неполярную. Связь, осуществляемая парой (парами) общих электронов, в равной мере принадлежащих обоим соединяющимся атомам, называется неполярной ковалентной связью Таким образом соединяются одинаковые или близкие по значениям электроотрицательности атомы (молекулы H2, N2 и др.) Если электроотрицательность атомов, образующих молекулу, неодинакова, то связующая пара электронов смещается в сторону атома с большей электроотрицательностью. (Под электроотрицательностью понимают способность атома данного элемента смещать к себе общую электронную пару в молекуле. Чем больше электроотрицательность атома, тем сильнее он притягивает общую электронную пару.) Полярная ковалентная связь характерна для молекул H2O, H2S, PCl3 и др. В некоторых молекулах с ковалентной связью соединяющиеся атомы поставляют на образование связей неодинаковое число электронов. Такое несоответствие наблюдается, когда один из взаимодействующих атомов имеет неподеленную электронную пару, а другой – свободную орбиталь.
H3N: + H+ g [NH4]+
Неподеленная электронная пара принадлежит атому азота и он называется донором, а ион Н+, имеющий свободную орбиталь, на которой располагается эта электронная пара, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным. Связи N—H, образованные по различным механизмам, равноценны по своим характеристикам.
Различие в электроотрицательности атомов приводит к образованию полярной связи вследствие смещения электронной плотности к атому с большей электроотрицательностью. Если же различие между атомами очень велико, то можно говорить о полном переходе электрона к более электроотрицательному атому. Такая связь называется ионной. Так образуется молекула KCl. Взаимодействие атомов калия и хлора сопровождается переносом электрона от калия к хлору. Теряя электрон, атом калия превращается в ион калия, положительно заряженный, а атом хлора, приобретая электрон, становится отрицательно заряженным ионом.
Ko – ē g K+
Clo + ē g Cl-
Вследствие этого процесса образуются противоположно заряженные ионы которые взаимодействуют за счет электростатических сил. Надо заметить, что полного перехода электронов от одного атома к другому не происходит. Поэтому ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Ионная связь образуется между атомами металлов и неметаллов, т.к. металлы имеют низкую энергию ионизации, а неметаллы высокое сродство к электрону. А ковалентные соединения состоят, как правило, из атомов неметаллов (одинаковых или различных).
Контрольные вопросы
- Напишите электронные формулы элементов с порядковыми номерами 7 и 25. К какому электронному семейству относится каждый из этих элементов? Напишите формулы оксидов этих элементов, в которых они имеют высшие степени окисления. К какой группе оксидов они относятся?
- Напишите электронные формулы элементов с порядковыми номерами 13 и 20. К какому электронному семейству относится каждый из этих элементов? Напишите формулы гидроксидов этих элементов. Приведите реакции, характеризующие свойства этих гидроксидов.
- Напишите электронные формулы элементов с порядковыми номерами 12 и 24. К какому электронному семейству относится каждый из этих элементов? Напишите формулы оксидов этих элементов. Какая связь в первом из них?
- Напишите электронные формулы элементов с порядковыми номерами 15 и 26. К какому электронному семейству относится каждый из этих элементов? Напишите формулы оксидов этих элементов. К какой группе оксидов они относятся? Какими свойствами обладают? Приведите реакции.
- Напишите электронные формулы элементов с порядковыми номерами 16 и 37. К какому электронному семейству относится каждый из этих элементов? Напишите формулы оксидов и гидроксидов этих элементов.
- Напишите электронные формулы элементов с порядковыми номерами 17 и 30. К какому электронному семейству относится каждый из этих элементов? Чему равна валентность атома элемента №17 в основном и возбужденном состоянии?
- Напишите электронные формулы элементов с порядковыми номерами 6 и 33. К какому электронному семейству относится каждый из этих элементов? Напишите формулы гидридов этих элементов. Какая связь в них? Приведите схемы образования молекул.
- Напишите электронные формулы элементов с порядковыми номерами 15 и 29. К какому электронному семейству относится каждый из этих элементов? Приведите формулы гидроксидов этих элементов. Напишите реакцию их взаимодействия с образованием средней и кислой солей.
- Напишите электронные формулы элементов с порядковыми номерами 37 и 47. К какому электронному семейству относится каждый из этих элементов? У какого из них сильнее выражены металлические свойства? Дайте объяснения.
- Напишите электронные формулы элементов с порядковыми номерами 11 и 35. К какому электронному семейству относится каждый из этих элементов? Приведите формулы водородных соединений этих элементов. Какая связь в каждой из них? Приведите схемы образования этих молекул.
- Напишите электронные формулы элементов с порядковыми номерами 5 и 30. К какому электронному семейству относится каждый из этих элементов? Напишите формулы гидроксидов этих элементов. Какой из них обладает амфотерными свойствами? Приведите реакции, подтверждающие амфотерность.
- Напишите электронные формулы элементов с порядковыми номерами 23 и 50. К какому электронному семейству относится каждый из этих элементов? Напишите формулу трихлорида фосфора и приведите схему его образования. Какая связь в этой молекуле?
- Напишите электронные формулы элементов с порядковыми номерами 9 и 34. К какому электронному семейству относится каждый из этих элементов? Приведите формулы водородных соединений этих элементов. В какой из молекул связь более полярная? Почему?
- Напишите электронные формулы элементов с порядковыми номерами 14 и 53. К какому электронному семейству относится каждый из этих элементов? Какая связь называется донорно-акцепторной? Приведите схему образования частицы BF4- ? Какая частица является донором, какая акцептором?
- Напишите электронные формулы элементов с порядковыми номерами 8 и 27. К какому электронному семейству относится каждый из этих элементов? Приведите схемы образования молекул N2 и NH3. Какая связь в каждой из них?
- Напишите электронные формулы элементов с порядковыми номерами 38 и 53. К какому электронному семейству относится каждый из этих элементов? Приведите пример двух ионных соединений. Покажите механизм образования этих молекул.
- Напишите электронные формулы элементов с порядковыми номерами 11 и 22. К какому электронному семейству относится каждый из этих элементов? Что такое водородная связь? Почему вода имеет более высокую температуру кипения, чем ее аналоги с большей молекулярной массой?
- Напишите электронные формулы элементов с порядковыми номерами 8 и 23. К какому электронному семейству относится каждый из этих элементов? Почему молекула Cl2– неполярна, а молекула ICl –полярна?
- Напишите электронные формулы элементов с порядковыми номерами 19 и 33. К какому электронному семейству относится каждый из этих элементов? Напишите формулы хлоридов этих элементов. Какая связь в этих молекулах? Приведите схему их образования.
- Напишите электронные формулы элементов с порядковыми номерами 13 и 25. К какому электронному семейству относится каждый из этих элементов? Какой характер имеют связи в молекулах NCl3, PCl3, H2S,CS2? К какому из атомов смещены электронные пары в каждой из молекул?
Тема 4. Химическая кинетика
Кинетика химических реакций – это учение о скорости химических процессов.
Скоростью химической реакции называют изменение концентрации какого-либо из реагирующих веществ в единицу времени.
Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса, а именно: концентрации реагирующих веществ, температуры, наличия катализаторов и др.
Зависимость скорости реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции
2NO + O2 → 2NO2 закон действия масс может быть записан
v = k [NO]2[O2],
где v – скорость химической реакции,
k – константа скорости,
[NO], [O2] – концентрации реагирующих веществ.
Реакция в гетерогенной системе, где реагирующие вещества находятся в разных фазах, осуществляется на поверхности раздела между фазами. Поэтому скорость гетерогенной реакции при постоянной температуре зависит от площади поверхности раздела, а не от концентрации твердого вещества. В этом случае для реакции
С (тв) + О2 → СО2 (г)
Закон действия масс может быть записан
v = k [O2]
Пример 1. Как изменится скорость реакции N2+3H2 →2NH3 при увеличении давления в системе в 2 раза?
Так как исходные вещества газообразные, то изменение давления и объема влияют на концентрации этих веществ: увеличение давления пропорционально концентрации этих веществ, а увеличение объема, наоборот, уменьшает концентрацию этих веществ.
Запишем выражение закона действия масс для данной реакции:
v1= k [N2][H2]3,
При увеличении давления в два раза концентрация обоих реагирующих веществ также увеличится в два раза. Тогда
v2 = k [2N2][2H2]3
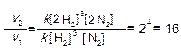
Следовательно, скорость реакции увеличится в 16 раз.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
vt2 = vt1∙ γ( t2- t1)/10, где
vt2 и vt1 скорости реакций при t1 и t2;
γ – температурный коэффициент, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на 10°, может принимать значения от 2 до 4.
Причиной роста скорости реакции от температуры является увеличение доли молекул, имеющих энергию активации, т. е. долю активных молекул. Энергия активации это та энергия, которая необходима чтобы произошла химическая реакция, она всегда больше чем средняя энергия молекул данной системы.
Пример 2. Как изменится скорость реакции при повышении температуры реакции с 25° до 75°, если температурный коэффициент равен 2?
vt2/ vt1 = γ( t2- t1)/10 = 2(75-25)/10 = 25 = 32
Скорость реакции возрастет в 32 раза.
Скорость химической реакции возрастает в присутствии катализатора, который снижает энергию активации, благодаря образованию нестабильных промежуточных соединений.
Контрольные вопросы
- Как следует изменить температуру, чтобы скорость реакции возрасла в 100 раз, если температурный коэффициент равен 2?
- Как изменится скорость реакции 2NO + O2 = 2NO2 при уменьшении давления в 3 раза?
- Как изменится скорость реакции при изменении температуры с 70° до 30° С если
γ = 3? - Как следует изменить давление, чтобы увеличить скорость реакции
С2Н4 + Н2 = С2Н6 в 30 раз?
- Как изменится скорость реакции С2Н4 + НBr = C2H5Br при уменьшении объема в 5 раз?
- Во сколько раз увеличится скорость прямой реакции 2SO2 + O2 = 2SO3, если концентрацию оксида серы (IV) увеличить в три раза?
- Как изменится скорость горения этилена, если концентрацию кислорода увеличить в три раза?
- Определите изменение скорости реакции С4Н6 + 2Н2 = С4Н10 при уменьшении давления в системе в три раза?
- Как изменится скорость горения метана при уменьшении концентрации кислорода в два раза?
- Скорость реакции при 0° С равна 1 моль/л ∙с. Вычислите скорость этой реакции при 30°С, если температурный коэффициент равен 3.
- Определите изменение скорости гетерогенной реакции 2C(тв) + 3H2 (г) = C2H6 (г) при увеличении концентрации водорода в 4 раза.
- Во сколько раз изменится (увеличится или уменьшится) скорость прямой реакции 4NH3 + 3O2 = 2N2 + 6H2O при уменьшении давления в два раза.
- Реакция идет по уравнению 2NO + O2 = 2NO2. Концентрация исходных веществ соответственно равна 0,02 моль/л и 0,03 моль/л. Как изменится скорость реакции при увеличении концентрации обоих исходных веществ до 0,04 моль/л?
- Напишите выражение закона действия масс для реакции 2СО + О2 = 2СО2. Как изменится скорость этой реакции, если объем системы увеличить в 3 раза?
- Как изменится скорость прямой реакции 2SO2 + O2 = 2SO3, при увеличении концентрации обоих веществ в два раза?
- При увеличении температуры на 30° скорость реакции возросла в 64 раза. Вычислите температурный коэффициент реакции.
- Во сколько раз возрастет скорость химической реакции при повышении температуры с 20°С до 50° С, если температурный коэффициент скорости реакции γ = 3?
- Во сколько раз уменьшится скорость реакции при понижении температуры от 100° С до 60 °С, если при охлаждении системы на 10°С скорость реакции уменьшается в два раза?
- Для реакции А + 2В = С + 2D константа скорости К = 10-6 л2 / моль2∙с, концентрации веществ А и В равны соответственно 0,6 моль/л, 1 моль/л. Вычислите скорость этой реакции.
- Для реакции А + В = 2С константа скорости равна 1∙10-8 л/моль∙с, концентрации веществ А и В равны соответственно 1,0 моль/л и 0,5 моль/л. Вычислите скорость этой реакции.