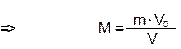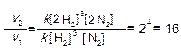ХИМИЯ
Методические указания к выполнению контрольных работ
для студентов заочной сокращенной формы обучения
по направлениям 100700 «торговое дело»,
100800 «товароведение»,
262000 «технология изделий легкой промышленности»,
262200 «конструирование изделий легкой промышленности»
(степень «бакалавр»)
Составители:
Войтова Н.В.
Колесникова О.А.
Тугай И.Д.
Санкт-Петербург
2012
УТВЕРЖДЕНО
на заседании методической комиссии
Регионального института непрерывного обучения
протокол № 1 от 14.09.2012
Рецензент
Р.Ф.Витковская
Оригинал подготовлен составителями и издан в авторской редакции
Подписано в печать 11.10.12. Формат 60х84 1/16. Усл. Печ. л. 2.2.
Тираж 100. Заказ 285/12. Электронный адрес: http://alt-rinpo.sutd.ru/
Отпечатано в типографии СПГУТД. 191028 Санкт-Петербург, ул. Моховая, 26

Общие методические указания
Химия, являясь одной из фундаментальных естественно-научных дисциплин, изучает материальный мир, законы его развития, химическую форму движения материи. С успехами химии и смежных с ней наук связано появление новых источников энергии, создание синтетических материалов, расширение сырьевой базы. Химические знания необходимы не только для понимания основ создания новых материалов и технологическитх процессов, но и для сохранения здоровья людей. Отсутствие элементарной «химической кцльтуры» пагубно отражается на окружающей среде и ставит человечкство на край экологической пропасти.
Химия является одним из основных предметов, составляющих методологическую базу подготовки специалистов в области естественных и технических наук. Знание химии необходимо для успешного последующего изучения общенаучных и специальных дисциплин.
Основной вид занятий студентов-заочников — самостоятельная работа над учеьным материалом. В курсе химии она слагается из следующих элементов: изучение дисциплины по учебникам и учебным пособиям; выполнение контрольных заданий; выполнение лабораторного практикума; индивидуальные консультации (очные и письменные); посещение лекций; сдача зачета по лабораторному практикуму; сдача экзамена по всему курсу.
Работа с книгой. Курс общей и неорганической химии рекомендуется изучать по темам в соответствии с разделами программы. Чтобы лучше запомнить и усвоить изучаемый материал, надо обязательно иметь рабочую тетрадь и заносить в нее формулировки законов и основных понятий химии, новы незнакомын термины и названия, формулы и уравнения реакций и т.п. Изучая курс, обращайтесь к предметному указателю в конце книги. Пока тот или иной раздел не усвоен, переходить к изучению новых разделов не следует. Краткий конспект курса будет полезен при повторении материала в период подготовки к экзамену. Изучение курса должно обязательно сопровождаться выполнением упражнений и решением задач. Решение задач— один из лучших методов прочного усвоения проверки и закрепления теоретического материала.
Контрольные задания. В процесе изучения курса химии студент должен выполнить две контрольные работы. К выполнению контрольной работы можно приступать только тогда, когда будет усвоена определенная часть курса и тщательно разобраны решения притмеров типовых задач, приведенных в данном пособии по соответствующим темам.
Решение задач и ответы на теоретические вопросы должны быть коротко, но четко обоснованы. При решении числовых задач приводится весь ход решения и математические преобразования.
Контрольная работа выполняется в отдельной тетради. Номера и условия задач переписываются в порядке, указанном в контрольной работе. В конце работы приводится список использованной литературы. Работа подписывается студентом с указанием даты и представляется для рецензирования.
Если контрольная работа не зачтена, ее нужно выполнить повторно в соответствии с указаниями рецензента и отдать на рецензирование вместе с незачтенной работой. Исправления следует выполнять в конце тетради, а не в рецензированном тексте.
Таблица вариантов контрольных заданий приведена в конце пособия. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не зачитывается, как сданная.
Лабораторные занятия студенту необходимо выполнить по основным разделам курса. Студенты, пропустившие отдельные темы занятий, отрабатывают их на кафедре по соглашению с преподавателем.
Зачет. Выполнив лабораторный практикум, студенты сдают зачет. Для сдачи зачета необходимо уметь изложить ход выполненных опытов, объяснить результаты работы и выводы из них, уметь составлять уравнения реакций.
Экзамен. К сдаче экзамена допускаются студенты, которые выполнили контрольные задания и сдали зачет по лабораторному практикуму. Экзаменатору студенты предоставляют зачетную книжку, направление на экзамен и зачтенные контрольные работы.

КОНТРОЛЬНОЕ ЗАДАНИЕ № 1
Тема 1. Атомно-молекулярное учение.
Основные химические понятия и законы
Создание атомно-молекулярного учения относится к концу XVIII – началу XIX века. Основные положения этой теории заключаются в следующем:
1. Вещества состоят из молекул; молекулы различных веществ различаются между собой химическим составом, химическими и физическими свойствами.
2. Молекулы находятся в непрерывном движении. Скорость движения зависит от агрегатного состояния вещества.
3. В ходе химических реакций образуются новые вещества, молекулы которых имеют иной качественный и количественный состав.
4. Молекулы состоят из атомов. Свойства атомов одного элемента одинаковы, и отличаются от свойств атомов других элементов.
Атом – мельчайшая частица химического элемента, сохраняющая его свойства. Молекула состоит из атомов, связанных химическими связями. Молекула является мельчайшей частицей вещества, обладающей его свойствами. За единицу количества вещества в химии принято такое количество вещества, которое содержит 6,02∙1023 структурных единиц. Эта единица количества вещества называется молем (n), а число 6,02∙1023 числом Авогадро.(NA). Массу одного моля вещества называют молярной массой вещества(М). Она численно равна молекулярной массе вещества. Моль, масса и молярная масса вещества связаны между собой.
n = m/M
| где:
| n
| — количество вещества (моль);
|
|
| m
| — масса вещества в граммах;
|
|
| M
| — молярная масса вещества в г/моль.
|
а также n = n/NA
| где:
| n
| — количество вещества (моль);
|
|
| n
| — число молекул;
|
|
| NA
| — число Авогадро (моль-1).
|
Одним из основных законов химии является закон сохранения массы веществ (М.Ломоносов, 1741 г.) «Масса веществ, вступивших в реакцию, равна массе веществ, полученных после реакции». Используя этот закон, можно устанавливать количественные соотношения между веществами, участвующими в химических реакциях.
А. Авогадро установил, что в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.(закон Авогадро) Из этого закона вытекают следствия:
I. Одинаковое число молекул различных газов при одинаковых внешних условиях будет занимать одинаковый объем. 1 моль любого газа при нормальных условиях (температура 273 К и давление 101,3 кПа) будет занимать объем 22,4 л. Этот объем называют молярный объем газа (Vо).
n = V/V0
| где:
| n
| — количество вещества (моль);
|
|
| V
| — объем газа (л);
|
|
| V0
| — молярный объем газа (л/моль).
|
II. Относительная плотность одного газа по другому (D) равна отношению молярной массы исследуемого газа к молярной массе газа, с которым проводится сравнение.
D=M1/М2
| где:
| D
| — плотность одного газа по другому (безразмерная величина);
|
|
| M1
| — молярная масса неизвестного газа (г/моль);
|
|
| M2
| — молярная масса газа с которым проводят сравнение (г/моль).
|
Чтобы было понятно, с каким газом проводят сравнение, ставят индекс DH2 (плотность по водороду, т.е. сравнение проводят с водородом)

| где:
| 
| — молярная масса водорода равная 2 г/моль;
|
|
| M(х)
| — молярная масса неизвестного газа (г/моль).
|
тогда

Зная плотность одного газа по другому, можно вычислить молярную массу газа, если химическая формула его неизвестна.
Пример 1. Какой объем займут при н.у. 8 г кислорода?
Молярная масса кислорода (O2) = 32 г/моль. Найдем, сколько молей составляют 8 г кислорода.
n = m/M= 8/32 = 0.25 моль.
Используя следствие из закона Авогадро можно записать V=Vo∙n, подставляем полученное значение и получаем V = 0,25∙22,4 = 5,6 л
Пример 2. Чему равна молярная масса газа и его плотность по воздуху, если 11 грамм его занимают объем 5,6 л (н.у.)?
М(х) = m/ n; n = V/V0 =>
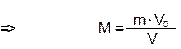

Dвозд. = М(х)/М возд. М возд.= 29 г/моль Dвозд. = 44/29 =1,52
Пример 3. Сколько атомов водорода содержится в 1,7 г аммиака?
Чтобы найти число атомов водорода в молекуле аммиака, нужно сначала найти число молекул аммиака
nмол.= n ∙NA; n = m/M; M(NH3) = 17 г/моль; nмол = 1,7/17∙6,02 1023 = 6,02∙1022. В каждой молекуле аммиака 3 атома водорода, поэтому общее число атомов водорода будет равно
n = 6,02∙1022 ∙ 3 = 1,8∙1023.
Контрольные задачи
- Сколько молей составляют 84 г азота? Какой объем займет эта масса газа при н.у.?
- Какова масса 10 л хлороводорода (н.у.)?
- Какова молярная масса газа, если 2 г его занимают объем 2,8 л (н.у.)?
- Масса 1 литра газа при н.у. равна 2,143г. Найти молярную массу газа и его плотность по воздуху.
- Плотность газа по водороду равна 35,5. Какой объем займут 5 г этого газа при н.у.?
- Сколько молей, молекул и атомов содержится в 12 г озона?
- Плотность газа по водороду 13. Найти массу 1 литра этого газа и его плотность по воздуху.
- Плотность паров серы по воздуху равна 6,62. Сколько атомов содержится в молекуле парообразной серы?
- Какова масса 1020молекул азота?
- Сколько молекул содержится в 3,4 г сероводорода?
- Чему равна масса 1 литра углекислого газа (н.у.)?
- Сколько атомов водорода содержится в 0,28 г этана (С2Н6)?
- Сколько молей и сколько молекул содержится в 4 г гидроксида натрия?
- Где содержится больше молекул вещества: в 100 г серной кислоты или в 100 г воды?
- Какой объем занимают при н.у. 3,01∙1022 молекул газа? Чему равна молярная масса этого газа, если вычисленный объем имеет массу 2,3 г?
- Масса 1 л некоторого газа равна 2,86. Найти молярную массу газа и его плотность по азоту.
- Сколько молекул содержится в 100 г воды?
- Сколько атомов содержится в 0,71 г хлора?
- Плотность газа по воздуху 1,586. Сколько молей составляют 11,5 г этого газа?
- Какой объем займут 5 г некоторого газа(н.у.), если его плотность по водороду 8,5?
Контрольные задачи
Какие вещества требуются для превращений? Напишите соответствующие реакции.
- Cr2O3 => CrCl3 => Cr(OH)3 =>Na3CrO3
- Na2CO3 => CO2 => H2CO3 => CaCO3
- CuO =>CuSO4 => Cu(OH)2 => CuO
- P =>P2O5 => H3PO4 => Mg3(PO4)2 => MgHPO4
- Zn => ZnCl2 => Zn(OH)2 => Na2ZnO2
- CaCO3 => Ca(HCO3)2 => Ca(OH)2 => (CaOH)2SO4
- Zn => Zn SO4 => Zn(HSO4)2 => ZnCO3 =>CO2
- CO2 => CaCO3 => Ca(HCO3)2 => Ca3(PO4)2
- Al => Al2(SO4)3 => Al(OH)3 => AlOH(NO3)2
- SO2 => SO3 => H2SO4 => KHSO4
- Напишите химическую и структурную формулы сульфата железа (III).
- Напишите химическую и структурную формулы гидросульфита алюминия.
- Напишите химическую и структурную формулы карбоната гидроксомагния.
- Напишите химическую и структурную формулы гидрофосфата цинка.
- Напишите химическую и структурную формулы сульфида гидроксохрома (III).
- Напишите химическую и структурную формулы нитрата гидроксосвинца (II).
- Напишите химическую и структурную формулы гидрокарбоната калия.
- Напишите химическую и структурную формулы фосфата гидроксоцинка.
- Напишите химическую и структурную формулы нитрита гидроксобария.
- Напишите химическую и структурную формулы дигидрофосфата меди.
Тема 4. Химическая кинетика
Кинетика химических реакций – это учение о скорости химических процессов.
Скоростью химической реакции называют изменение концентрации какого-либо из реагирующих веществ в единицу времени.
Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса, а именно: концентрации реагирующих веществ, температуры, наличия катализаторов и др.
Зависимость скорости реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции
2NO + O2 → 2NO2 закон действия масс может быть записан
v = k [NO]2[O2],
где v – скорость химической реакции,
k – константа скорости,
[NO], [O2] – концентрации реагирующих веществ.
Реакция в гетерогенной системе, где реагирующие вещества находятся в разных фазах, осуществляется на поверхности раздела между фазами. Поэтому скорость гетерогенной реакции при постоянной температуре зависит от площади поверхности раздела, а не от концентрации твердого вещества. В этом случае для реакции
С (тв) + О2 → СО2 (г)
Закон действия масс может быть записан
v = k [O2]
Пример 1. Как изменится скорость реакции N2+3H2 →2NH3 при увеличении давления в системе в 2 раза?
Так как исходные вещества газообразные, то изменение давления и объема влияют на концентрации этих веществ: увеличение давления пропорционально концентрации этих веществ, а увеличение объема, наоборот, уменьшает концентрацию этих веществ.
Запишем выражение закона действия масс для данной реакции:
v1= k [N2][H2]3,
При увеличении давления в два раза концентрация обоих реагирующих веществ также увеличится в два раза. Тогда
v2 = k [2N2][2H2]3
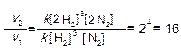
Следовательно, скорость реакции увеличится в 16 раз.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
vt2 = vt1∙ γ( t2- t1)/10, где
vt2 и vt1 скорости реакций при t1 и t2;
γ – температурный коэффициент, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на 10°, может принимать значения от 2 до 4.
Причиной роста скорости реакции от температуры является увеличение доли молекул, имеющих энергию активации, т. е. долю активных молекул. Энергия активации это та энергия, которая необходима чтобы произошла химическая реакция, она всегда больше чем средняя энергия молекул данной системы.
Пример 2. Как изменится скорость реакции при повышении температуры реакции с 25° до 75°, если температурный коэффициент равен 2?
vt2/ vt1 = γ( t2- t1)/10 = 2(75-25)/10 = 25 = 32
Скорость реакции возрастет в 32 раза.
Скорость химической реакции возрастает в присутствии катализатора, который снижает энергию активации, благодаря образованию нестабильных промежуточных соединений.
Контрольные вопросы
- Как следует изменить температуру, чтобы скорость реакции возрасла в 100 раз, если температурный коэффициент равен 2?
- Как изменится скорость реакции 2NO + O2 = 2NO2 при уменьшении давления в 3 раза?
- Как изменится скорость реакции при изменении температуры с 70° до 30° С если
γ = 3? - Как следует изменить давление, чтобы увеличить скорость реакции
С2Н4 + Н2 = С2Н6 в 30 раз?
- Как изменится скорость реакции С2Н4 + НBr = C2H5Br при уменьшении объема в 5 раз?
- Во сколько раз увеличится скорость прямой реакции 2SO2 + O2 = 2SO3, если концентрацию оксида серы (IV) увеличить в три раза?
- Как изменится скорость горения этилена, если концентрацию кислорода увеличить в три раза?
- Определите изменение скорости реакции С4Н6 + 2Н2 = С4Н10 при уменьшении давления в системе в три раза?
- Как изменится скорость горения метана при уменьшении концентрации кислорода в два раза?
- Скорость реакции при 0° С равна 1 моль/л ∙с. Вычислите скорость этой реакции при 30°С, если температурный коэффициент равен 3.
- Определите изменение скорости гетерогенной реакции 2C(тв) + 3H2 (г) = C2H6 (г) при увеличении концентрации водорода в 4 раза.
- Во сколько раз изменится (увеличится или уменьшится) скорость прямой реакции 4NH3 + 3O2 = 2N2 + 6H2O при уменьшении давления в два раза.
- Реакция идет по уравнению 2NO + O2 = 2NO2. Концентрация исходных веществ соответственно равна 0,02 моль/л и 0,03 моль/л. Как изменится скорость реакции при увеличении концентрации обоих исходных веществ до 0,04 моль/л?
- Напишите выражение закона действия масс для реакции 2СО + О2 = 2СО2. Как изменится скорость этой реакции, если объем системы увеличить в 3 раза?
- Как изменится скорость прямой реакции 2SO2 + O2 = 2SO3, при увеличении концентрации обоих веществ в два раза?
- При увеличении температуры на 30° скорость реакции возросла в 64 раза. Вычислите температурный коэффициент реакции.
- Во сколько раз возрастет скорость химической реакции при повышении температуры с 20°С до 50° С, если температурный коэффициент скорости реакции γ = 3?
- Во сколько раз уменьшится скорость реакции при понижении температуры от 100° С до 60 °С, если при охлаждении системы на 10°С скорость реакции уменьшается в два раза?
- Для реакции А + 2В = С + 2D константа скорости К = 10-6 л2 / моль2∙с, концентрации веществ А и В равны соответственно 0,6 моль/л, 1 моль/л. Вычислите скорость этой реакции.
- Для реакции А + В = 2С константа скорости равна 1∙10-8 л/моль∙с, концентрации веществ А и В равны соответственно 1,0 моль/л и 0,5 моль/л. Вычислите скорость этой реакции.
КОНТРОЛЬНОЕ ЗАДАНИЕ № 2
Тема 8. Гидролиз солей
Гидролизом солей называется обратимое взаимодействие ионов соли с ионами воды, приводящее к изменению соотношения между ионами водорода и гидроксид-ионами в растворе. При этом изменяется рН среды. В результате гидролиза могут образовываться молекулы слабых кислот и оснований, анионы кислых солей или катионы основных солей. В большинстве случаев гидролиз является обратимым процессом.
Гидролизу подвергаются только те соли, в состав которых входят ионы слабого электролита (слабой кислоты или слабого основания), потому что для слабых электролитов более характерно существование в молекулярной форме. Соли, образованные сильными кислотами и сильными основаниями гидролизу не подвергаются.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) NaCN, б) K2CO3, в) ZnSO4. Определите реакцию среды в растворах этих солей.
Решение. а) Цианид натрия – соль слабой одноосновной кислоты HCN и сильного основания KOH. При растворении в воде молекулы NaCN диссоциируют на катионы Na+ и анионы CN-. Катионы Na+ не могут связывать ионы OH-, образующиеся при диссоциации воды, так как NaOH - сильное основание. Анионы же CN- связывают ионы Н+ воды, образуя молекулы слабого электролита. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза CN- + H2O = HCN + OH-
В молекулярной форме NaCN + H2O = HCN + NaOH
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор NaCN имеет щелочную реакцию, рН>7.
б) Карбонат калия – соль слабой многоосновной кислоты и сильного основания. Гидролиз пойдет по аниону. Поскольку диссоциация слабых электролитов протекает ступенчато, то и гидролиз также должен идти по стадиям. В этом случае анионы соли СО32- связывая водородные ионы воды, образуют анионы кислой соли НСО3-, а не молекулы Н2СОз, так как ионы НСО3- диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Ионно-молекулярное уравнение гидролиза CO32-+ H2O = HCO3- + OH‑, или в молекулярной форме K2СO3 + H2O = KHСO3 + KOH. В растворе появляется избыток ионов ОН-, поэтому раствор К2СО3 имеет щелочную реакцию, рН>7.
в) Сульфат цинка – соль слабого основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn2+связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекулы Zn(OH)2 не происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза имеет вид: Zn2+ + H2O = ZnOH+ + H+ или в молекулярной форме 2ZnSO4 + 2H2O = (ZnOH)2SO4 + H2SO4 В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию рН<7.
Пример 2. Какие продукты образуются при смешивании растворов Al(NO3)3 и Na2S? Составьте ионно-молекулярное и молекулярное уравнения гидролиза.
Решение. Соль Al(NO3)3 гидролизуется по катиону (так как Al(OH)3 - слабое основание), а Na2S - по аниону(H2S - слабая кислота)
Al3+ + H2O = AlOH2+ + H+
S2- + H2O = HS- + OH-
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, так как ионы Н+ и ОН- образуют молекулу слабого электролита Н2О. При этом равновесие реакции сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием Al(OH)3 и Н2S. Ионно-молекулярное уравнение имеет вид:
2Al3+ +3S2- + 6H2O = 2 Al(OH)3 + 3H2S, а молекулярное уравнение
2Al(NO3)3 + 3Na2S +6H2O = 2 Al(OH)3 + 6NaNO3 + 3H2S
Контрольные вопросы
141. Какое значение рН (больше или меньше 7) имеют растворы солей MnCl2, Na2CO3, Ni(NO3)2? Составьте ионные и молекулярные уравнения гидролиза этих солей.
142. Какие из солей Al2(SO4)3, K2S, Pb(NO3)2, KCl подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза соответсвующих солей.
143. Составьте ионные и молекулярные уравнения гидролиза солей CH3COOK, CuSO4, Al(NO3)3? Какое значение рН имеют растворы этих солей?
144. Какие из солей RbCl, Cr2(SO4)3, Ni(NO3)2 подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза соответствующих солей?
145. При смешивании растворов FeCl3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца. Выразите этот совместный гидролиз ионным и молекулярным уравнениями.
146. Какое значение рН имеют растворы солей Na3PO4, K2S, CoCl2? Составьте ионные и молекулярные уравнения гидролиза этих солей.
147. Составьте ионные и молекулярные уравнения гидролиза этих солей CuSO4, Cs2CO3, ZnCl2.Какое значение рН имеют растворы этих солей?
148. Составьте ионные и молекулярные уравнения совместного гидролиза, происходящего при смешивании растворов K2S и CrCl3. Каждая из взятых солей гидролизуется до конца.
149. Составьте ионные и молекулярные уравнения гидролиза солей K2S, Cs2CO3, NiCl2. Какое значение рН (больше или меньше 7) имеют растворы этих солей?
150. Какие из солей K2CO3, FeCl3, K2SO4, ZnCl2 подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза этих солей. Какое значение рН имеют растворы этих солей?
151. При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный процесс гидролиза ионным и молекулярным уравнениями.
152. Какие из солей NaBr, Na2S, K2CO3, CoCl2 подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза этих солей. Какое значение рН имеют растворы этих солей?
153. Какое значение рН имеют растворы солей Li2S, Al(NO3)3, NiSO4? Составьте ионные и молекулярные уравнения гидролиза этих солей.
154. Какие из солей KNO3, CrCl3, Cu(NO3)2, NaCN подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза этих солей. Какое значение рН имеют растворы этих солей?
155. Составьте ионные и молекулярные уравнения совместного гидролиза, происходящего при смешивании растворов Cu(NO3)2 и Na2S. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты.
156. Какое значение рН имеют растворы солей K3PO4, Pb(NO3)2, K2S? Составьте ионные и молекулярные уравнения гидролиза этих солей.
157. Какие из солей K2CO3, FeCl3, K2SO4, ZnCl2 подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза этих солей. Какое значение рН имеют растворы этих солей?
158. При смешивании растворов Al2(SO4)3 и K2СO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный процесс гидролиза ионным и молекулярным уравнениями.
159. Составьте ионные и молекулярные уравнения гидролиза солей Na2SiO3, CoCl2,MgCl2. Какое значение рН имеют растворы этих солей?
160. Какое значение рН имеют растворы солей NiSO4, Na2SO3, Al2(SO4)3?Составьте ионные и молекулярные уравнения гидролиза этих солей.
Литература
- Н. Л.Глинка Общая химия.М.: Интеграл – Пресс, 2011.
- Н.Л. Глинка Задачи и упражнения по общей химии. М.: Интеграл – Пресс, 2011.
- А.В.Суворов, А.Б. Никольский Общая химия, СПб.: Химиздат, 2000.
- М.И.Гельфман, В.П. Юстратов Химия СПб.: Лань, 2001.
Варианты контрольных заданий
Каждый студент выполняет вариант контрольных заданий, обозначенный двумя последними цифрами номера студенческого билета. Нарпимер, номер зачетной книжки — 1140046, две последние цифры — 46, им соответствует вариант контрольного задания 46. Если последние две цифры в зачётной книжки больше 50, то номер вашего варианта = (две последние цифры зачётной книжки – 50). Например: две последние цифры 91 – 50 = 41. Номер варианта = 41.
Варианты контрольных заданий:
| Номера вариантов
| Номера контрольных заданий
| Номера задач, относящихся к данному заданию
|
| 01
| I
II
| 1 21 41 61 81
101 121 141 161 181 201
|
| 02
| I
II
| 2 22 42 62 82
102 122 142 162 182 202
|
| 03
| I
II
| 3 23 43 63 83
103 123 143 163 183203
|
| 04
| I
II
| 4 24 44 64 84
104 124 144 164 184204
|
| 05
| I
II
| 5 25 45 65 85
105 125 145 165 185 205
|
| 06
| I
II
| 6 26 46 66 86
106 126 146 166 186 206
|
| 07
| I
II
| 7 27 47 67 87
107 127 147 167 187 207
|
| 08
| I
II
| 8 28 48 68 88
108 128 148 168 188 208
|
| 09
| I
II
| 9 29 49 69 89
109 129 149 169 189 209
|
| 10
| I
II
| 10 30 50 70 90
110 130 150 170 190 210
|
| 11
| I
II
| 11 31 51 71 91
111 131 151 171 191 211
|
| 12
| I
II
| 12 32 52 72 92
112 132 152 172 192 212
|
| 13
| I
II
| 13 33 53 73 93
113 133 153 173 193 213
|
| 14
| I
II
| 14 34 54 74 94
114 134 154 174 194 214
|
| 15
| I
II
| 15 35 55 75 95
115 135 155 175 195 215
|
| 16
| I
II
| 16 36 56 76 96
116 136 156 176 196 216
|
| 17
| I
II
| 17 37 57 77 97
117 137 157 177 197 217
|
| 18
| I
II
| 18 38 58 78 98
118 138 158 178 198 218
|
| 19
| I
II
| 19 39 59 79 99
119 139 159 179 199 219
|
| 20
| I
II
| 20 40 60 80 100
120 140 160 180 200 220
|
| 21
| I
II
| 1 22 43 64 85
101 122 143 164 185 206
|
| 22
| I
II
| 2 23 44 65 86
102 123 144 165 186 207
|
| 23
| I
II
| 3 24 45 66 87
103 124 145 166 187 208
|
| 24
| I
II
| 4 25 46 67 88
104 125 146 167 188 209
|
| 25
| I
II
| 5 26 47 68 89
105 126 147 168 189 210
|
| 26
| I
II
| 6 27 48 69 90
106 127 148 169 190 211
|
| 27
| I
II
| 7 28 49 70 91
107 128 149 170 191 212
|
| 28
| I
II
| 8 29 50 71 92
108 129 150 171 192 213
|
| 29
| I
II
| 9 30 51 72 93
109 130 151 172 193 214
|
| 30
| I
II
| 10 31 52 73 94
110 131 152 173 194 215
|
| 31
| I
II
| 11 32 53 74 95
111 132 153 174 195 216
|
| 32
| I
II
| 12 33 54 75 96
112 133 154 175 196 217
|
| 33
| I
II
| 13 34 55 76 97
113 134 155 176 197 218
|
| 34
| I
II
| 14 35 56 77 98
114 135 156 177 198 219
|
| 35
| I
II
| 15 36 57 78 99
115 136 157 178 199 220
|
| 36
| I
II
| 16 37 58 79 100
116 137 158 179 200 201
|
| 37
| I
II
| 17 38 59 80 81
117 138 159 180 181 202
|
| 38
| I
II
| 18 39 60 62 82
118 139 160 161 182 203
|
| 39
| I
II
| 19 40 41 63 83
119 140 141 162 183 204
|
| 40
| I
II
| 20 21 42 63 84
120 121 142 163 184 205
|
| 41
| I
II
| 2 22 43 64 85
102 123 144 165 186 207
|
| 42
| I
II
| 3 23 44 65 86
103 124 145 166 187 208
|
| 43
| I
II
| 4 24 45 66 87
104 125 146 167 188 209
|
| 44
| I
II
| 5 25 46 67 88
105 126 147 168 189 210
|
| 45
| I
II
| 6 26 47 68 89
106 127 148 169 190 211
|
| 46
| I
II
| 7 27 48 69 90
107 128 149 170 191 212
|
| 47
| I
II
| 8 28 49 70 91
108 129 150 171 192 213
|
| 48
| I
II
| 9 29 50 71 92
109 130 151 172 193 214
|
| 49
| I
II
| 10 30 51 72 93
110 131 152 173 194 215
|
| 50
| I
II
| 11 31 52 73 94
111 132 153 174 195 216
|
ХИМИЯ
Методические указания к выполнению контрольных работ
для студентов заочной сокращенной формы обучения
по направлениям 100700 «торговое дело»,
100800 «товароведение»,
262000 «технология изделий легкой промышленности»,
262200 «конструирование изделий легкой промышленности»
(степень «бакалавр»)
Составители:
Войтова Н.В.
Колесникова О.А.
Тугай И.Д.
Санкт-Петербург
2012
УТВЕРЖДЕНО
на заседании методической комиссии
Регионального института непрерывного обучения
протокол № 1 от 14.09.2012
Рецензент
Р.Ф.Витковская
Оригинал подготовлен составителями и издан в авторской редакции
Подписано в печать 11.10.12. Формат 60х84 1/16. Усл. Печ. л. 2.2.
Тираж 100. Заказ 285/12. Электронный адрес: http://alt-rinpo.sutd.ru/
Отпечатано в типографии СПГУТД. 191028 Санкт-Петербург, ул. Моховая, 26

Общие методические указания
Химия, являясь одной из фундаментальных естественно-научных дисциплин, изучает материальный мир, законы его развития, химическую форму движения материи. С успехами химии и смежных с ней наук связано появление новых источников энергии, создание синтетических материалов, расширение сырьевой базы. Химические знания необходимы не только для понимания основ создания новых материалов и технологическитх процессов, но и для сохранения здоровья людей. Отсутствие элементарной «химической кцльтуры» пагубно отражается на окружающей среде и ставит человечкство на край экологической пропасти.
Химия является одним из основных предметов, составляющих методологическую базу подготовки специалистов в области естественных и технических наук. Знание химии необходимо для успешного последующего изучения общенаучных и специальных дисциплин.
Основной вид занятий студентов-заочников — самостоятельная работа над учеьным материалом. В курсе химии она слагается из следующих элементов: изучение дисциплины по учебникам и учебным пособиям; выполнение контрольных заданий; выполнение лабораторного практикума; индивидуальные консультации (очные и письменные); посещение лекций; сдача зачета по лабораторному практикуму; сдача экзамена по всему курсу.
Работа с книгой. Курс общей и неорганической химии рекомендуется изучать по темам в соответствии с разделами программы. Чтобы лучше запомнить и усвоить изучаемый материал, надо обязательно иметь рабочую тетрадь и заносить в нее формулировки законов и основных понятий химии, новы незнакомын термины и названия, формулы и уравнения реакций и т.п. Изучая курс, обращайтесь к предметному указателю в конце книги. Пока тот или иной раздел не усвоен, переходить к изучению новых разделов не следует. Краткий конспект курса будет полезен при повторении материала в период подготовки к экзамену. Изучение курса должно обязательно сопровождаться выполнением упражнений и решением задач. Решение задач— один из лучших методов прочного усвоения проверки и закрепления теоретического материала.
Контрольные задания. В процесе изучения курса химии студент должен выполнить две контрольные работы. К выполнению контрольной работы можно приступать только тогда, когда будет усвоена определенная часть курса и тщательно разобраны решения притмеров типовых задач, приведенных в данном пособии по соответствующим темам.
Решение задач и ответы на теоретические вопросы должны быть коротко, но четко обоснованы. При решении числовых задач приводится весь ход решения и математические преобразования.
Контрольная работа выполняется в отдельной тетради. Номера и условия задач переписываются в порядке, указанном в контрольной работе. В конце работы приводится список использованной литературы. Работа подписывается студентом с указанием даты и представляется для рецензирования.
Если контрольная работа не зачтена, ее нужно выполнить повторно в соответствии с указаниями рецензента и отдать на рецензирование вместе с незачтенной работой. Исправления следует выполнять в конце тетради, а не в рецензированном тексте.
Таблица вариантов контрольных заданий приведена в конце пособия. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не зачитывается, как сданная.
Лабораторные занятия студенту необходимо выполнить по основным разделам курса. Студенты, пропустившие отдельные темы занятий, отрабатывают их на кафедре по соглашению с преподавателем.
Зачет. Выполнив лабораторный практикум, студенты сдают зачет. Для сдачи зачета необхо