1. Концентрация кислоты. Концентрация кислоты влияет на ее окислительные свойства и если концентрация будет не достаточной, то полученное золото будет не достаточно чистым, и не благородные примеси могут остаться в металле. Если же концентрация будет высокой, то часть золота может перейти в раствор и будет потеряно с металлическим серебром.
2. Избыток кислоты по отношению к стехиометрии. Растворение примесей в кислоте идет с выделением тепла. Перегрев сопровождается разложением кислоты, т.е. не целевым расходом. Избыток зависит от соотношения компонентов в аффинируемом металле и находится опытным путем.
3. Температура. Действие аналогично концентрации кислоты.
4. Количество промывок осадка после аффинирования. Иногда для лучшего удаления аффинируемый металл обрабатывают несколько раз. Однако это приводит к увеличению расхода кислоты.
Кислотные методы аффинажа громоздки, дороги. Из-за этих недостатков кислотные методы в настоящее время применяются ограниченно.
Экспериментальная часть.
Описание экспериментальной установки
Для изучения процесса кислотного аффинирования не требуется специальной экспериментальной установки. Необходимы термостойкие стаканы, плитка, вытяжка, фильтровальная воронка, лабораторная посуда и т.д.
Порядок выполнения работы.
1. Получить в установленном порядке черновое золото 200-800 пробы с известной концентрацией золота и примесей. Либо приготовить самостоятельно несколько искусственных сплавов с различным содержанием меди, цинка, серебра и т.д.
2. Приготовить растворы азотной (серной) кислоты с различной концентрацией по заданию преподавателя (70, 80, 90, 95, 99%)
3. Рассчитать расход кислоты по стехиометрии уравнений реакций (1-3) с учетом коэффициента избытка кислоты по заданию преподавателя
4. В термостойкие стаканы поместить навески металла, залить кислотой, поставить на плитку и поместить в вытяжной шкаф.
5. Дождаться завершения реакции, добавляя в стаканы по мере протекания реакции дистиллированную воду. Окончание реакции регистрируется по окончанию выделения окислов азота.
6. По окончанию реакции декантировать раствор, промыть осадок дистиллированной водой. После получения нейтральных смывов отфильтровать осадок. Осадок высушить и взвесить Мсплав (аф).
7. Полученный осадок прокипятить с 5-кратным избытком концентрированной кислоты. Аналогично пунктам 4-6 получить осадок чистого золота, переплавить его в слиток и взвесить МAuчист. Результаты записывать таблицу
8. Повторить опыт при различных концентрациях кислоты, различном избытке кислоты относительно стехиометрии и при различных соотношениях примесных элементов в сплаве
Обработка экспериментальных данных
1. Рассчитать расход азотной кислоты по формулам исходя из стехиометрии реакций:
3Zn + 8HNO3 = 3Zn(NO3)2 + 2NO + 4H2O (7)
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O (8)
MHNO3Ag = ((MAg * 4 * Mr HNO3 / 3 * ArAg) / CHNO3) * Kизб (9)
MHNO3Zn = ((MZn * 8 * Mr HNO3 / 3 * ArZn) / CHNO3) * Kизб (10)
MHNO3Cu = ((MCu * 8 * Mr HNO3 / 3 * ArCu) / CHNO3) * Kизб (11)
å MHNO3 = MHNO3i (12)
где: MAg MZn MCu – масса серебра, цинка, меди с навеске сплава, грамм
Mr HNO3 , – молекулярная масса азотной кислоты, 63 г/моль
CHNO3 – концентрация азотной кислоты, в долях
ArAg ArZn ArCu – атомная масса серебра, цинка, меди, 107,8; 65,3; 63,5 г/моль соответственно
Kизб – коэффициент избытка кислоты
2. Рассчитать концентрацию золота в очищенном сплаве по формуле:
СAu = (МAuчист / Мсплав (аф).) * 100% (13)
3. Рассчитать степень извлечения золота по формуле:
ХAu = (МAuчист / МAuисх) * 100% (14)
где: МAuисх – масса золота в исходном металле, грамм
4. Построить график зависимости степени извлечения и концентрации золота в аффинированном металле при стехиометрическом расходе кислоты. По данному графику найти минимальную исходную концентрацию, обеспечивающую наибольшее извлечение при условии получения золота требуемого качества.
5. На основе полученных экспериментальных данных при помощи математического пакета статистической обработки данных вывести многофакторную зависимость типа: ХAu = f (СAg, СZn, СCu), СAu = f (СAg, СZn, СCu)
Таблица 13
Результаты экспериментов кислотного аффинирования
| Химический состав исходного металла, %
| CHNO3, %
| Kизб
| СAu, %
| ХAu, %
| Мсплав (аф), г
|
| Au
| Ag
| Zn
| Cu
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вопросы допуска
1. Какова цель работы?
2. Ход выполнения работы?
3. Какие закономерности исследуются в данной работе?
Контрольные вопросы
1. Опишите аффинирование азотной кислотой?
2. Опишите аффинирование по методу д'Арсе?
3. Что такое «царская водка»? Что обуславливает ее окислительные свойства?
4. Опишите аффинирование «царской водкой»
5. Какие факторы влияют на кислотное аффинирование?
6. Какое максимально допустимое содержание меди и свинца в металле перед кислотным аффинированием? Почему?
7. Как вернуть серную кислоту в рецикл при кислотном аффинировании?
8. Что такое купелирование?
Лабораторная работа № 7
Исследование влияния состава электролита для рафинирования серебра и золота на выход по току с применением ЭВМ
(2 часа)
Цель работы: Изучить влияние состава электролита, концентрации нитрата серебра и РН-среды и плотности тока на катоде и аноде на показатели электролиза при рафинировании – выход по току и степень извлечения драгоценных металлов из рафинируемого сплава
Теоретическая часть.
Наиболее совершенным способом аффинирования золота и серебра на сегодняшний день является электролитическое рафинирование. Данный способ более технологичен, т.к. при этом не затрачиваются дорогостоящие кислоты и не образуются ядовитые оксиды азота, серы, хлор.
При электролизе серебра. Анодом при рафинировании служит металл Доре, электролит представляет собой водный раствор нитрата серебра с добавкой азотной кислоты для обеспечения максимальной электропроводности раствора. Серебро подвергается анодному растворению и осаждается на катоде, примеси переходят в раствор, а золото выпадает в осадок.
Схематически процесс электролитического рафинирования серебра можно представить следующей совокупностью реакций:
Катодный процесс:
Ag+ + e = Ag (1)
2H+ + 2e = H2 (2)
2NO3- + 10H+ + 8e = N2O + 5H2O (3)
NO3- + 4H+ + 3e = NO + 2H2O (4)
Анодный процесс:
Ag - e = Ag+ (5)
2H2O - 4e = 4H+ + O2 (6)
4 NO3- - 4e = 2N2O5 + O2 (7)
N2O5 + H2O = 2H+ + 2NO3- (8)
При электролизе золота. В качестве анодов при электролизе золота используют рафинируемый золотой сплав, содержащий в качестве примесей серебро, платиновые металлы и некоторые неблагородные металлы. Электролитом служит водный раствор хлорного золота с добавкой соляной кислоты для электропроводности.
Схематически процесс электролитическое рафинирование золота можно представить следующей совокупностью реакций:
Образование ионизированного золота:
AuCl3 + HCl = HAuCl4 (9)
HAuCl4 = H+ + AuCl4- (10)
Катодный процесс:
AuCl4- + 3e = Au + 4Cl- (11)
Au + 2Cl- - e = AuCl4- (12)
3AuCl2- = AuCl4- + 2Au + 2Cl- (13)
AuCl2- + e = Au +2Cl- (14)
Анодный процесс:
Au + 4Cl- - 3e = AuCl4- (15)
Существует проблема получения высокой силы тока в ванне электролиза, т.к. от силы тока, согласно закону Фарадея напрямую зависит производительность электролизера.
M = ЭAg * I * Dt, (16)
где: ЭAg – электрохимический эквивалент серебра = (107,88/1) / 96500 = 0,0011(107,88 г/моль – молярная масса эквивалента серебра, 1 – число участвующих электронов, 96500 Кулон – число Фарадея)
I – сила тока, А
Dt – время электролиза, сек
На силу тока же влияет и напряжение, подаваемое на ванну и сопротивление раствора (химический состав раствора).
Влияние напряжения: К электродам, помещенным в раствор, прилагают напряжение и постепенно его увеличивают. Вначале ток почти не протекает через раствор. При достижении определенного значения напряжения происходит резкое увеличение силы тока. Далее с увеличением напряжения ток расти перестает. Величина этого тока называется током насыщения. Такая зависимость называется вольт-амперной характеристикой.
Влияние химического состава раствора: Величина напряжения, при котором ток начинает расти определяется природой катионов, содержащихся в растворе. А величина, на которую увеличивается сила тока (ток насыщения) прямо пропорциональна их концентрации. На величину силы тока может повлиять как концентрация катионов (в случае рафинирования золота, Ag+, %) так и другие ионы, содержащиеся в электролите.
На рисунке 24 представлена вольтамперная характеристика электролита с фиксированным содержанием ионов серебра и различной концентрацией азотной кислоты.
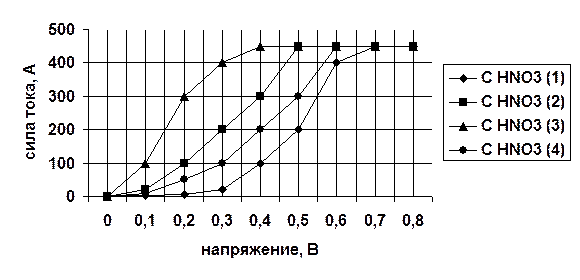
Рисунок 23 Вольт-амперная характеристика электролита с фиксированным содержанием ионов серебра и различной концентрацией серной кислоты С HNO3 (1) < С HNO3 (2) < С HNO3 (3) < С HNO3 (4)
Как видно из графика рисунок 23 с ростом концентрации кислоты снижается напряжение, при котором достигается ток насыщения. Однако после определенной концентрации это напряжение снова растет. Наша задача же добиться тока насыщения при том напряжении, при котором на катоде будет восстанавливаться только серебро (0,7-0,9 В). Далее аналогичные вольт-амперные характеристики изучаются для электролита других концентрации ионов серебра. Величина тока насыщения для других Ag+, % будет отличаться. По результатам этих строится график зависимости тока насыщения от Ag+, %. Подобная зависимость представлена на рисунке 24.
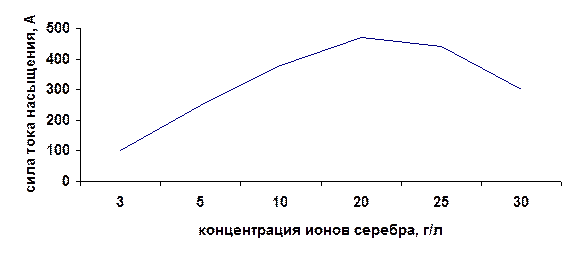
Рисунок 24 Зависимость силы тока насыщения от концентрации ионов серебра в электролите
Существует определенная концентрация ионов серебра, при которой наблюдается максимальная сила тока насыщения, т.к. при высоких концентрациях возможно увеличение электрического сопротивления раствора за счет уменьшения степени электролитической диссоциации. Эта концентрация является оптимальной для проведения процесса электролиза и должна поддерживаться в ванне постоянной.
Конечно это только общие закономерности. Реальные зависимости для конкретных электролитов будут иметь свои нюансы, которые необходимо изучать опытным путем.
Фактический расход электроэнергии на производство серебра и золота можно рассчитать с использованием величины выхода по току, который является своего рода КПД процесса электролиза и может быть рассчитан как отношение теоретического расхода электроэнергии к расходу фактическому:
Кт = Wпракт / Wтеорет (17)
Wпракт = I * t * V / G * Kт, (18)
где: I – сила тока, А
t – время электролиза, ч
V – общее напряжение ванны, В
Kт – выход по току (для производства золота и серебра – 0,97-0,98), после электролиза и почти 1 с учетом металла извлеченного из раствора, после повторного рафинирования серебра и т.д.
G – масса полученного металла, кг
Конечно доля затрат на электроэнергию в структуре общих затрат при производстве золота и серебра очень мала. Поэтому гораздо более важен выход по току, найденный по формуле:
КТ = (Gтеорет / Gпракт ) *100%, (19)
где: Gтеорет – теоретический выход металла, рассчитанный по закону Фарадея, грамм
Gпракт – практический выход металла, грамм
Например, если электролиз сплава с содержанием 2% золота и 16% серебра велся при силе тока 1000 Ампер в течение 1 часа. Следовательно, мы должны были получить согласно закону Фарадея 0,0011*1000*3600 = 4024,43 грамм серебра. Следовательно, золота мы должны получить
Gзолота = Gсеребра * (Хзолота / Хсеребра) (20)
где: Gзолота , Gсеребра - масса золота и серебра, грамм
Хзолота, Хсеребра – концентрация золота и серебра и серебра в сплаве Доре, %
Gзолота = 4024,43 * (2/16) = 503,05 грамм
Немаловажной деталью при электролитическом производстве золота и серебра является то, что плотность тока на катоде должна быть такова, чтобы восстанавливающееся серебро не плотно оседало на катоде. Отделить потом серебро от катода, не загрязнив при этом металл, очень сложно. Поэтому в каждом конкретном случае подбирают опытным путем такую плотность тока (отношение силы тока к площади поверхности катода) при которой серебро не оседает на поверхности, а после восстановления в виде крупных кристаллов отваливается от катодов в специальные подкатодные емкости.
В ходе практики электролиза выработаны некоторые рекомендации по условиям ведения процесса. Так для электролиза серебра:
Плотность тока 300-400 А/м2
Состав электролита:
HNO3 = 0,5-1,0 %, Ag = 120-150 г/л, Pd не более 0,1-0,2 г/л, Cu не более 100 г/л в растворе (не более 7,5% в очищаемом металле), Te не более 16-30 мг/л, Pt не более 0,025 г/л.
Напряжение – 0,7-2,5 В
Удельный расход электроэнергии 0,3-0,6 кВт*ч/т
Выход по току 94-96%
Электролиз серебра обычно ведут в прямоугольных ваннах системы Мебиуса рисунок 25, изготовленных из винипласта.

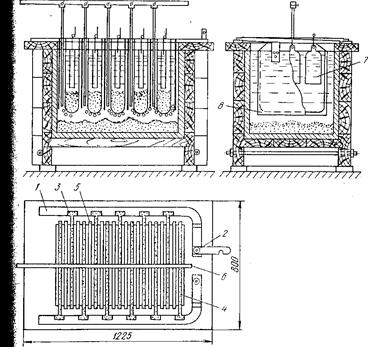
Рисунок 25 Ванна Мебиуса для электролиза серебра
На анодной штанге закреплено от одного до трех анодов, расположенных в ряд. Катод обычно делают один на всю ширину ванны. Аноды помещают в чехлы из хлорвиниловой ткани или другого материала. При растворении анода шлам собирается на дне чехла, благодаря чему исключается загрязнение катодного металла.
При электролизе с вертикальным расположением электродов силовые линии распределяются неравномерно, концентрируясь в нижней части электродов. Вследствие этого нижняя часть анодов растворяется быстрее верхней. Во избежание этого аноды отливают утолщенными книзу. Для лучшего контакта с токоподводящими шинами и снижения выхода анодных остатков удобно пользоваться сплошными анодами, отлитыми вместе с ушками для подвешивания в ванну.
Аноды массой до 10 кг и более и толщиной 5—15 мм рассчитаны на растворение в течение 2—3 суток. Процесс электролиза ведут круглосуточно. Серебро осаждается на катоде в виде крупнокристаллического осадка, неплотно пристающего к катоду. Кристаллы серебра растут в направлении к аноду, стремясь замкнуть электроды. Поэтому их периодически счищают вручную лопатками или непрерывно механическими скребками. Электролит перемешивают либо с помощью сжатого воздуха, подаваемым в ванну по винипластовым или стеклянным трубкам, либо механическими скребками (одновременно со снятием катодного осадка). Упавшие на дно ванны кристаллы серебра периодически извлекают дырчатыми совками из алюминия.
Серебро, выгруженное из ванн, промывают последовательно разбавленной (2—3%-ной) азотной кислотой и горячей водой, Шрессуют для удаления влаги и плавят в слитки. Чистота катод-|ного серебра после плавки составляет 999,7—999,9 проб.
для электролиза золота:
Плотность тока 800-1500 А/м2
Состав электролита:
HCl = 40-80 г/л (При большей концентрации возможно осаждение хлорида золота на поверхности электрода. Анод пассивируется и на нем начнет выделяться хлор), Au = 100-200 г/л, Cu = 90 г/л, Pt = 50 г/л, Pd – 15 г/л
Состав металла:
Сu – до 2%, Ag – до 5-6% при использовании постоянного тока и до 20% при использовании асимметричного тока по методу Вольвилля, Pb – до 13% и исключая от 3 до 10 % в присутствии серы. Bi – до 0,3%, S – 2,16-6,87%, As, Sn, Sb до 0,05% каждый
Напряжение – 1 В
Выход по току 96-98%
Электролиз золота ведут в небольших ваннах из фарфора или винипласта рисунок 26. В отечественной практике применяют фарфоровые ванны емкостью 25 л. В качестве катодов используют золотую жесть толщиной 0,1—0,25 мм, изготовляемую прокаткой чистого электролитного золота. Для придания катодам жесткости их подвергают рифлению на специальном прессе. В ванны подвешивают 18 катодов (на рисунке не показаны) на шести штангах (по 3 катода в ряд) и 15 анодов на пяти штангах (по 3 анода в ряд). Масса одного анода составляет примерно 2 кг. Аноды подвешивают к штангам с помощью золотых ленточек, вплавленных в металл при отливке анодов. Для поддержания необходимой температуры электролита ванны устанавливают в водяных банях. Электролит перемешивается сжатым воздухом, подаваемым в ванны по стеклянным трубкам. Так как при электролизе выделяется хлор, ванны помещают в специальном вытяжном шкафу. Ток подводят снаружи шкафа по медным шинам, а внутри — серебряными как более стойкими в атмосфере хлора. Из серебра же делают штанги для подвески электродов.
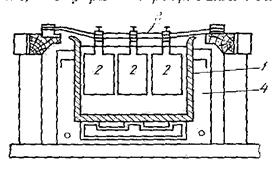
Рисунок 26 Ванна для электролитического аффинирования золота
Катодное золото промывают горячей водой, очищают щетками, обрабатывают соляной кислотой или аммиаком (для растворения случайно приставших частиц хлорида серебра), снова промывают водой, сушат и плавят в индукционной печи в слитки. Чистота катодного золота 999,8—999,9 пробы.
Анодный шлам выгружают из ванн и отмывают водой от электролита. Промывные воды используют для доливки ванн. Шлам загружают в сетчатый серебряный барабан, помещенный в наполненную водой ванну. При вращении барабана хлорид серебра через отверстия смывается в ванну, а более крупные частицы золотого анодного скрапа и дендриты катодного золота остаются в барабане. Золотые остатки сушат и возвращают в плавку на аноды. Хлористое серебро восстанавливают железным скрапом или порошком в солянокислой среде, промывают водой и плавят в аноды для серебряного электролиза. Выход анодного скрапа при электролизе золота зависит от чистоты анодов и колеблется от 10 до 20% от массы исходных анодов. Так же, как и шлам, остатки анодов отмывают в сетчатом барабане от хлорида серебра и электролита, сушат и плавят в аноды.
В случае необходимости получения золота и серебра 999,99 и 999,999 пробы используют 3-х кратное рафинирование. Поскольку вредные примеси сильно влияют на электролиз – это обычно завершающая стадия очистки.
Экспериментальная часть
Описание экспериментальной установки.
Установка для определения выхода по току, созданная на основе установки по изучению вольт-амперных характеристик, представлена на рисунке 27. Электролизер 5 в который заливается электролит 4 запитывается от понижающего трансформатора 1, подающего на электролизер постоянный ток. Трансформатор оснащен системой регулирования вторичного напряжения от 0 до 5 вольт. В электролит помещаются два электрода. Отрицательно заряженный катод 6 где происходит восстановление ионов серебра и положительно заряженный анод 7, материал которого подвергается анодному разложению за счет окисления элементарного серебра и перехода его в раствор. Сила тока в цепи измеряется последовательно подключенным амперметром 3. Напряжение, подаваемое на ванну измеряется вольтметром 2, который подключен параллельно с трансформатором. С помощью счетчика электрической энергии 8 определяем расход электроэнергии, которая затрачивается на проведение процесса электролиза. Раствор в электролизере перемешивается с помощью мешалки 9. Из бюреток 10 и 11 в электролизер добавляется раствор нитрата серебра и раствор азотной кислоты соответственно для поддержания необходимой концентрации нитрата в электролите и РН-среды. Электролит охлаждается с помощью холодильника 12 внутри которого циркулирует охлаждающая вода. На катод надет плотный матерчатый мешочек 13 для сбора кристаллов серебра. На анод надет такой же мешочек 12 для сбора осадка кристаллов чистого золота.
Порядок выполнения работы.
1. Получить в установленном порядке образцы сплава, содержащего драгоценные металлы – золото и серебро, а также соль – нитрат серебра.
2. Электролиз проводим, используя водные растворы. Растворы готовить по заданию преподавателя, с различным содержанием нитрата серебра (от 0 до 70%) и азотной кислоты. Кислоту прикапывать к готовому раствору до получения РН-среды по указанию преподавателя.
3. Перед началом работы взвесить анод, измерить длину, ширину, толщину катода и записать результат. Надеть мешочек на анод и поместить электроды в электролизер
4. Залить электролит в электролизер и подать необходимое напряжение, включить систему охлаждения.
5. Визуально наблюдать за тем как будет осаждаться серебро на катоде. Если на катоде будет образовываться плотный осадок, то следует отключить установку и заменить катод на другой меньших размеров, чтобы увеличить плотность тока. Повторять эту операцию до тех пор серебро, восстанавливающееся на катоде, не станет отпадать в виде шлама. Серебро с использованных катодов отчистить, взвесить и сдать мастеру для дальнейшей переработки.
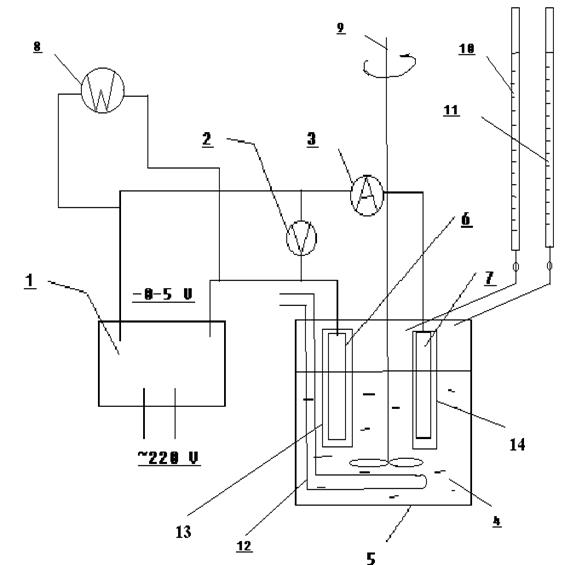
Рисунок 27 Экспериментальная установка для определения выхода по току в процессе электролитического разделения золота и серебра.
6. По мере протекания процесса электролиза возможно изменение концентрации ионов серебра и азотной кислоты, которое может повлечь изменение РН-среды в электролите. Отчасти это можно контролировать периодическим определением РН раствора с помощью универсальной индикаторной бумажки. Основным показателем, показывающим изменение химического состава электролита, является изменение напряжения ванны. Как правило, оно повышается. Также может упасть сила тока. Если это произошло необходимо проверить РН. Если РН высокий, то из бюретки прикапываем дополнительную азотную кислоту. Если РН стабильно, значит надо добавить нитрата серебра. В момент прибавления реагента включается мешалка для быстрого и равномерного распределения. Добавка реагентов производится до выхода на стабильные параметры.
7. Все параметры процесса записывать в таблицу 13 каждые 5 минут.
8. В конце опыта извлечь из электролизера мешочки с осадком серебра, и осадком золота. Удалить из мешочков катод и анод. Промыть каждый из них в отдельной емкости с дистиллированной водой. Взвесить анод. В соответствующие емкости поместить вывернутые наизнанку мешочки и тщательно прополоскать. Полученные взвеси отфильтровать через обеззольнные бумажные фильтры. Емкость несколько раз сполоснуть дистиллированной водой. Фильтры поместить в огнеупорные тигли и переплавить осадки в муфельной печи. По счетчику определить количество израсходованной электроэнергии.
9. Полученные в ходе опытов очищенные золото, серебро, а также оставшийся электролит сдать мастеру под расписку в журнале учета расхода и прихода драг. металла.
Обработка экспериментальных данных.
1. Произвести расчет расхода нитрата серебра для приготовления электролита, исходя из формулы 8 учитывая, что плотность воды равна 1 г/мл:
СAgNO3 = (G AgNO3 / (G AgNO3 + GH2O)) * 100%, (21)
где: G AgNO3 – масса нитрата серебра, г
GH2O – масса воды, г
2. Рассчитать площадь поверхности электрода (части, которая была погружена в электролит) по формуле:
F = a*b*2 + a*c*2 + b*c, (22)
где: a, b, c – длина, ширина и толщина соответственно части электрода, погруженной в электролит, см
3. Рассчитать плотности тока при различных концентрациях сульфата меди Iуд в электролите как отношение силы тока гальванического элемента I к площади поверхности электрода F по формуле:
Iуд = I / F (23)
4. По формулам 17, 18, 19 рассчитать выход по току для золота и серебра. Все результаты записать в таблицу
5. Построить график зависимости выхода по току для различных концентраций азотной кислоты для фиксированных значений концентрации нитрата серебра и для различных концентраций нитрата серебра в районе токов насыщения.
6. На основе полученных результатов, с помощью математического пакета корреляционно-регрессионного анализа установить многофакторную зависимость вида: Выход по току = f (С НNO3, %, С AgNO3, %, напряжение на ванне).
7. Сделать выводы по проделанной работе
Таблица 14
Результаты изучения влияния концентрации азотной кислоты и ионов серебра на выход по току при электролитическом разделении золота и серебра.
| Время, мин
| U, В
| I, А
| Iуд, А/см2
| СНNO3, %
| СAgNO3, %
| РН
| Расход эл. энергии, кВт*ч
| Масса, г
| Выход по току Кт
|
| Ag
| Au
| Ag
| Au
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вопросы допуска
1. Какова цель работы?
2. Ход выполнения работы?
3. Какие закономерности исследуются в данной работе?
Контрольные вопросы
1. Опишите общие принципы рафинирования Ag и Au.
2. Запишите электрохимические реакции рафинирования серебра
3. Запишите электрохимические реакции рафинирования золота
4. Какие оптимальные условия электролитического аффинирования Ag?
5. Какие оптимальные условия электролитического аффинирования Au?
6. Опишите электролитическую ванну Мебиуса
7. Опишите ванну электролитического аффинирования Au
8. Закон Фарадея? Как напряжение влияет на показатели электролиза?
9. Что такое вольт-амперная характеристика?
10. Что такое выход по току и как его рассчитать?
Лабораторная работа № 8











