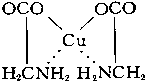Этот вид изомерии вызван неодинаковым размещением лигандов во внутренней сфере относительно друг друга. Необходимым условием геометрической изомерии является наличие во внутренней координационной сфере не менее двух различных лигандов. Геометрическая изомерия проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды. С увеличением числа различных лигандов во внутренней сфере растет число геометрических изомеров.
· 
цис -[CoCl2(NH3)4]+
· 
транс -[CoCl2(NH3)4]+
Оптическая изомерия
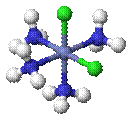
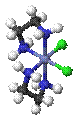
Оптическая изомерия связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга, как левая рука и правая. Поэтому оптическую изомерию называют иногда ещё зеркальной изомерией.
· 
Λ- цис -[CoCl2(en)2]+
· 
Δ- цис -[CoCl2(en)2]+
Структурная изомерия
Гидратная (сольватная) изомерия заключается в различном распределении молекул растворителя между внутренней и внешней сферами комплексного соединения, в различном характере химической связи молекул воды с комплексообразователем. Например: [Cr(H2O)6]Cl3 (фиолетовый), [Cr(H2O)5Cl]Cl2 × H2O (светло-зелёный), [Cr(H2O)4Cl2]Cl × 2H2O (темно-зелёный).
Ионизационная изомерия определяется различным распределением заряженных лигандов между внутренней и внешней сферами комплекса и характеризует способность координационных соединений с одним и тем же элементным составом давать в растворе разные ионы. Примеры соединений: [Co(NH3)5Br]SO4 (красно-фиолетовый), [Co(NH3)5SO4]Br (красный).
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6].
9. Полидентатные лиганды. Хелатирование. Конкуренция за лиганд или за комплексообразователь: изолированное и совмещенное равновесия замещения лигандов.
Особенно эффективное связывание ионов комплексообразователя происходит при реакции с полидентатными (многозубыми) лигандами. Эти лиганды благодаря наличию в них двух и более электронодонорных центров способны образовывать несколько связей с ионами металлов, формируя устойчивую циклическую структуру (т.е. ион металла захватывается полидентатным лигандом подобно жертве, попавшей в клешни рака). В связи с этим такие комплексные соединения получили названия хелатов.
Хелаты - устойчивые комплексы металлов с полидентатными лигандами, в которых центральный атом является компонентом циклической структуры. Простейшими хелатообразующими лигандами. являются бидентатные лиганды, образующие две связи с центральным атомом, например, глицин:
 К нест. =5,6ž10-16
К нест. =5,6ž10-16
Конкуренция за лиганд или за ион-комплексообразователь.
Процессы образования комплексного соединения иона металла с каждым из лигандов являются конкурирующими: преобладающим будет процесс, который приводит к образованию наиболее прочного (т. е. с наименьшей константой нестойкости) комплексного соединения. Заключение о сравнительной прочности комплексных соединений на основании величин констант нестойкости можно делать только для однотипных соединений.
| Конкуренция за лиганд
| Конкуренция за ион-комплексообразователь
|
| Допустим, в растворе в равных концентрациях окажутся ионы Zn2+, Ni2+ и CN-ионы. В этом случае преимущественно образуется тетрацианоникколат- ион, а не тетрацианоцинкат- ион, так как Kнест([Zn(CN)4]2-) > Kнест ([Ni(CN)4]2-). В этом случае объектом конкуренции является цианид-ион, а конкурирующими частицами - ионы цинка и никеля.
| Если смешать вещества таким образом, что в растворе в равных концентрациях окажутся ионы Zn2+, NH3, CN-ионы, то преимущественно образуется тетрацианоцинкат-ион, а не тетраамминцинкат-ион, так как Kнест ([Zn(CN)4] 2-) < Kнест ([Zn(NH3)4]2-). В этом случае объектом конкуренции является ион цинка, а конкурирующими частицами - цианид-ионы и молекулы аммиака, конкуренцию выигрывают цианид-ионы.
|
Нарушения металлолигандного гомеостаза вызывают нарушения процесса обмена веществ, ингибируют активность ферментов, разрушают важные метаболиты, такие, как АТФ, клеточные мембраны, нарушают градиент концентрации ионов в клетках. Поэтому создаются искусственные системы защиты. Должное место в этом методе занимает хелатотерапия (комплексонотерапия).
Хелатотерапия - это выведение токсичных частиц из организма, основанное на хелатировании их комплексонатами s-элементов. Препараты, применяемые для выведения инкорпорированных в организме токсичных частиц, называют детоксикантами (Lg). Хелатирование токсичных частиц комплексонатами металлов (Lg) преобразует токсичные ионы металлов (Мт) в нетоксичные (МтLg) связанные формы, подходящие для изоляции и проникновения через мембраны, транспорта и выведения из организма. Они сохраняют в организме хелатообразующий эффект как по лиганду (комплексону), так и по иону металла. Это обеспечивает металлолигандный гомеостаз организма. Поэтому применение комплексонатов в медицине, животноводстве, растениеводстве обеспечивает детоксикацию организма.
Основные термодинамические принципы хелатотерапии можно сформулировать в двух положениях.
I. Детоксикант (Lg) должен эффективно связывать ионы-токсиканты (Мт, Lт), вновь образующиеся соединения (МтLg) должны быть прочнее, чем те, которые существовали в организме.
II. Детоксикант не должен разрушать жизненно необходимые комплексные соединения (МбLб); соединения, которые могут образовываться при взаимодействии детоксиканта и ионов биометаллов (MбLg), должны быть менее прочными, чем существующие в организме.
Вещества, устраняющие последствия воздействия ядов на биологические структуры и инактивирующие яды посредством химических реакций, называют антидотами.
В настоящее время применяют унитиол:

Этот препарат эффективно выводит из организма мышьяк, ртуть, хром и висмут.
Фосфоросодержащие комплексонаты являются мощными ингибиторами кристаллообразования фосфатов и оксалатов кальция. В качестве антикальцифицирующего препарата при лечении мочекаменной болезни предложен ксидифон - калиево-натриевая соль оксиэтилидендифосфоновая кислота (ОЭДФ). Дифосфонаты, кроме того, в минимальных дозах увеличивают включение кальция в костную ткань, предупреждают патологический выход его из костей. ОЭДФ и другие дифосфонаты предотвращают различные виды остеопороза, включая почечную остеодистрофию, периодентальную деструкцию, также деструкцию пересаженной кости у животных. Описан также антиатеросклеротический эффект ОЭДФ.
В США предложен ряд дифосфонатов, в частности ОЭДФ, в качестве фармацевтических препаратов для лечения человека и животных, страдающих метастазированным раком костей. Регулируя проницаемость мембран, дифосфонаты способствуют транспортировке противоопухолевых лекарств в клетку, а значит, и эффективному лечению различных онкологических заболеваний.
Одной из актуальных проблем современной медицины является задача экспрессной диагностики различных заболеваний. В этом аспекте несомненный интерес представляет новый класс препаратов, содержащих катионы, способные выполнять функции зонда - радиоактивных магниторелаксационных и флюоресцентных меток. В качестве основных компонентов радиофармацевтических препаратов используются радиоизотопы некоторых металлов. Хелатирование катионов этих изотопов комплексонами позволяет повысить их токсикологическую приемлемость для организма, облегчить их транспортировку и обеспечить в известных пределах избирательность концентрации в тех или иных органах.
10. Классы комплексных соединений: внутрикомплексные, макроциклические, многоядерные, сэндвичевые.
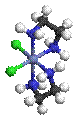
Внутрикомплексные соединения - клешневидные соединения, хелатные соединения, один из классов комплексных соединений. Например, гликоколят меди:
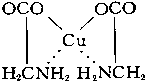
Адденд (радикал гликокола строения NH2CH2COO—) присоединяется к центральному атому (Cu) одновременно двумя функциональными группами. Связь Cu — O ионная, связь Cu — N ковалентная. Центральный атом (Cu) оказывается как бы втянутым внутрь адденда; отсюда и название соединений такого типа. Внутрикомплексные соединения характеризуются малой растворимостью в воде, аномальными окрасками, сильно различающимися для различных ионов металлов, что обеспечило им широкое применение в аналитической химии в качестве высокочувствительных и селективных реактивов. Хорошо известен специальный объёмный метод аналитической химии - комплексонометрия, - основанный на образовании внутрикомплексных соединений различных металлов с многоосновными аминокислотами, в частности с трилоном Б (динатриевой солью этилендиаминтетрауксусной кислоты). Важнейшие природные пигменты — Хлорофилл и Гемоглобин, являются внутрикомплексными соединениями.







 К нест. =5,6ž10-16
К нест. =5,6ž10-16