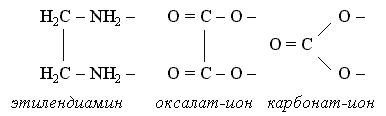Центральный атом (комплексообразователь)
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + n L  [ML n ]
[ML n ]
где M – нейтральный атом, положительно или отрицательно заряженный условный ион, объединяющий (координирующий) вокруг себя другие атомы, ионы или молекулы L. Атом M получил название комплексообразователя или центрального атома.
В комплексных ионах [Cu(NH3)4]2+, [SiF6]2-, [Fe(CN)6]4-, [BF4]- комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III).
Чаще всего комплексообразователем служит атом элемента в положительной степени окисления.
Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота(-III) в катионе аммония [NH4]+ и т.п.
Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO)4] и [Fe(CO)5], содержат атомы никеля(0) и железа(0).
Комплексообразователь (выделен жирно) может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например:
Ag + + 2 NH3  [ Ag (NH3)2]+;
[ Ag (NH3)2]+;
Ag + + 2 CN-  [ Ag (CN)2]-
[ Ag (CN)2]-
так и находясь в составе молекулы:
Si F4 + 2 F- 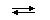 [ Si F6]2-;
[ Si F6]2-;
I 2 + I- 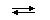 [ I (I)2]-;
[ I (I)2]-;
P H3 + H+ 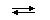 [ P H4]+;
[ P H4]+;
B F3 + NH3 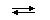 [ B (NH3)F3]
[ B (NH3)F3]
В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах.
Комплексное соединение может включать несколько комплексных ионов, в каждом из которых содержится свой комплексообразователь.
Например, в одноядерном комплексном соединении состава [K(H2O)6][Al(H2O)6](SO4)2 комплексообразователи KI и AlIII, а в [Cu(NH3)4][PtCl6] - CuII и PtIV.
Лиганды
В комплексном ионе или нейтральном комплексе вокруг комплексообразователя координируются ионы, атомы или простые молекулы (L). Все эти частицы, имеющие химические связи с комплексообразователем, называются лигандами (от латинского «ligare» - связывать). В комплексных ионах [SnCl6]2- и [Fe(CN)6]4- лигандами являются ионы Cl- и CN-, а в нейтральном комплексе [Cr(NH3)3(NCS)3] лиганды – молекулы NH3 и ионы NCS-.
Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей.
Лигандами могут быть различные неорганические и органические ионы и молекулы. Важнейшими лигандами являются ионы CN-, F-, Cl-, Br-, I-, NO2-, OH-, SO3S2-, C2O42-, CO32-, молекулы H2O, NH3, CO, карбамида (NH2)2CO, органических соединений – этилендиамина NH2CH2CH2NH2, a-аминоуксусной кислоты NH2CH2COOH и этилендиаминтетрауксусной кислоты (ЭДТА):

и другие.
Дентатность лиганда
Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. Такого рода лиганды получили название монодентатных. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Некоторые распространенные лиганды типа молекул воды H2O, гидроксид-иона OH-, тиоцианат-иона NCS-, амид-иона NH2-, монооксида углерода CO в комплексах преимущественно монодентатны, хотя в отдельных случаях (в мостиковых структурах) становятся бидентатными.
Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными. Это этилендиамин, карбонат-ион, оксалат-ион и т.п. Каждая молекула или ион бидентатного лиганда образует с комплексообразователем две химические связи в соответствии с особенностями своего строения: 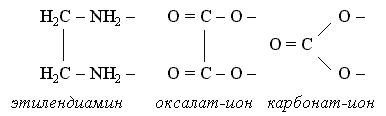
Например, в комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32-- образует две связи с комплексообразователем – условным ионом Co(III), а каждая молекула лиганда NH3 – только одну связь: 

Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты:
Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома.
Координационное число
Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число (КЧ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя.
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа.
Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др.), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. Наиболее распространенными координационными числами являются 4 и 6.
Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная зависимость. Так, для элементов-комплексообразователей, имеющих степень окисления +I (AgI, CuI, AuI, II и др.) наиболее характерно координационное число 2 – например, в комплексах типа [Ag(NH3)2]+, [Cu(CN)2]-, [IBr2]-.
Элементы-комплексообразователи со степенью окисления +II (ZnII, PtII, PdII, CuII и др.) часто образуют комплексы, в которых проявляют координационное число 4, такие как [Zn(NH3)4]2+, [PtCl4]2-, [Pd(NH3)2Cl2]0, [ZnI4]2-, [Cu(NH3)4]2+.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6: [Fe(H2O)6]2+, [Mg(H2O)6]2+, [Ni(H2O)6]2+.
Элементы-комплексообразователи, обладающие степенью окисления +III и +IV (PtIV, AlIII, CoIII, CrIII, FeIII), имеют в комплексах, как правило, КЧ 6.
Например, [Co(NH3)6]3+, [Cr(OH)6]3-, [PtCl6]2-, [AlF6]3-, [Fe(CN)6]3-.
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах [Al(OH)4]- и [Al(H2O)2(OH)4]-.
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9[Bi(NCS)12].



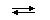 [ML n ]
[ML n ]