Наиболее селективная реакция на фосфаты – образование желтого кристаллического осадка фосфомолибдата аммония:
Na2HPO4 + 12(NH4)2MoO4 + 23 HNO3 = (NH4)3PO4·12MoO3·2H2O$+ 21NH4NO3 + 2NaNO3 + 10H2O
Осадок легко растворим в щелочах и аммиаке. Эта реакция применяется для обнаружения фосфатов в моче.
Выполнение опыта:
К 5-6 каплям нагретой молибденовой жидкости добавляют 1-2 капли раствора Na2HPO4. Дают пробирке немного постоять и наблюдают выпадение осадка. Нагревание и добавление NH4NO3 ускоряют образование осадка.
ОПЫТ 20. Получение гидрофосфата кальция.
Выполнение опыта:
Внести в пробирку по 4-5 капель растворов хлорида кальция и гидрофосфата натрия Na2НРО4. Отметить цвет выпавшего осадка. Написать уравнение реакции в молекулярной и ионной форме.
ОПЫТ 21. Осаждение фосфатов железа и алюминия в присутствии ацетата.
Выполнение опыта:
В две пробирки внести по 3-4 капли растворов солей, в первую - FeCl3, во вторую -Al2(SО4)3. Добавить в каждую из пробирок по 2-3 капли растворов ацетата натрия и гидрофосфата натрия. Отметить цвета выпавших осадков и записать реакции, учитывая, что в растворах буферируемых ацетатом натрия получаются средние фосфаты:
Na2НPО4 + FeCl3 g FePO4 +
A12(SO4)3 + Na2HPO4 + CH3COONa g A1PO4 +...
ОПЫТ 22. Гидролиз ортофосфатов натрия.
Выполнение опыта:
В три пробирки опустить по полоске нейтральной лакмусовой бумаги. Одну пробирку оставить как контрольную, во вторую добавить 3-4 капли фосфата натрия, в третью - столько же дигидрофосфата натрия. Содержимое второй и третьей пробирок тщательно размешать чистыми стеклянными палочками до полного растворения солей.
Отметить окраску лакмуса в пробирках с солями по сравнению с окраской в контрольной пробирке.
Написать уравнение первой ступени гидролиза фосфата натрия в молекулярной и ионной формах.
Аналитическое обнаружение малых количеств мышьяка.
Для аналитического обнаружения малых количеств мышьяка, например при отравлениях в судебно-медицинской экспертизе, пользуются «пробой МАРША». Она заключается в том, что материал, в котором ищут мышьяк (остаток пищи, рвотные массы, содержимое желудка, взятые у пострадавшего) обрабатываются смесью серной и азотной кислот при нагревании для разрушения (окисления) органических веществ. Мышьяк при этом окисляется до Аs5+. После полного окисления и удаления окислов азота, смесь переносят в прибор МАРША, содержащий металлический цинк и серную кислоту (рис 1).
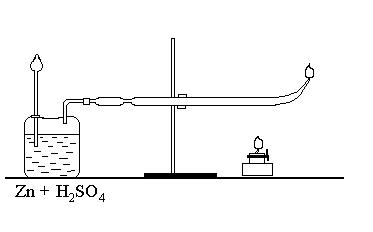
Рисунок 1.
Выделившийся при этом активный водород восстанавливает Аs5+ до образования нестойкого газообразного АsН3 (арсин).
Мышьяковистый водород проходит через отводную трубку прибора, нагреваемую пламенем в определенном месте. В зоне нагрева АsН3 разлагается и дальше в холодной (суженой) части трубки образует бурый налет «мышьякового зеркала».
Н3AsO4 + 4Zn + 4Н2SО4 = 4ZnSО4 + АsН3 + 4Н2О
ТЕМА: «ЭЛЕМЕНТЫ VIА ГРУППЫ»
Элементы главной подгруппы шестой группы периодической системы это кислород, сера, селен, теллур, и полоний. Последний - радиоактивный металл.
Во внешней электронной оболочке атомы рассматриваемых элементов содержат шесть электронов - два на s-орбитали и четыре на р-орбитали.
Атом кислорода отличается от атомов других элементов подгруппы отсутствием d-подуровня во внешнем электронном слое.
Все элементы данной подгруппы, кроме полония, неметаллы, хотя и менее активные, чем галогены. В своих соединениях они проявляют как отрицательную, так и положительную окисленность.
В соединениях с металлами и водородом их степень окисления, как правило, равна -2. В соединениях с неметаллами, например, с кислородом, они могут иметь значение +4 или +6. Исключение при этом составляет сам кислород. По величине электроотрицательности он уступает только фтору, поэтому только в соединении с этим элементом (ОF2) его окисленность положительна (+2). В соединениях со всеми другими элементами степень окисления кислорода отрицательна и равна -2. В пероксиде водорода и его производных она равна -1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ







