Для органических реакций характерны три основных типа: замещение, присоединение, отщепление.
В реакциях замещения одинаковые связи разрываются и образуются у углеродного атома свободная связь. И новая группа замещает уходящую.
Н Н
Н – С Н + Cl Cl ® Н – С – Cl + НCl
Н Н
СН4 + Cl2 ¾® СН3Сl + НCl
В реакциях присоединения, π-связь разрывается и превращается в две σ-связи, к которым присоединяются два заместителя.
 Br Br
Br Br
C C + Br – Br ® C – C
В реакциях отщепления – это по существу реакции, обратные присоединению, т.к. две σ-связи превращаются в π-связь.
СН2 – СН2 + К ОН ¾® СН2 = СН2 + КCl + Н2О
Н Cl
Механизм протекания химических реакций зависит от типа разрыва ковалентной связи. Различают два механизма: гомолитический и гетеролитический. При гомолитическом разрыве связи связующая электронная пара разъединяется и каждый из атомов получает по одному электрону (ē) превращаясь в активную частицу – радикал (R).
 Н
Н
Н: С: Н ¾®¾¾ СН3 · + Н ·
Н
Такой механизм называется радикальным. Эти реакции протекают при t0 > 3000C или при облучении ультрафиолетовым светом. Этому разрыву подвержены неполярные С – С; N – N и др. или малополярные связи С – Н и др.
При гетеролитическом разрыве связи связующая электронная пара полностью переходит к более электроотрицательному атому, заряжая его отрицательно, а второй атом, отдав ē (электрон) заряжается положительно.
 Н
Н
Н: С: Cl ¾® СН+3 + Cl–
Н
Положительно заряженная частица называется электрофилом, а отрицательно заряженная частица (или группа атомов) называется нуклеофилом. Если к атому углерода подходит электрофильная частица, то механизм называется электрофильный, если нуклеофильная – то нуклеофильный.
Такие реакции протекают в растворе или на поверхности катализатора. Электрофильная частица – это положительно заряженные ионы Н+; Al3+; Fe3+ и т.д. N – нуклеофильная частица – это отрицательно заряженные частицы молекул Н2О; NH3; Cl–; CN–, в которых один из атомов имеет неподеленные пары электронов. Гетеролитическому разрыву подвержены полярные связи (π).
1.8 Обучающее задание №1
Напишите электронные и графические формулы фосфора и серы. Определите возможные степени окисления. Приведите примеры веществ.
Решение: Фосфор находится в 3м периоде таблицы Д.И. Менделеева, следовательно n = 3, l = 0, 1, 2 – подуровни s, p, d. Напишем электронную формулу: 1s22s22p63s23p3 и графическую:













 n = 3
n = 3

Т.к. у фосфора d-подуровень свободен, то атом способен возбуждаться.
 n=3 электронная формула
n=3 электронная формула
1s22s22p63s13p33d,В= 5 (H3PO4,
P2O5)
Обучающее задание №2
Напишите электронные формулы: катионов Na+, Ca2+, анионов F-, S2-.
Решение: Катион Na+ - частица, отдавшая один электрон. Электронная формула атома Na - 1s22s22p63s, отдав один электрон с 3s-подуровня, формула иона Na+ будет 1s22s22p6. Атом Ca, отдав два электрона, дает формулу иона Ca2+ 1s22s22p63s23p6. Атом F, принимая один электрон, образует ион F- с электронной формулой 1s22s22p6, а у S2- формула будет 1s22s22p63s23p6.
Обучающая задача №3
Почему фтор в отличие от хлора имеет степень окисления -1 хлор различные степени окисления? Напишите электронные и графические формулы строения указанных атомов.
Решение: Вначале пишем электронную и графическую формулы атома фтора: 1s22s22p5.
 n = 2 В = 1
n = 2 В = 1
n = 1
В отличие от хлора, у фтора нет свободных квантовых ячеек, и он не может возбуждаться. Электронная формула атома хлора 1s22s22p63s23p5.
 Графическая формула третьего периода:
Графическая формула третьего периода:
У хлора есть свободные квантовые ячейки, и он способен возбуждаться, т.е. происходит распаривание электронных пар.
Первое возбуждение: 1s22s22p63s23p43d1
 Второе валентное состояние: 1s22s22p63s23p33d2
Второе валентное состояние: 1s22s22p63s23p33d2
 Третье валентное состояние: 1s22s22p63s3p33d3
Третье валентное состояние: 1s22s22p63s3p33d3
Обучающее задание 4.
Охарактеризуйте соединение:
СН3 – СН = СН2
Решение: Это соединение ациклическое (жирного ряда) неразветвленное, непредельное (ненасыщенное) относится к классу углеводородов.
Обучающее задание 5.
Охарактеризуйте соединение:
 СН3 – СН – СН2 – СН3
СН3 – СН – СН2 – СН3
СН3
Решение: Это соединение ациклическое (жирного ряда) разветвленное, предельное (насыщенное) относится к классу углеводородов (алканов).
 Обучающее задание 6.
Обучающее задание 6.
Охарактеризуйте соединение:
Решение: Это галогенопроизводное, циклическое, ароматическое, непредельное (ненасыщенное) содержит функциональную группу Cl.
Обучающее задание 7.
Какой тип и механизм реакций характерен для соединения СН3 – СН3?
Решение: Так как данное соединений содержит только σ-связи, т.е. является предельным, для него характерны реакции замещения или отщепления и протекают по радикальному механизму.
Обучающее задание 8.
Какой тип реакции характерен для СН2=СН2?
Решение: Это соединение содержит π-связь и является непредельным, поэтому для него характерны реакции присоединения по месту разрыва π-связи с образованием 2х σ-связи. При обычных условиях механизм реакций электрофильный, так как к подвижным р-электронам, образующим π-связь подходит электрофильная (+) частица.
 СН2 СН2 + Н – ОН ® СН3 – СН2ОН
СН2 СН2 + Н – ОН ® СН3 – СН2ОН
1.9 Вопросы для самоконтроля
1. Что изучает органическая химия?
2. Особые свойства атома углерода в органических соединениях.
3. Основные положение теории химического строения А.М. Бутлерова.
4. Изомерия структурная и пространственная.
5. Оптическая изомерия.
6. Электронное строение атома.
7. Главное, орбитальное, квантовые числа. Какие значения могут иметь?
8. Как определяется число электронов на уровне, подуровне?
9. Магнитное и спиновое квантовые числа. Какие значения могут принимать?
10. Принцип Паули. Правило Гунда и В. Клечковского.
11. В какой последовательности будут заполняться подуровни 2s, 3d, 4s.
12. Напишите электронные и графические формулы атомов N и O.
13. Напишите электронные и графические формулы атомов S в невозбужденном и возбужденном состояниях, определите валентность.
14. Какие элементы имеют электронные конфигурации:
а) 1s22s22p63s23p4; б) 1s22s22p63s; в) 1s22s22p63s23p2;
г)1s22s22p63s23p64s; д) 1s22s22p63s23p64s2;
е) 1s22s22p63s23p64s23d9.
15. Атом какого элемента имеет электронную формулу1s22s22p63s23p64s23d5. Определите номер периода, номер группы и максимальную степень окисления.
16. Могут ли электроны иона К+ находиться на следующих орбиталях: а) 3p, б) 4f, в) 4s?
17. Напишите электронную формулу элемента, атом которого содержит на 3d-подуровне три электрона. В каком периоде, группе и подгруппе он находится и как называется?
18. Какие валентные состояния имеет атом углерода?
19. Что такое sp3-гибридизация? Какие связи при этом образуются?
20. Что такое sp2-гибридизация? Для каких соединений она характерна? Какие связи при этом образуются?
21. sp-гибридизация, определение этого состояния. Для каких соединений она характерна? Какие связи при этом образуются?
22. Дать определение δ-связи и π-связи.
23. Что представляют собой двойные и тройные связи?
24. Как классифицируются органические соединения по углеводородному скелету?
25. Какие соединения называются алифатическими?
26. Какие соединения называются гетероциклическими?
27. Какие соединения называются циклическими?
28. Какие соединения называются ароматическими?
29. Какие соединения называются предельными?
30. Какие соединения называются непредельными?
31. Какие типы реакций вам известны?
32. Охарактеризуйте реакции:
- присоединения;
- отщепления;
- замещения.
33. В чем заключается сущность гомолитического разрыва связи?
34. Почему гомолитический разрыв связи называется радикальным и какие связи ему подвержены?
35. В чем заключается механизм разрыва связи при гетеролитическом разрыве?
36. Какие заряды несут: электрофильная, нуклеофильная частицы
37. Приведите примеры электрофильных и нуклеофильных частиц.
1.10 Контрольное задание 1
| В каких из указанных соединений
|
| 1) не содержится кратной связи
2) содержится кратная связь
3) атом С находится в состоянии sp3 – гибридизации
4) атом С находится в состоянии sp2 – гибридизации
5) атом С находится в состоянии sp – гибридизации
| а) СН3 – С ≡ С – СН3
б) СН3 – СН = СН2
в) СН3 – СН2 – СН2 – СН3
г) СН4
 д) СН3 – С = СН2
СН3
е) СН ≡ С – СН2 – СН3
ж) C6H6 д) СН3 – С = СН2
СН3
е) СН ≡ С – СН2 – СН3
ж) C6H6
  з) Н2С – СН2
Н2С–СН2 з) Н2С – СН2
Н2С–СН2
|
Контрольное задание 2
| Какие из указанных соединений:
|
| А. содержат одну π-связь
Б. содержат две π-связи
В. не содержат π-связи
Г. содержат атом С, находящийся в первом валентном состоянии
Д. Содержат атом С, находящийя во втором валентном состоянии
Е. Содержат атом С. находящийся в 3м валентном состоянии
| 1) СН3 – СН2 – СН3
2) СН3 – СН = СН – СН3
3) СН2 = СН – СН = СН2
4) СН3 – СН3
5) СН ≡ С – СН3
6) СН2=СН–СН2–СН2–СН3
 7)
8) С2Н5 – С ≡ С – С2Н5 7)
8) С2Н5 – С ≡ С – С2Н5
|
Контрольное задание 3
| В каких соединениях:
|
| А. атом С находится в состоянии sp – гибридизации
Б. содержатся кратные связи
В. содержатся две π-связи
Г. содержится только σ-связь
Д. атом С находится в sp3 – гибридизации
Е. атом С находится в sp2 – гибридизации
Ж. атом углерода четырехвалентен
|  1) СН3 – СН – СН3
СН3 1) СН3 – СН – СН3
СН3
 2)
3) СН3 – С ≡ С – СН3 2)
3) СН3 – С ≡ С – СН3
  4) Н2С–СН2
Н2С–СН2
5) СН2 = СН – СН3
6) СН3 – СН2 – СН2 – СН3
7) СН3 – (СН2)2 – С ≡ СН 4) Н2С–СН2
Н2С–СН2
5) СН2 = СН – СН3
6) СН3 – СН2 – СН2 – СН3
7) СН3 – (СН2)2 – С ≡ СН
|
Контрольное задание 4
| Какое из указанных соединений:
|
| 1) предельное
2) непредельное
3) циклическое
4) ациклическое
5) разветвленное
6) неразветвленное
7) ароматическое
8) гетероциклическое
9) ароматический углеводород
10) ароматический амин
11) ненасыщенный углеводород
12) насыщенный углеводород
| а) СН3 – С6Н5
б) СН3 – С ≡ СН
в) СН3 – СН2 – СН3
 г) СН3 – С = СН2
СН3 г) СН3 – С = СН2
СН3
  д) Н2С – СН2
Н2С – СН2
е) С6Н5 – NH2 д) Н2С – СН2
Н2С – СН2
е) С6Н5 – NH2
 ж)
з) С2Н5 – NO2 ж)
з) С2Н5 – NO2
|
Контрольное задание 5
| Для каких соединений наиболее характерны:
|
| 1) реакции отщепления
2) реакции присоединения
3) реакции замещения
4) нуклеофильные реакции
5) радикальные реакции
6) электрофильные реакции
| а) СН2 = СН – СН3
б) СН ≡ СН
в) СН3 – СН2Br
г) СН3 – СН2 – СН3
д) СН3 – СН2 – ОН
е) СН3 – С6Н5
ж) СН3 – С ≡ С – СН2
з) С6Н5ОН
к) С8Н18
|
1.11 Взаимное влияние атомов в органических соединениях.
Одним из основных положений теории А.М. Бутлерова является взаимное влияние атомов в молекулах органических веществ. Особенно сильно это влияние оказывают атомы непосредственно связанные друг с другом, что приводит к перераспределению электронной плотности. Природа этого явления различная и зависит:
- от свойства гетероатома, его электроотрицательности (ЭО);
- от типа связи. по которым это влияние распространятся.
Существует два вида электронных смещений:
- смещение электронной плотности в простых σ-связях (индуктивный эффект);
- смещение электронной плотности по сопряженной системе (мезомерный эффект).
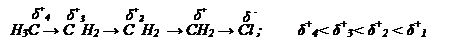 Индуктивный эффект. При образовании σ-связи между атомами с различной ЭО электронная плотность в молекуле смещается в сторону более электроотрицательного атома. Это вызывает поляризацию молекулы и образование частичных зарядов (δ+; δ-). Например, введение в молекулу бутана хлора (Сl) приводит к поляризации молекулы, так как ЭО(Сl)>ЭО(С) и поляризации σ-связей.
Индуктивный эффект. При образовании σ-связи между атомами с различной ЭО электронная плотность в молекуле смещается в сторону более электроотрицательного атома. Это вызывает поляризацию молекулы и образование частичных зарядов (δ+; δ-). Например, введение в молекулу бутана хлора (Сl) приводит к поляризации молекулы, так как ЭО(Сl)>ЭО(С) и поляризации σ-связей.
Смещение электронной плотности по σ-связям от одного атома к другому вследствие разной ЭО называют индуктивной поляризацией или индуктивным эффектом (J-эффект).
Графически действие J-эффекта изображают стрелкой, направленной в сторону более электроотрицательного атома
СН3 → СН2 → Сl. Этот J-эффект передается по цепи σ-связей с постепенным затуханием и, как правило, через три- четыре связи он затухает. J-эффект обусловлен стремлением атома или группы атомов подавать или оттягивать на себя электронную плотность. В основе оценки J-эффекта (+J; -J) лежит электроотрицательность элементов, в качестве стандарта служит атом водорода, индуктивный эффект которого равен нулю.
 Заместитель, притягивающий электронную плотность
Заместитель, притягивающий электронную плотность
σ-связей сильнее чем атом водорода, проявляет отрицательный
(-J-эффект). Такие заместители называют э лектроно-акцепторными. Они снижают электронную плотность системы. Заместители с -J-эффектом:
Атомы углерода в состоянии sp- и sp2 – гибридизации более электроотрицательны, чем sp3-гибридизованные углеродные атомы. Поэтому все ненасыщенные группы проявляют (–J эффект).
-С ≡ СН > -С6Н5 > -СН = СН2 > -Н
Отрицательный индуктивный эффект (-Jэф) атомов и атомных групп определяется их ЭО. С увеличением ЭО усиливается индукционное влияние заместителей. Например, чем более электроотрицательным элементом является заместитель, тем сильнее должна стать кислота, что и наблюдается:
Н2СF–СООН > Н2ССl – СООН > СН2Br – СООН > СН2J–СООН > СН3СООН
Накопление электроотрицательных элементов приводит к возрастанию (–J эффекта).
СF3 – СООН > СНF2 – СООН > СН2F – СООН
Удаление заместителя вызывающего (–Jэф) от группы
(-СООН) приводит к его снижению:
СН3–СН2–СНСl–СООН > СН3–СНСl–СН2–СООН > СН2Сl–СН2–СН2 – СООН
Заместитель, смещающий электронную плотность σ-связей в сторону атома углерода цепи, проявляет положительный индуктивный эффект (+J). Такие заместители отталкивают от себя электроны в связях с углеродом, повышают электронную плотность в цепи и называются электронодонорными.
К ним относятся метильные, этильные группы и т.д., металлы, анионы. Наибольшим +J-эффектом обладают третичные радикалы, затем вторичные и наименьшим – первичные.
(СН3)3С- > (СН3)2СН- > СН3 – СН2- > СН3- > Н
 Мезомерный эффект (Мэф) – передача электронного влияния заместителей по сопряженной системе (π-системе). При этом заместитель сам является участником сопряженной системы. Он может вносить в систему
Мезомерный эффект (Мэф) – передача электронного влияния заместителей по сопряженной системе (π-системе). При этом заместитель сам является участником сопряженной системы. Он может вносить в систему
 сопряжения π-связь, неподеленную пару электронов гетероатома (галогены, амино- и гидрооксигруппы и т.д.). Например, в бутадиене-1,3 (СН2=СН–СН=СН2) роль заместителя играет вторая (С=С) связь. Здесь электронное облако равномерно распределено по всей молекуле.
сопряжения π-связь, неподеленную пару электронов гетероатома (галогены, амино- и гидрооксигруппы и т.д.). Например, в бутадиене-1,3 (СН2=СН–СН=СН2) роль заместителя играет вторая (С=С) связь. Здесь электронное облако равномерно распределено по всей молекуле.
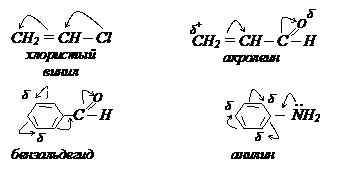 В непредельном альдегиде роль заместителя выполняет группа С=О. Здесь электронная плотность смещена в сторону более отрицательного атома кислорода. Это смещение обычно изображается частичными зарядами δ+ и δ- и изогнутыми стрелками, указывающими к каким атомам электронная плотность смещается. Например:
В непредельном альдегиде роль заместителя выполняет группа С=О. Здесь электронная плотность смещена в сторону более отрицательного атома кислорода. Это смещение обычно изображается частичными зарядами δ+ и δ- и изогнутыми стрелками, указывающими к каким атомам электронная плотность смещается. Например:
 Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М-эф.). Как правило это атомы с неподеленной парой электронов или целым отрицательным зарядом, т.е. являются электродонорами. Заместители с +М-эффектом:
Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М-эф.). Как правило это атомы с неподеленной парой электронов или целым отрицательным зарядом, т.е. являются электродонорами. Заместители с +М-эффектом:
Заместители, понижающие электронную плотность в сопряженной системе, проявляют отрицательный мезомерный эффект (-М-эф), т.е. электроноакцепторные заместители. К ним относятся ненасыщенные группы и положительно заряженные атомы.



О OH
В них обязательно присутствие кратной связи. Мезомерный эффект передается по цепи сопряженных связей без ослабления. Мезомерный эффект атомов или группы атомов может совпадать с J-эффектом, но может иметь и противоположный знак. Например, атом хлора обладает (-Jэф.) и (+Мэф.).
Электронные эффектозаместители.
| Заместитель
| Jэф
| Мэф
| Суммарное электронное действие заместителя сопряженной системы
|
| Алкильные радикалы (-СН3; -С2Н5 и т.д.)
| +J
| -
| электронодоноры
|
| -NН2; -NНR; -NR2; -ОН; -ОR
| -J
| +M
| электронодоноры
|
 Галогены (F; Сl; Br; J) Галогены (F; Сl; Br; J)
| -J
| +M
| электроноакцепторы
|
|
| -J
| -M
| электроноакцепторы
|
Если рассматривается распределение электронной плотности в нереагирующих молекулах, то это называется статистическим эффектом сопряжения. Если распределение электронной плотности происходит в процессе протекания реакций – называется динамическим эффектом сопряжения. Оба эти эффекта сказываются на свойствах и реакционной способности органических соединений, условиях и направлениях протекания реакций, а особенно динамический эффект. Например, рассмотрим присоединение НХ соединения к несимметрично построенным алкенам, которое определяется правилом Марковникова (1869 г.) и может быть объяснено с точки зрения электронной теории органических реакций.
Рассмотрим статическое распределение электронной плотности в молекуле пропилена
 π-электроны очень подвижны, поэтому смещение
π-электроны очень подвижны, поэтому смещение
σ-электронов вдоль простых связей вызывает поляризацию (=) связи.
 Электрофильному протону легче присоединиться к атому углерода несущему заряду (δ-) – наиболее гидрогенизированному атому углерода.
Электрофильному протону легче присоединиться к атому углерода несущему заряду (δ-) – наиболее гидрогенизированному атому углерода.
 Нуклеофильная частица направляется к атому углерода несущему заряд (δ+) – наименее гидрогенизированному атому углерода.
Нуклеофильная частица направляется к атому углерода несущему заряд (δ+) – наименее гидрогенизированному атому углерода.
 Рассмотрим динамические факторы. Сравним устойчивость образующихся карбкатионов. В реакции возможно образование двух карбкатионов.
Рассмотрим динамические факторы. Сравним устойчивость образующихся карбкатионов. В реакции возможно образование двух карбкатионов.
 В карбкатионе (I) заряд (δ+) на центральном углеродном атоме частично гасится двумя группами СН3, имеющими +J-эффект. В карбкатионе (II) нескомпенсированный заряд (δ+) будет больше, чем в карбкатионе (I), так как погашен только одним радикалом С2Н5. Следовательно, более устойчивым является карбкатион
В карбкатионе (I) заряд (δ+) на центральном углеродном атоме частично гасится двумя группами СН3, имеющими +J-эффект. В карбкатионе (II) нескомпенсированный заряд (δ+) будет больше, чем в карбкатионе (I), так как погашен только одним радикалом С2Н5. Следовательно, более устойчивым является карбкатион
Реакция (I) будет протекать через его образование, что соответствует правилу Марковникова.
Правило Марковникова соблюдается только при ионном электрофильном механизме присоединения. Но если вести реакцию в присутствии Н2О2 она протекает по радикальному механизму и против правила Марковникова (эффект Караша).
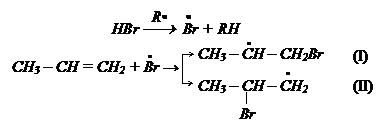
 Радикал атакует наиболее доступный (крайний) атом углерода.
Радикал атакует наиболее доступный (крайний) атом углерода.
Кислотные свойства спиртов выражены слабее, чем у воды, из-за +J-эффекта алкильных групп, отталкивающих от себя электроны и несколько снижающих поляризацияю связи кислород – водород (О – Н).
Н – О – Н R → О – Н
Если же в радикал спирта внести электроноакцепторный атом, то кислотные свойства усиливаются, например:
Этот спирт является кислотой и более сильной, чем угольная кислота.
В альдегидах и кетонах карбонильная группа обладает наибольшей реакционной способностью, которая основывается на полярности этой группы, в результате поляризуемости (=) cвязи и (-Jэф) кислорода. Характер реакций, в которые вступают карбонильные соединения, связан с тремя имеющимися реакционными центрами.
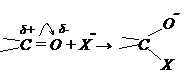 1. Углеродный атом карбонильной группы несет δ+ и способен реагировать с нуклеофильными (-) реагентами:
1. Углеродный атом карбонильной группы несет δ+ и способен реагировать с нуклеофильными (-) реагентами:
 и чем больше δ+ на углеродном атоме, тем это соединение активнее. Карбонильные соединения можно расположить в ряд по их активности:
и чем больше δ+ на углеродном атоме, тем это соединение активнее. Карбонильные соединения можно расположить в ряд по их активности:
 2. Второй активный центр карбонильной группы – кислород (Оδ–). Он способен взаимодействовать с электрофильными реагентами (+) частицами, в первую очередь присоединять протон Н+. Такое присоединение усиливает положительный заряд на углеродном атоме карбонильной группы.
2. Второй активный центр карбонильной группы – кислород (Оδ–). Он способен взаимодействовать с электрофильными реагентами (+) частицами, в первую очередь присоединять протон Н+. Такое присоединение усиливает положительный заряд на углеродном атоме карбонильной группы.
3. Третий центр – подвижные атомы водорода, находящиеся в α-положении к карбонильной группе.
 Под влиянием (–Jэф) карбонильной группы повышается полярность связи С – Н в α-положении к карбонильной группе и α-водородные атомы способоны отщепляться в виде протона под действием основания. Оставшаяся после этого часть молекулы карбонильного соединения приобретает характер аниона и сама может вступать в роли нуклеофильного реагента.
Под влиянием (–Jэф) карбонильной группы повышается полярность связи С – Н в α-положении к карбонильной группе и α-водородные атомы способоны отщепляться в виде протона под действием основания. Оставшаяся после этого часть молекулы карбонильного соединения приобретает характер аниона и сама может вступать в роли нуклеофильного реагента.
Образовавшийся анион в значительной степени стабилизирован за счет сопряжения электронной пары, оставшейся после отщепления протона, с двойной связью карбонильной группы.

Вывод. Альдегиды активнее кетонов. Понижение активности у кетонов объясняется меньшей поляризацией их карбонильной группы. Наличие у кетонов алкильного радикала с (+Jэф) приводит к понижению δ+ на углеродном атоме карбонильной группы и уменьшает его активность в реакциях с полярными реагентами.




 Br Br
Br Br
 Н
Н Н
Н









 n = 3
n = 3
 n=3 электронная формула
n=3 электронная формула n = 2 В = 1
n = 2 В = 1 Графическая формула третьего периода:
Графическая формула третьего периода: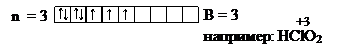
 Второе валентное состояние: 1s22s22p63s23p33d2
Второе валентное состояние: 1s22s22p63s23p33d2 Третье валентное состояние: 1s22s22p63s3p33d3
Третье валентное состояние: 1s22s22p63s3p33d3 СН3 – СН – СН2 – СН3
СН3 – СН – СН2 – СН3 Обучающее задание 6.
Обучающее задание 6. СН2 СН2 + Н – ОН ® СН3 – СН2ОН
СН2 СН2 + Н – ОН ® СН3 – СН2ОН д) СН3 – С = СН2
СН3
е) СН ≡ С – СН2 – СН3
ж) C6H6
д) СН3 – С = СН2
СН3
е) СН ≡ С – СН2 – СН3
ж) C6H6

 з) Н2С – СН2
Н2С–СН2
з) Н2С – СН2
Н2С–СН2
 7)
8) С2Н5 – С ≡ С – С2Н5
7)
8) С2Н5 – С ≡ С – С2Н5
 1) СН3 – СН – СН3
СН3
1) СН3 – СН – СН3
СН3
 2)
3) СН3 – С ≡ С – СН3
2)
3) СН3 – С ≡ С – СН3

 ж)
з) С2Н5 – NO2
ж)
з) С2Н5 – NO2
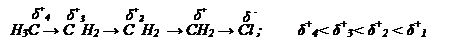 Индуктивный эффект. При образовании σ-связи между атомами с различной ЭО электронная плотность в молекуле смещается в сторону более электроотрицательного атома. Это вызывает поляризацию молекулы и образование частичных зарядов (δ+; δ-). Например, введение в молекулу бутана хлора (Сl) приводит к поляризации молекулы, так как ЭО(Сl)>ЭО(С) и поляризации σ-связей.
Индуктивный эффект. При образовании σ-связи между атомами с различной ЭО электронная плотность в молекуле смещается в сторону более электроотрицательного атома. Это вызывает поляризацию молекулы и образование частичных зарядов (δ+; δ-). Например, введение в молекулу бутана хлора (Сl) приводит к поляризации молекулы, так как ЭО(Сl)>ЭО(С) и поляризации σ-связей. Заместитель, притягивающий электронную плотность
Заместитель, притягивающий электронную плотность  Мезомерный эффект (Мэф) – передача электронного влияния заместителей по сопряженной системе (π-системе). При этом заместитель сам является участником сопряженной системы. Он может вносить в систему
Мезомерный эффект (Мэф) – передача электронного влияния заместителей по сопряженной системе (π-системе). При этом заместитель сам является участником сопряженной системы. Он может вносить в систему сопряжения π-связь, неподеленную пару электронов гетероатома (галогены, амино- и гидрооксигруппы и т.д.). Например, в бутадиене-1,3 (СН2=СН–СН=СН2) роль заместителя играет вторая (С=С) связь. Здесь электронное облако равномерно распределено по всей молекуле.
сопряжения π-связь, неподеленную пару электронов гетероатома (галогены, амино- и гидрооксигруппы и т.д.). Например, в бутадиене-1,3 (СН2=СН–СН=СН2) роль заместителя играет вторая (С=С) связь. Здесь электронное облако равномерно распределено по всей молекуле. В непредельном альдегиде роль заместителя выполняет группа С=О. Здесь электронная плотность смещена в сторону более отрицательного атома кислорода. Это смещение обычно изображается частичными зарядами δ+ и δ- и изогнутыми стрелками, указывающими к каким атомам электронная плотность смещается. Например:
В непредельном альдегиде роль заместителя выполняет группа С=О. Здесь электронная плотность смещена в сторону более отрицательного атома кислорода. Это смещение обычно изображается частичными зарядами δ+ и δ- и изогнутыми стрелками, указывающими к каким атомам электронная плотность смещается. Например: Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М-эф.). Как правило это атомы с неподеленной парой электронов или целым отрицательным зарядом, т.е. являются электродонорами. Заместители с +М-эффектом:
Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М-эф.). Как правило это атомы с неподеленной парой электронов или целым отрицательным зарядом, т.е. являются электродонорами. Заместители с +М-эффектом:


 Галогены (F; Сl; Br; J)
Галогены (F; Сl; Br; J)


 π-электроны очень подвижны, поэтому смещение
π-электроны очень подвижны, поэтому смещение  Электрофильному протону легче присоединиться к атому углерода несущему заряду (δ-) – наиболее гидрогенизированному атому углерода.
Электрофильному протону легче присоединиться к атому углерода несущему заряду (δ-) – наиболее гидрогенизированному атому углерода. Нуклеофильная частица направляется к атому углерода несущему заряд (δ+) – наименее гидрогенизированному атому углерода.
Нуклеофильная частица направляется к атому углерода несущему заряд (δ+) – наименее гидрогенизированному атому углерода. Рассмотрим динамические факторы. Сравним устойчивость образующихся карбкатионов. В реакции возможно образование двух карбкатионов.
Рассмотрим динамические факторы. Сравним устойчивость образующихся карбкатионов. В реакции возможно образование двух карбкатионов. В карбкатионе (I) заряд (δ+) на центральном углеродном атоме частично гасится двумя группами СН3, имеющими +J-эффект. В карбкатионе (II) нескомпенсированный заряд (δ+) будет больше, чем в карбкатионе (I), так как погашен только одним радикалом С2Н5. Следовательно, более устойчивым является карбкатион
В карбкатионе (I) заряд (δ+) на центральном углеродном атоме частично гасится двумя группами СН3, имеющими +J-эффект. В карбкатионе (II) нескомпенсированный заряд (δ+) будет больше, чем в карбкатионе (I), так как погашен только одним радикалом С2Н5. Следовательно, более устойчивым является карбкатион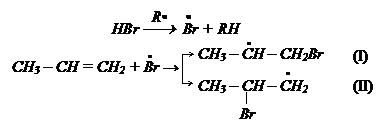
 Радикал атакует наиболее доступный (крайний) атом углерода.
Радикал атакует наиболее доступный (крайний) атом углерода.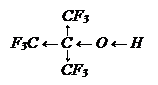
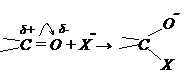 1. Углеродный атом карбонильной группы несет δ+ и способен реагировать с нуклеофильными (-) реагентами:
1. Углеродный атом карбонильной группы несет δ+ и способен реагировать с нуклеофильными (-) реагентами: и чем больше δ+ на углеродном атоме, тем это соединение активнее. Карбонильные соединения можно расположить в ряд по их активности:
и чем больше δ+ на углеродном атоме, тем это соединение активнее. Карбонильные соединения можно расположить в ряд по их активности: 2. Второй активный центр карбонильной группы – кислород (Оδ–). Он способен взаимодействовать с электрофильными реагентами (+) частицами, в первую очередь присоединять протон Н+. Такое присоединение усиливает положительный заряд на углеродном атоме карбонильной группы.
2. Второй активный центр карбонильной группы – кислород (Оδ–). Он способен взаимодействовать с электрофильными реагентами (+) частицами, в первую очередь присоединять протон Н+. Такое присоединение усиливает положительный заряд на углеродном атоме карбонильной группы.
 Под влиянием (–Jэф) карбонильной группы повышается полярность связи С – Н в α-положении к карбонильной группе и α-водородные атомы способоны отщепляться в виде протона под действием основания. Оставшаяся после этого часть молекулы карбонильного соединения приобретает характер аниона и сама может вступать в роли нуклеофильного реагента.
Под влиянием (–Jэф) карбонильной группы повышается полярность связи С – Н в α-положении к карбонильной группе и α-водородные атомы способоны отщепляться в виде протона под действием основания. Оставшаяся после этого часть молекулы карбонильного соединения приобретает характер аниона и сама может вступать в роли нуклеофильного реагента.



