СН2 = СН2 этилен
СН3 – СН = СН2 пропилен
СН3 – СН2 – СН = СН2 бутилен и т.д.
Строение. Атомы углерода в алкенах, связанных (=) связью, находятся в состоянии sp2-гибридизации. Валентный угол 1200, длина связи – 0,133 нм.
Структурная изомерия. возможна для алкенов, начиная с бутилена. Напишем все возможные изомеры состава С4Н8. В начале пишем углеродный скелет нормального строения:
С – С – С – С
Затем от первого С атома пишем (=) связь, С = С – С – С и продолжаем ее передвигать по цепочке пишем от второго С атома
С – С = С – С
Так как счет С атомов ведется с любого конца, то располагая (=) связь от 3 го С атома, это будет то же, что и от 1 го углеродного атома, только справа. Значит начинаем разветвлять углеродную цепь, переставляя (=) связь.
С = С – С; С – С = С
С С
Это один и тот же изомер. Поэтому для С4Н8 возможны три изомера:
1) СН2 = СН – СН2 – СН3
2) СН3 – СН = СН – СН3
3) СН2 = С – СН3

СН3
Итак: структурная изомерия алкенов обусловлена расположением (=) связи и строением углеродного скелета.
4.2 Пространственная изомерия. (Цис–транс–изомерия. Геометрическая изомерия) обусловлена расположением заместителей по отношению к плоскости (=) связи. Рассмотрим на примере бутена–2 СН3 – СН = СН – СН3.

Н Н Н СН3

 С = С С = С
С = С С = С
СН3 СН3 СН3 Н
цис-бутен-2 транс-бутен-2
(т.пл. +139,30С) (т.пл. –105,80С)
Если одинаковые заместители расположены по одну сторону плоскости (=) связи, то это будет цис-изомер, если по разные стороны – транс-изомер. Эта изомерия возможна для тех алкенов, у которых при каждом С атоме, связанных (=) связью, находятся разные заместители.
4.3 Способы получения алкенов. Промышленные способы.
а) крекинг алканов:
С8Н18 ¾®¾ С4Н10 + С4Н8
алкан алкен
б) дегидрирование алканов:
СН3 – СН3 ¾®¾ СН2 = СН2 + Н2
Лабораторные способы.
а) дегидратация спиртов (отщепление Н2О):
С Н 3 – СН2 ОН ¾® СН2 = СН2 + Н2О

 СН3 – СОН – СН2 – СН3 ¾® СН3 – С = СН – СН3 + Н2О
СН3 – СОН – СН2 – СН3 ¾® СН3 – С = СН – СН3 + Н2О
СН3 СН3
Отщепление Н2О осуществляется по правилу А.М. Зайцева: легче отщепляется водородный атом от углеродного атома, рядом стоящего с С атомом с группой ОН, у которого меньше атомов Н.
б) Действие спиртового раствора щелочи на моногалогенопроизводные:
СН3 – СН2Cl + КОН ¾® СН2 = СН2 + КCl + Н2О
Эта реакция также протекает по правилу А.М. Зайцева.
в) Действием цинковой пыли или Mg на дигалогенопроизводные:
СН2Cl – СН2Cl + Zn ¾® СН2 = СН2 + ZnCl2
г) Гидрированием алкинов
СН СН + Н2  СН2 = СН2
СН2 = СН2
4.4 Физические свойства. Первые три члена гомологического ряда алкенов – газы, от С5 до С17 – жидкости, с С18 – твердые вещества. Алкены с нормальной углеродной цепью строения кипят при более высокой температуре, чем изостроения. Температура кипения цис-изомеров выше, чем транс-изомеров, а температура плавления – наоборот. Алкены имеют плотность меньше единицы, обладают характерным запахом, плохо растворимы в воде, хорошо – в органических растворителях.
Физические свойства некоторых алкенов Таблица №3
| Алкен
| Формула
| tпл. 0С
| tкип. 0С
| d204
|
| Этилен
| C2H4
| -169,1
| -103,7
| 0,5700
|
| Пропилен
| C3H6
| -187,6
| -47,7
| 0,5193*
|
| Бутен-1
| CH2 = CH-CH2 –CH3
| -185,3
| -6,3
| 0,5951
|
| Цис-бутен-2
| Н Н
С = С
СН3 СН3
| -138,9
| 3,7
| 0,6213
|
| Транс-бутен-2
| Н СН3
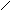  С = С С = С
СН3 Н
| -105,5
| 0,9
| 0,6042
|
| Изобутилен (2-метилпропен)
|  СН2 = С – CH3
CH3 СН2 = С – CH3
CH3
| -140,4
| -7
| 0,6260
|
| Пентен-1
| СН2=СН–(CH2)2 –CH3
| -165,2
| +30,1
| 0,6400
|
*жидкий
4.5 Химические свойства алкенов. Для алкенов наиболее характерны реакции электрофильного присоединения. Механизм.
Имеем реагент НХ, который распадается на частицы:
 НХ Н+ + Х-
НХ Н+ + Х-
Н+ - электрофильная частица
Х- - нуклеофильная частица
Имеем любой алкен, к р-электронам двойной связи подходит электрофильная частица (Н+).

Затем эта частица образует с одним из С атомов σ-связь, на образование которой идет два электрона (ē). Один ē отдает соседний С атом и частица заряжается положительно, получается карбкатион, который взаимодействует с Х- образует конечный продукт реакции.
На основе данного механизма пишутся уравнения реакций.
 1) Гидрирование (+Н2)
1) Гидрирование (+Н2)
 R – СН СН2 + Н+ - Н- ¾® R – СН2 – СН3
R – СН СН2 + Н+ - Н- ¾® R – СН2 – СН3
2) Галогенирование
 СН2 СН2 + Br+ - Br- ® СН2Br – СН2Br
СН2 СН2 + Br+ - Br- ® СН2Br – СН2Br
желтый бесцветный
Данная реакция является качественной на (=) связь.
3) Гидрогалогенирование (присоединение галогеноводородов HCl; HBr; HJ)
 СН2 СН2 + Н+ - J- ® СН3 – СН2J
СН2 СН2 + Н+ - J- ® СН3 – СН2J
 СН3 – СН СН2 + Н+Br- ® СН3 – СНBr – СН3
СН3 – СН СН2 + Н+Br- ® СН3 – СНBr – СН3
Присоединение галогеноводородов происходит по правилу В.В. Марковникова: присоединение Н+ к несимметричному алкену происходит к атому углерода, у которого находится больше атомов Н по месту разрыва (=) связи.
 В присутствии перекиси водорода (Н2О2) реакция протекает против правила В.В. Марковникова.
В присутствии перекиси водорода (Н2О2) реакция протекает против правила В.В. Марковникова.
4) Гидратация (+Н2О) осуществляется по правилу В.В. Марковникова.
 R – СН СН2 + Н+ - ОН- ¾®¾ R – СНОН – СН3
R – СН СН2 + Н+ - ОН- ¾®¾ R – СНОН – СН3
спирт
5) Алкилирование – присоединение алканов, преимущественно содержащих третичный С атом.
 СН3
СН3
R – СН СН2 + СН3 – СН – СН3 ® R – СН – С – СН3
СН3 СН3 СН3
6) Реакции изомеризации. При нагревании или в присутствии катализаторов (AlCl3) алкены способны изомеризоваться – происходит перемещение двойной связи или установление изостроения.
 СН3 – СН = СН – СН3
СН3 – СН = СН – СН3
СН2 = СН – СН2 – СН3 бутен-2
СН3 – С = СН2

СН3
2-метилпропен-1
Реакции окисления.
а) Горение: С2Н4 + 3О2 ® 2СО2 + 2Н2О
б) Окисление в мягких условиях действием перманганатом калия (KMnO4) в разбавленном р-ре при обычной температуре, при этом образуются двухатомные спирты – гликоли:
СН2 = СН2 + [О] + Н – ОН ¾® СН2 ОН – СН2ОН
фиолетовый бесцветный р-р
р-р с бурым осадком
3СН2 = СН2 + 2КMnO4+4Н2О®3СН2ОН–СН2ОН +3MnО2¯+2КОН
фиолетовый р-р бесцветный бурый
Данная реакция является качественной на (=) связь.
При нагревании: СН2 = СН2 + 4КMnO4 ® 2CO2 + 4MnO2 + 4KOH
в) Окисление в жестких условиях сильными окислителями (КMnО4 + Н2SO4 или К2Cr2О7 + Н2SO4). При этом происходит разрыв (=) связи и образуются 2 молекулы кислоты или кислота и кетон, или СО2 и кислота, или СО2 и кетон.

О
 R – CН ¹ СН2 + [О] ¾¾®¾¾ R – С + СО2
R – CН ¹ СН2 + [О] ¾¾®¾¾ R – С + СО2
ОН
кислота
 О
О
СН3 – СН ¹ СН – СН3 + [О] ¾¾® 2СН3 – С
ОН
уксусная кислота

О

СН
3 – С ¹ СН
2 + [О] ¾¾® СН
3 – С + СО
2
 СН3
СН3
СН3 кетон

О


СН
3 – С ¹ С – СН
3 + [О] 2СН
3 – С

 СН3
СН3
СН3 СН3
По продуктам реакции можно установить строение алкена, т.е. место расположения (=) связи.
г) Окисление кислородом воздуха в присутствии Ag (кат.)
2СН2 = СН2 + О2 ¾¾® 2СН2 – СН2
О

 2R – СН = СН2 + О2 ¾¾® 2R – СН2 – СН2
2R – СН = СН2 + О2 ¾¾® 2R – СН2 – СН2
О

Окисление кислородом воздуха в присутствии катализаторов PdCl
2, CuCl.
| |
| | | 2СН2 = СН2 + О2 ¾¾¾¾® 2СН3 – С – Н
| |
Эта реакция является промышленной для получения не только уксусного альдегида, но и других альдегидов.
д ) Окисление озоном (О3)
Эта реакция используется для определения строения алкена. Озон присоединяется по месту (=) связи, образуя озониды, которые при обработке водой образуют перекись водорода Н2О2, альдегиды и кетоны.

 О СН3 О
О СН3 О


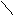





СН
3 – С = СН – СН
3 + ® С СН – СН
3 +Н–ОН® ®
 О О О О
О О О О
 О О
О О


 ® СН3 – С + СН3 – С + Н2О2
® СН3 – С + СН3 – С + Н2О2
СН3 Н
Реакция полимеризации – реакция соединения большого количества молекул алкенов (мономеров) с образованием высокомолекулярных соединений (полимеров).

n СН
2 СН
2 ® [– СН
2 – СН
2 –]
n
этилен полиэтилен

 n СН3 – СН СН2 ® [– СН – СН2 –]n
n СН3 – СН СН2 ® [– СН – СН2 –]n
пропилен
СН3
полипропилен
Реакции замещения. При термическом хлорировании
(300 - 600
0) происходит замещение атома водорода:
СН2 = СН2 + Cl2 ¾¾® СН2 = СНCl + HCl
хлористый винил
У гомологов этилена замещение происходит в радикале:
СН2 = СН – СН3 + Cl2 ¾¾®СН2 = СН – СН2Сl + HCl
3-хлорпропен-1
4.6 Обучающее задание №1.
Напишите возможные изомеры алкена С5Н10 и назовите.
Решение: В начале пишем неразветвленную цепь из С атомов, меняя положение (=) связи.
1) С = С – С – С – С; 2) С – С = С – С – С
Затем разветвляем цепь и меняем положение (=) связи.
 3) С = С – С – С 4) С – С = С – С
3) С = С – С – С 4) С – С = С – С

С С
 5) С – С – С = С
5) С – С – С = С
С
В конце подписываем к С атомам атомы водорода, соблюдая валентность углеродных атомов равную 4 и называем по двум номенклатурам.
1) СН2 = СН – СН2 – СН2 – СН3
М.н. пентен-1; Р.н. пропилэтилен
2) СН
3 – СН = СН – СН
2 – СН
3
М.н. пентен-2; Р.н. α-метил- β-этилэтилен
3) СН
2 = С – СН
2 – СН
3

СН3
М.н. 2-метилбутен-1; Р.н. α-метил- α-этилэтилен
 4) СН3 – С = СН – СН3
4) СН3 – С = СН – СН3
СН3
М.н. 2-метилбутен-2; Р.н. α,α,β-триметилэтилен
 5) СН3 – СН – СН = СН2
5) СН3 – СН – СН = СН2
СН3
М.н. 3-метилбутен-1; Р.н. α-изопропилэтилен
Обучающее задание №2.
Для каких соединений возможны цис-транс-изомерия?
 а)
а) 

б) 
в) 
Для соединения (а) эта изомерия не возможна, т.к. при втором С атоме стоят два одинаковых заместителя – группы СН3, а для (б) возможна, т.к. при углеродных атомах С2 и С3 стоят 2 разных заместителя СН3 и Н. Для соединения (в) эта изомерия не возможна, т.к. при С1 стоят два одинаковых заместителя Н.
Обучающее задание №3.
Какой спирт необходимо взять для получения
3-метилбутена-1?
Решение: Вначале пишем формулу алкена по названию:



Затем пишем углеродный скелет этого соединения:



Определяем место расположения группы ОН. Эта группа должна располагаться только при С1. пишем формулу спирта добавляя атомы водорода.

 СН3 – СН – С Н 2 – СН2 ОН ¾® СН3 – СН – СН = СН2 + Н2О
СН3 – СН – С Н 2 – СН2 ОН ¾® СН3 – СН – СН = СН2 + Н2О
СН3 СН3
Обучающее задание №4.
Какие алкены можно получить при крекинге бутана?
Решение:
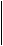
® СН
4 + СН
2 = СН–СН
3
СН3 – СН2 – СН2 – СН3 ¾® ® СН3 – СН3 + СН2=СН2
® Н2 + СН3 – СН =СН–СН3
Обучающее задание №5.
Из какого монобромпроизводного можно получить
4–метилпентен–2? Напишите уравнение реакции.
Решение: Вначале пишем формулу:
СН3 – СН = СН – СН – СН3

СН3
Определяем, у какого С атома должен находится атом Br, помня при этом правило Зайцева. Атом Br должен находится только у второго С атома.

СН
3 – СН Br – С
Н 2 – СН – СН
3 + К
ОН ¾®
СН3
¾® СН3 – СН = СН – СН – СН3 + КBr + Н2О

СН3
Обучающее задание №6.
Какие вещества получатся при каталитическом дегидрировании бутана?
 Решение:
Решение:
Обучающее задание №7
1) Напишите уравнения реакций взаимодействия
2–метилбутена–2 с HBr; H2O.
Решение: Вначале необходимо написать формулу алкена:
 СН3 – С = СН – СН3
СН3 – С = СН – СН3
СН3
Затем пишем уравнения реакций, используя правило Марковникова:


 СН3 – С СН – СН3 + Н+ - Br- ® СН3 – СBr – СН2 – СН3
СН3 – С СН – СН3 + Н+ - Br- ® СН3 – СBr – СН2 – СН3
СН3 СН3
2) Напишите уравнения реакций окисления в мягких и жестких условиях a-изопропил-a,b -диметилэтилена.
Решение: Пишем формулу алкена:







 СН3 – СН – С СН – СН3 + [О] + Н – ОН ¾®
СН3 – СН – С СН – СН3 + [О] + Н – ОН ¾®
СН3 СН3

¾® СН
3 – СН – СОН – СНОН – СН
3
СН3 СН3



СН
3 – СН – С СН – СН
3 + [О] ¾¾¾®
СН3 СН3
 О О
О О
¾¾¾® СН3 – СН – С + СН3 – С
СН3 ОН
3) В результате окисления алкена K2Cr2O7 + H2SO4 получены продукты:

 О О
О О

 СН3 – СН2 – С + СН3 – С
СН3 – СН2 – С + СН3 – С
ОН ОН
Установите строение алкена.
Решение: Исходный алкен состоит из 5
и углеродных атомов, а (=) связь находится между вторым и третьем С атомами
| СН3 – СН2 – СН = СН – СН3 + [О]¾¾¾¾¾¾®
®СН3 – СН2 – С – ОН + СН3 – С – ОН
| |
Обучающее задание №8
Осуществите превращения:
1) 
Решение: Зная свойства метана при t0=5000С образовывать этилен, пишем уравнения
2СН4 ¾® СН2 = СН2 + 2Н2

СН2 СН2 + НCl ® СН3 – СН2Cl
Действие Na – это реакция Вюрца.
 СН3 – СН2 Cl
СН3 – СН2 Cl
+ 2Na ® СН3 – СН2 – СН2 – СН3 + 2NaCl
СН3 – СН2 Cl

СН
3 – СН
2 – СН
2 – СН
3 ¾® СН
3 – СН
3 + СН
2 = СН
2
2) Исходя из пропена получить 2,3–диметилбутан.
СН3 – СН = СН2 ® СН3 – СН – СН – СН3
СН3 СН3
Решение: Необходимо получить алкан в котором в 2 раза больше С атомов. Для этого необходимо воспользоваться реакцией Вюрца. А сущность реакции Вюрца заключается в действии Nа на две молекулы моногалогенопроизводных. Поэтому из пропена действием HCl вначале получаем моногалогенопроизводное, а затем пишем уравнение реакции Вюрца.
СН3 – СН СН2 + HCl ® СН3 – СНCl – СН3
 СН3 – СН Cl
СН3 – СН Cl
СН3 + 2Na ® СН3 – СН – СН – СН3 + 2NаCl
СН3 – СН Cl СН3 СН3

CH3
 Обучающее задание №9
Обучающее задание №9
Было сожжено 5 л бутена. Определите объем воздуха, пошедшего на сжигание и объем выделившегося углекислого газа.
Решение: Пишем уравнение реакции:



Расчет ведем по коэффициентам, т.к. все вещества газообразные. На 5л бутана расходуется в 6 раз больше О2 и в
4 раза больше выделяется СО2. В воздухе» 20% О2, следовательно воздуха потребуется в 5 раз больше, т.е.:
Vвозд = 30 · 5 = 150л
Ответ: Vвозд = 150л. V(CO2) = 20л.
 Обучающее задание №10
Обучающее задание №10
Осуществите превращения: 1-бромпропана
в 2,3-диметилбутан.
Решение:
СН3 – СН2 – СH2Br ¾® СН3 – СН – СН – СН3
СН3 СН3
1) СН3 – СН2 – СH2Br + KOH ¾® СН3–СН=СН2+KBr+H2O
2) СН3 – СН = СН2+HBr ¾®СН3–СHBr–СН3
3) 2СН3 – СHBr – СН3 + 2Na ¾®СН3–СН – СН –СН3+2NaBr
СН3 СН3
 Обучающее задание №11
Обучающее задание №11
Определите структурную формулу алкена, если при взаимодействии 21 г. его с избытком бромводорода образуется 45,47 г. монобромпроизводного с атомом брома при третичном атоме углерода.
Решение:
CnH2n + HBr ¾® CnH2n+1Br
Определяем количество алкена по формуле:
 n(CnH2n) =
n(CnH2n) = 
Определяем количество вещества монобромпроизводного по формуле:
n(CnH2n+1Br) = 
По уравнению реакции из одного моль алкена получается
1 моль монобромпроизводного, т.е.:
n(CnH2n) = n(CnH2n+1Br)
 =
= 
21*(14n+81) = 45,47*14n; n = 5
Формула алкена – С5Н10
Структурная формула алкена может быть:

 СН2 = С – СН2 – СН3 или
СН2 = С – СН2 – СН3 или  СН2 – С = СН – СН3
СН2 – С = СН – СН3
СН3 СН3
 СН2 = С – СН2 – СН3
СН2 = С – СН2 – СН3
| + HBr ¾® СН3 – СBr – СН2 – СН3
СН3
| |
СН
3

 СН2 – С = СН2 – СН3
СН2 – С = СН2 – СН3
СН3
4.7 Контрольное задание 1
| Какие из указанных справа соединений можно использовать для получения слева соединений по реакции дегидратации и при действии КОН (спирт. р-ра)?
|
| 1) 2–метилбутен–2
2) изобутилен
3) 3–метилпентен–2
4) пропилен
|
а) СН3
 СН3 – С – СН3
СН3 – С – СН3
 ОН
б) СН3 – СН – СНОН – СН3
ОН
б) СН3 – СН – СНОН – СН3
 СН3
в) СН3 – СН – СН2Br
СН3
в) СН3 – СН – СН2Br
 СН3
г) СН3 – СОН – СН2 – СН3
СН3
г) СН3 – СОН – СН2 – СН3
 СН3
д) СН3 – СН2 – СН2ОН
е) СН3 – СНBr – СН3
ж) СН3–СН2 – СН – СНBr – СН3
СН3
д) СН3 – СН2 – СН2ОН
е) СН3 – СНBr – СН3
ж) СН3–СН2 – СН – СНBr – СН3
 СН3
СН3
 з) СН3 – СН2 – СОН – СН2 – СН3
СН3 з) СН3 – СН2 – СОН – СН2 – СН3
СН3
|
Контрольное задание 2
| Какие алкены получатся из следующих соединений?
|
1) СН3 – СHОН – СН2 – СН3
2) СН3 – СН2 – СН2 – СН3
3) СН3 – СН2Br
4) CН3 – СН2 – СН2 – СН2ОН
5) СН3 – СНBr – СН2Br
6) СН3 – СН2 – С ≡ СН
7) СН3 – СCl – СН2 – СН3
 СН3
СН3
| а) триметилэтилен
б) этилен
в) бутен–1
г) бутен–2
д) пропилен
|
| Напишите уравнения реакций и условия их протекания.
|
Контрольное задание 3
| Какие соединения получатся при действии Н2О и HBr на:
|
| 1) 3,3–диметилбутен–1
2) a,b-диметил-a-этилэтилен
3) изобутилен
4) бутен–1
| а) СН3 – СН2 – СНBr – СН3
 б) СН3 – СОН – СН3
СН3
в)СН3 – СН2 –СОН–СН2 – СН3 б) СН3 – СОН – СН3
СН3
в)СН3 – СН2 –СОН–СН2 – СН3
 СН3
г) СН3
СН3
г) СН3
 СН3 – С – СНBr – СН3
СН3 – С – СНBr – СН3
 СН3
д) СН3 – СНОН – СН2 – СН3
СН3
д) СН3 – СНОН – СН2 – СН3
 е) СН3–СН2 –СBr –СН2 – СН3
СН3
СН3 е) СН3–СН2 –СBr –СН2 – СН3
СН3
СН3
 ж) СН3 – СНОН – С – СН3
ж) СН3 – СНОН – С – СН3
 СН3
з) СН3 – СBr – СН3
СН3
з) СН3 – СBr – СН3
 СН3
СН3
|
| Напишите уравнения реакций.
|
Контрольное задание 4
Контрольное задание 5
| Какие продукты реакций получатся при окислении в жестких условиях следующих алкенов:
|
1) СН3 – СН = СН – СН3
2) СН3 – СН = СН –СН– СН3
 СН3<
СН3< |











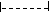





 СН2 = СН2
СН2 = СН2
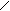
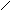
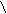


 С = С
С = С СН2 = С – CH3
CH3
СН2 = С – CH3
CH3
 НХ Н+ + Х-
НХ Н+ + Х-
 1) Гидрирование (+Н2)
1) Гидрирование (+Н2) R – СН СН2 + Н+ - Н- ¾® R – СН2 – СН3
R – СН СН2 + Н+ - Н- ¾® R – СН2 – СН3
 В присутствии перекиси водорода (Н2О2) реакция протекает против правила В.В. Марковникова.
В присутствии перекиси водорода (Н2О2) реакция протекает против правила В.В. Марковникова.
 СН3
СН3
 СН3 – СН = СН – СН3
СН3 – СН = СН – СН3

 R – CН ¹ СН2 + [О] ¾¾®¾¾ R – С + СО2
R – CН ¹ СН2 + [О] ¾¾®¾¾ R – С + СО2 О
О
 СН3 – С ¹ СН2 + [О] ¾¾® СН3 – С + СО2
СН3 – С ¹ СН2 + [О] ¾¾® СН3 – С + СО2


 СН3 – С ¹ С – СН3 + [О] 2СН3 – С
СН3 – С ¹ С – СН3 + [О] 2СН3 – С

 СН3
СН3

 2R – СН = СН2 + О2 ¾¾® 2R – СН2 – СН2
2R – СН = СН2 + О2 ¾¾® 2R – СН2 – СН2

 О СН3 О
О СН3 О

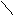




 СН3 – С = СН – СН3 + ® С СН – СН3 +Н–ОН® ®
СН3 – С = СН – СН3 + ® С СН – СН3 +Н–ОН® ®
 О О
О О


 5) СН3 – СН – СН = СН2
5) СН3 – СН – СН = СН2







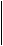 ® СН4 + СН2 = СН–СН3
® СН4 + СН2 = СН–СН3
 Решение:
Решение:


 О О
О О
 О О
О О
 СН3 – СН2 – С + СН3 – С
СН3 – СН2 – С + СН3 – С



 СН3 – СН2 Cl
СН3 – СН2 Cl СН3 – СН2 – СН2 – СН3 ¾® СН3 – СН3 + СН2 = СН2
СН3 – СН2 – СН2 – СН3 ¾® СН3 – СН3 + СН2 = СН2


 Обучающее задание №9
Обучающее задание №9


 n(CnH2n) =
n(CnH2n) = 


 СН3 – С – СН3
СН3 – С – СН3
 ОН
б) СН3 – СН – СНОН – СН3
ОН
б) СН3 – СН – СНОН – СН3
 СН3
в) СН3 – СН – СН2Br
СН3
в) СН3 – СН – СН2Br
 СН3
г) СН3 – СОН – СН2 – СН3
СН3
г) СН3 – СОН – СН2 – СН3
 СН3
г) СН3
СН3
г) СН3
 СН3
д) СН3 – СНОН – СН2 – СН3
СН3
д) СН3 – СНОН – СН2 – СН3
 ж) СН3 – СНОН – С – СН3
ж) СН3 – СНОН – С – СН3
 1) О
1) О

 СН3 – СН2 – СН2 – С + СО2 2) О ОH
СН3 – СН2 – СН2 – С + СО2 2) О ОH
 СН3 – СН2 – С
ОН
СН3 – СН2 – С
ОН
 3) О
3) О
 СН3 – С + СО2
СН3
СН3 – С + СО2
СН3
 4) О
СН3 – С – СН3
4) О
СН3 – С – СН3

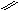 5) О О
5) О О
 СН3 – С – СН3 + СН3 – С
ОН
СН3
СН3 – С – СН3 + СН3 – С
ОН
СН3
 6) O
6) O
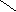 + СН3 – СН2 – С
ОН
+ СН3 – СН2 – С
ОН



