Для бакалавров направления 111100.62 «Зоотехния»
Рабочая тетрадь
Студент (ка) _______________________
Группа № ________________________
Москва 2012
Биологическая химия: Рабочая тетрадь/ С.В. Савчук, Т.В. Саковцева, Т.В. Метревели, А.А. Ксенофонтова. М.: Изд-во РГАУ-МСХА имени К.А. Тимирязева, 2012. 70 с.
В рабочей тетради представлены основные лабораторно-практические занятия, используемые в учебном процессе по курсу биологической химии. Так же отражены контрольные вопросы для сдачи коллоквиумов по наиболее важным разделам дисциплины.
Предназначено для студентов очного отделения зооинженерного факультета университета, обучающихся по направлению 111100.62 «Зоотехния»
Рекомендовано к изданию методической комиссией зооинженерного факультета (протокол № от____________2012 г.)
© Савчук С.В.,Саковцева Т.В.,
Метревели Т.В., Ксенофонтова А.А. 2012
© ФГОУ ВПО РГАУ – МСХА
имени К.А. Тимирязева, 2012
СОДЕРЖАНИЕ
Введение. 4
ОРГАНИЗАЦИЯ РАБОТЫ СТУДЕНТА.. 6
Занятие № 1. «Основы физической и коллоидной химии». 9
Занятие № 2. «Углеводы и липиды как биогенные соединения». 12
Занятие № 3. «Строение и физико-химические свойства аминокислот и белков». 15
Занятие № 4. «Ферментный катализ». 21
Занятие № 5. «Роль витаминов в метаболизме». 25
Занятие № 6. «Гормональная регуляция обмена веществ». 29
Занятие № 7. Коллоквиум I: «Уровни организации биогенных соединений. Ферменты. Витамины. Гормоны» 33
Занятие № 8. «Обмен веществ и энергии». 34
Занятие № 9. «Цикл трикарбоновых кислот». 37
Занятие № 10. «Обмен углеводов (часть 1)». 40
Занятие № 11. «Обмен углеводов (часть 2)». 43
Занятие № 13. «Липиды и биологические свойства клеточных мембран». 51
Занятие № 14. «Белковый обмен». 54
Занятие № 15. «Биохимическая детоксикация». 59
Занятие № 16. Коллоквиум II: «Обмен веществ и энергии». 62
Занятие № 17. Семинар на тему: 63
«Биологические основы, опыт и перспективы использования в животноводстве ферментных препаратов, витаминов и микроэлементов. Взаимосвязь углеводного, липидного и азотистого обменов. Биохимическая адаптация». 63
Занятие № 18. «Контроль практических навыков биохимического анализа». 65
Приложение 1. 67
Приложение 2. 68
Введение
ЦЕЛИ И ЗАДАЧИ ДИСЦИПЛИНЫ
Цель изучения дисциплины «Биологическая химия» состоит в подготовке студентов к комплексному подходу при решении таких профессиональных задач как эксплуатация животных, качество производимой продукции, проведение научных исследований.
В задачи дисциплины «Биологическая химия» входит формирование системных знаний о свойствах дисперсных систем и растворов биополимеров; энергетике и кинетике химических процессов в организме; обмене веществ и энергии в организме; обучение студентов правилам техники безопасности при работе с лабораторной посудой и техникой; получение навыков выполнения биохимических анализов; стимулирование учебно-исследовательской работы студентов; привить умение оценивать информативность результатов анализа на базе знания теоретических основ биологической химии.
ОБЪЕМ ДИСЦИПЛИНЫ И ВИДЫ УЧЕБНОЙ РАБОТЫ
Таблица 1
| Виды учебной работы
| Зачетных единиц
| Всего часов
| Семестр 3
|
| Общая трудоемкость дисциплины
| 3,0
|
|
|
| Аудиторные занятия
| |
|
|
| Лекции
|
|
|
|
| Практические занятия (ПЗ)
|
|
|
|
| Семинары (С)
|
|
|
|
| Самостоятельная работа
| |
|
|
| Вид итогового контроля (зачет, экзамен)
| | | экзамен
|
ФОРМЫ И СОДЕРЖАНИЕ ТЕКУЩЕГО И ИТОГОВОГО КОНТРОЛЯ
Текущий контроль: рейтинговая оценка знаний студентов, отчет о лабораторной работе.
Промежуточный контроль: коллоквиум.
Итоговый контроль – экзамен.
Система рейтинговой оценки
| Соответствие баллов текущей проверки знаний
традиционным оценкам
|
| Оценки:
| «Удовлетворительно»
| «Хорошо»
| «Отлично»
|
| Баллы:
| 5,0 - 7,4
| 7,5 - 8,9
| 9 - 10
|
ОРГАНИЗАЦИЯ РАБОТЫ СТУДЕНТА
НА ЛАБОРАТОРНО-ПРАКТИЧЕСКИХ ЗАНЯТИЯХ
Каждый студент имеет в лаборатории постоянное место. Степень подготовленности к занятию систематически проверяется путем опроса в течение 15 мин с использованием контрольных вопросов из рабочей тетради. Проверку результатов лабораторных заданий, выполненных студентами, преподаватель начинает за 10 мин до конца занятия. Пропущенные или не зачтенные занятия студент должен отработать в течение ближайших двух недель.
Правила техники безопасности при работе
В биохимической лаборатории
Работа в биохимической лаборатории связана с некоторой опасностью, поскольку многие вещества, используемые в ходе практических занятий, в той или иной степени ядовиты, огнеопасны или взрывоопасны. Существуют общие правила, выполнение которых обязательно для каждого работающего в лаборатории независимо от характера эксперимента.
I. Общие требования к поведению студентов в аудитории
1. Соблюдение требований настоящих Правил обязательно для студентов, работающих в аудитории.
2. Посторонние лица допускаются в аудиторию в момент проведения эксперимента только с разрешения преподавателя.
3. В лаборатории запрещено находиться в верхней одежде.
4. В биохимической лаборатории студенты обязаны находиться в халатах, проявлять осторожность в движениях, быть внимательными к указаниям преподавателя и лаборанта.
5. Запрещается загромождать проходы и лабораторные столы сумками.
6. Прежде чем приступить к выполнению работы, необходимо подробно изучить порядок ее проведения.
7. Следует соблюдать все указания преподавателя по безопасному обращению с оборудованием, реактивами, нагревательными приборами и методами нагревания реактивов, наполнению сосудов и т.д.
8. Без разрешения запрещается проводить опыты, не предусмотренные планом занятия.
9. Запрещается прием пищи в биохимической лаборатории.
10. Обо всех неполадках в работе оборудования, водопровода, электросети и т.д. необходимо ставить в известность преподавателя или лаборанта.
11. Уборку рабочих мест по окончании работы следует произвести с указаниями преподавателя.
12. По окончании лабораторных работ студенты должны вымыть руки с мылом.
13. При получении травмы (порезы, ожоги), а также при плохом самочувствии студенты должны немедленно сообщить об этом преподавателю или лаборанту.
14. При возникновении в аудитории во время занятий аварийных ситуаций (пожар, появление сильных посторонних запахов) не допускать паники и следовать указаниям преподавателя.
Экспериментальная работа.
Опыт 1. Определение рН растворов.
Для нормального протекания биологических процессов большое значение имеет активная кислотность. Это концентрация свободных ионов водорода в растворе. Активная кислотность зависит от степени диссоциации, находящихся в растворе кислот или других кислореагирующих веществ и характеризуется величиной рН. От величины рН зависит протекание биохимических процессов.
В настоящее время большое значение приобрел потенциометрический метод определения рН растворов, который позволяет быстро и точно (< 0,1 pH) определять значения pH даже при исследовании мутных и окрашенных растворов.
Приборы. 1. Пластиковые стаканчики.
2. рН – метр.
Реактивы. 1. Дистиллированная вода.
2. Моча.
3. Молоко.
4. Раствор яичного белка, 1%-ный.
- Определение рН-метром проводите в пластиковых стаканчиках.
- Измерьте рН следующих биологических жидкостей: вода, моча, молоко, раствор слюны, раствор яичного белка. Запишите полученные значения в таблицу.
- Добавьте во все исследуемые жидкости по 1 мл дистиллированной воды и снова измерьте рН. Запишите полученные значения в таблицу.
- Во все исследуемые жидкости добавьте по 4 капли 0,1 н раствора соляной кислоты. Измерьте рН и запишите полученные величины в таблицу.
- Во все исследуемые жидкости добавьте по 4 капли 0,1 н раствора гидроксида натрия. Измерьте рН и запишите полученные величины в таблицу.
| № п/п
| Вид биологической
жидкости
| рН
| рН после
добавления
воды
| рН после
добавления
кислоты
| рН после
добавления
щелочи
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Какой вывод можно сделать на основе полученных данных? Какая исследуемая жидкость обладает наибольшей буферной емкостью? По отношению к каким веществам (кислоте или щелочи) выражена больше буферная емкость у биологических жидкостей и почему? Почему важно поддерживать кислотно-основное равновесие внутренней среды организма?
Экспериментальная работа.
Экспериментальная работа.
Экспериментальная работа.
Экспериментальная работа.
Задание 1. Заполните таблицу, обобщающую сведения об основных коферментах.
| Название
кофермента
| Витамин-предшественник
| Биохимическая роль кофермента в катализе
|
| 1. НАД+, НАДФ+
|
|
|
| 2. ФМН, ФАД+
|
|
|
| 3. ТПФ
|
|
|
| 4. Биоцеталь
|
|
|
| 5. Ко-А
|
|
|
| 6. ПФ
|
|
|
| 7. ТГФК
|
|
|
Дата выполнения ________ Балл ____ Подпись преподавателя ____________
Экспериментальная работа.
Опыт 1. Влияние физической нагрузки на содержание глюкозы в крови.
Концентрация глюкозы в крови контролируется центральной нервной системой и железами внутренней секреции. Поэтому в здоровом организме возможны лишь кратковременные колебания уровня глюкозы в крови. Так, гипергликемия наблюдается при сильном эмоциональном возбуждении (испуг, радость, страх, плач и т.д.), стрессовых реакциях, болевых приступах. Умеренная гипергликемия возникает после физической нагрузки.
Приборы. 1. Штатив с пробирками.
2. Набор пипеток.
3. Скарификатор стерильный.
Реактивы. 1. Тест-набор для определения глюкозы.
1. У испытуемого (добровольца) возьмите из пальца 0,1 мл крови.
2. Определите количество глюкозы в крови при помощи тест-полосок.
3. Затем он выполняет физические упражнения (например, 50-60 приседаний), и через 15-20 минут у него снова возьмите 0,1 мл крови из пальца для анализа.
Рассчитайте количество глюкозы в крови до и после физической нагрузки. Сравните полученные результаты и объясните причину гипергликемии после физической нагрузки.
Биуретовая реакция.
В пробирку поместите 0,5 мл фильтрата. Добавьте равный объем 10%-ного раствора гидроксида натрия, а затем 2-3 капли 2%-ного раствора сульфата меди (II). Красно-фиолетовое окрашивание свидетельствует о положительной реакции.
Ксантопротеиновая реакция.
В пробирку поместите 0,5 мл фильтрата. Добавьте 3 капли концентрированной азотной кислоты и нагрейте на водяной бане. Желтое окрашивание свидетельствует о положительной реакции.
Реакция Фоля.
В пробирку налейте 1 мл фильтрата. Добавьте равный объем раствора гидроксида натрия, нагрейте до кипения и прибавьте 1-2 капли 0,5%-ного раствора ацетата свинца. Потемнение раствора свидетельствует о положительной реакции.
На основании полученных результатов сделайте вывод о строении инсулина. На какие биохимические процессы и как влияет инсулин?
Задание 1. Заполните таблицу, обобщающую сведения о влиянии гормонов на обмен углеводов.
| Название гормона
| Место синтеза гормона
| Химическая природа
гормона
| Ткани-мишени
| Влияние на процессы обмена
углеводов
| Влияние на концентрацию глюкозы в крови
|
| Инсулин
|
|
|
|
|
|
| Адреналин
|
|
|
|
|
|
| Глюкагон
|
|
|
|
|
|
| Кортизол
|
|
|
|
|
|
Дата выполнения ________ Балл ____ Подпись преподавателя ____________
Экспериментальная работа.
Опыт 2. Открытие альдегиддегидрогеназы в молоке.
Приборы. 1. Штатив с пробирками.
2. Набор пипеток.
3. Водяная баня.
4. Пробки.
Реактивы. 1. Молоко, кипяченое и некипяченое.
2. Формалин, 0,4%-ный раствор.
3. Метиленовая синь, 0,01%-ный раствор.
1. Налейте в две пробирки по 3 мл молока из пронумерованных колбочек соответственно (в одной из них молоко кипяченое, в другой - нет).
2. В обе пробирки внесите по 6 капель 0,4%-ного раствора формальдегида и несколько капель 0,01%-ного раствора метиленовой сини (до появления голубого окрашивания).
3. Пробирки встряхните и быстро закройте пробками для того, чтобы создать относительно анаэробные условия.
4. Поместите пробирки в водяную баню (37оС) и отметьте постепенное обесцвечивание метиленовой сини через 5-10 минут в одной из пробирок.
5. После обесцвечивания содержимое пробирки несколько раз встряхните и наблюдайте за изменением цвета.
Определите, в какой пробирке содержалось некипяченое молоко? Объясните, почему Вы сделали такой вывод? Почему после встряхивания обесцвеченной пробирки произошло изменение цвета?
Экспериментальная работа.
Одним из методов количественного анализа в биохимии является фотокалориметрия. Метод основан на измерении оптической плотности окрашенных растворов, которые получают при взаимодействии субстрата с различными химическими агентами. Концентрация субстрата пропорциональна степени окрашивания раствора.
Экспериментальная работа.
Экспериментальная работа.
Экспериментальная работа.
Опыт 4. Определения видовой принадлежности жира по температуре плавления жира.
Приборы. 1. Фарфоровая чашка.
2. Капилляры стеклянные.
3. Холодильник.
4. Термометр.
5. Химический стаканчик, 150-250 мл.
6. Штатив.
7. Стеклянная палочка.
Реактивы. 1. Жир животный.
1. Исследуемый жир поместите в фарфоровую чашку, вытопите его на горелке и наберите в прозрачные стеклянные капилляры диаметром 1,5 мм. Высота столбика жира должна быть 5-7 мм.
2. Капилляры с жиром поместите в холодильник на 1-2 часа.
3. После охлаждения капилляр с жиром при помощи резинки закрепите на термометре таким образом, чтобы столбик жира был на одном уровне с головкой термометра.
4. Термометр вместе с капилляром закрепляют на штативе и опустите в прозрачный химический стакан, наполненный водой и стоящий на электрической плитке, таким образом, чтобы верхняя часть капилляра была выше поверхности воды.
5. Начинайте нагревать воду, помешивая ее стеклянной палочкой. Нагревание продолжайте до тех пор, пока столбик жира не станет прозрачным и под давлением воды станет подниматься вверх по капилляру. В этом момент снимают показатель термометра.
6. Измерение повторите пять раз и найдите среднее арифметическое.
Полученный результат считают температурой плавления исследуемого жира. Данные о температуре плавления жира приведены в таблице.
| Вид животного
| Температура плавления жира животных разных видов
|
| T°Сплавления
наружного жира
| T°С плавления
внутреннего жира
|
| Крупный рогатый скот
|
| 49,5
|
| Лошадь
| 28,5
| 31,5
|
| Мелкий рогатый скот
| 49,5
|
|
| Собака
|
|
|
| Свинья
| 37,5
| 45,5
|
| Олень
| 48,5
|
|
| Кролик
|
|
|
| Кошка
|
|
|
| Нутрия
|
|
|
| Гусь
|
|
|
| Курица
|
|
|
На основании полученных результатов сделайте вывод.
Дата выполнения ________ Балл ____ Подпись преподавателя ____________
Экспериментальная работа.
Опыт 1. Искусственные полупроницаемые мембраны.
Приборы. 1. Штатив с пробирками.
2. Набор пипеток.
3. Стеклянные палочки.
Реактивы. 1. Силикатный клей.
2. Дистиллированная вода.
3. Безводный хлористый кобальт.
4. Безводная хлористая медь.
1. Для приготовления раствора силикатного клея налейте в пробирку 1 мл клея и 3 мл воды. Тщательно перемешайте содержимое стеклянной палочкой.
2. В пробирку бросьте кристаллики безводного хлористого кобальта или хлористой меди и хорошо встряхните (не перемешивать!), для того, чтобы кристаллы опустились на дно пробирки.
Объясните причину наблюдаемого роста дендроидных образований.
__________________________________________________________________ Опыт 2. Количественное определение концентрации общего холестерина в сыворотке крови по методу Илька.
В основу метода положена модифицированная Ильком реакция Либермана-Бурхарда, реактив которого дает изумрудное окрашивание с холестерином.
1. В три пробирки внесите реактивы согласно следующей таблице:
| Раствор
| Опытная проба,
мл
| Калибровочная проба, мл
| Контрольная проба, мл
|
| Исследуемый образец
| 0,5
| -
| -
|
| Калибровочный раствор холестерина
| -
| 0,5
| -
|
| Дистиллированная вода
| -
| -
| 0,5
|
| Рабочий реактив
| 2,0
| 2,0
| 2,0
|
2. Содержимое пробирок перемешайте и на 20 минут поместите в термостат при температуре 37°С.
3. Измерьте оптическую плотность при длине волны 650 им (красный светофильтр) опытной пробы против контрольной (D1) и калибровочной пробы против контрольной (D2).
4. Расчет ведут по следующей формуле:
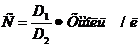 ,
,
где С – концентрация холестерина;
X - содержание холестерина в калибровочном растворе, ммоль/л
Сравните полученное значение с физиологическими нормами и сделайте вывод.
Экспериментальная работа.
Опыт 1. Количественное определение общего белка в сыворотке крови.
В плазме крови содержится до 200 различных белковых компонентов. Большая часть выполняемой функции крови, так или иначе, связана с белками плазмы: поддержание онкотического давления, участие в процессах свертывания крови, регуляции рН крови, выполнение транспортной и защитной функции, функции «белкового резерва» и др. Качественное и количественное постоянство белкового состава крови четко поддерживается организмом, и любые изменения в этой системе, как правило, являются отражением нарушенного функционирования тех или органов и тканей.
Приборы. 1. Штатив с пробирками.
2. Набор пипеток.
3. Центрифуга.
4.Центрифужные пробирки.
5. Водяная баня.
6. ФЭК.
7. Кюветы, 10 мм.
Реактивы. 1. Сыворотка крови.
2. Трихлоруксусная кислота, 3%-ный раствор в этаноле.
3. Биуретовый реактив.
4. Хлорид натрия, 0,85%-ный раствор.
а) Определение концентрации альбуминов.
1. В центрифужную пробирку поместите 1,5 мл 3%-ной трихлоруксусной кислоты в этаноле.
2. Добавьте 0,5 мл сыворотки крови, тщательно перемешайте и через 10 мин центрифугируйте.
3. 0,2 мл центрифугата перенесите в пробирку, содержащую 2,3 мл 0,85%-ного раствора хлорида натрия и добавьте 2,5 мл биуретового реактива.
4. Тщательно перемешайте и выдержите 20 мин в термостате при 37°С.
5. Измерьте оптическую плотность при зеленом светофильтре (540-560 нм) в кювете с толщиной слоя 10 мм.
б) Определение концентрации общего белка.
1. 0,1 мл сыворотки крови внесите в пробирку, содержащую 2,4 мл 0,85% раствора хлористого натрия.
2. Прибавьте 2,5 мл биуретового реактива.
3. Перемешайте, термостатируйте 30 мин при 37оС, измерьте оптическую плотность так же, как и при определении альбуминов.
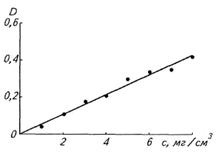
 Концентрацию альбуминов и общего белка определите по калибровочному графику.
Концентрацию альбуминов и общего белка определите по калибровочному графику.
Для определения концентрации альбуминов полученные по стандартному графику значения следует умножить на 2, т.к. в ходе подготовки реакции сыворотка крови была разбавлена в два раза больше, чем при определении общего белка.
Сравните полученные значения с нормальными величинами. О чем свидетельствует снижение (повышение) уровня белка в сыворотке крови у животных? К каким последствия может привести недостаточность альбумина в крови?
ЭТАЛОН
содержания незаменимых аминокислот в пищевом белке:
| Аминокислота
| Содержание в г
на 100 г белка
|
| Изолейцин
| 4,0
|
| Лейцин
| 7,0
|
| Лизин
| 5,5
|
| Серосодержащие аминокислоты (метионин + цистеин)
| 3,5
|
| Ароматические аминокислоты (фенилаланин + тирозин)
| 6,0
|
| Треонин
| 4,0
|
| Триптофан
| 1,0
|
| Валин
| 5,0
|
Лимитирующей биологическую ценность аминокислотой считается та, скор которой наименьший.

где ∆РАС – избыток скора аминокислоты; n – количество незаменимых аминокислот.
∆РАС = Сi - Сmin
где Сi – избыток скора аминокислоты;
Сmin - минимальный из скоров незаменимых аминокислот исследуемого белка по отношению к эталону, %.
Биологическую ценность (БЦ) пищевого белка (%) определяют по формуле:
БЦ = 100 – КРАС
Содержание незаменимых (для человека) аминокислот
Экспериментальная работа.
Биологическая химия
Рабочая тетрадь
Издается в редакции составителей
Корректура составителей
для бакалавров направления 111100.62 «Зоотехния»
Рабочая тетрадь
Студент (ка) _______________________
Группа № ________________________
Москва 2012
Биологическая химия: Рабочая тетрадь/ С.В. Савчук, Т.В. Саковцева, Т.В. Метревели, А.А. Ксенофонтова. М.: Изд-во РГАУ-МСХА имени К.А. Тимирязева, 2012. 70 с.
В рабочей тетради представлены основные лабораторно-практические занятия, используемые в учебном процессе по курсу биологической химии. Так же отражены контрольные вопросы для сдачи коллоквиумов по наиболее важным разделам дисциплины.
Предназначено для студентов очного отделения зооинженерного факультета университета, обучающихся по направлению 111100.62 «Зоотехния»
Рекомендовано к изданию методической комиссией зооинженерного факультета (протокол № от____________2012 г.)
© Савчук С.В.,Саковцева Т.В.,
Метревели Т.В., Ксенофонтова А.А. 2012
© ФГОУ ВПО РГАУ – МСХА
имени К.А. Тимирязева, 2012
СОДЕРЖАНИЕ
Введение. 4
ОРГАНИЗАЦИЯ РАБОТЫ СТУДЕНТА.. 6
Занятие № 1. «Основы физической и коллоидной химии». 9
Занятие № 2. «Углеводы и липиды как биогенные соединения». 12
Занятие № 3. «Строение и физико-химические свойства аминокислот и белков». 15
Занятие № 4. «Ферментный катализ». 21
Занятие № 5. «Роль витаминов в метаболизме». 25
Занятие № 6. «Гормональная регуляция обмена веществ». 29
Занятие № 7. Коллоквиум I: «Уровни организации биогенных соединений. Ферменты. Витамины. Гормоны» 33
Занятие № 8. «Обмен веществ и энергии». 34
Занятие № 9. «Цикл трикарбоновых кислот». 37
Занятие № 10. «Обмен углеводов (часть 1)». 40
Занятие № 11. «Обмен углеводов (часть 2)». 43
Занятие № 13. «Липиды и биологические свойства клеточных мембран». 51
Занятие № 14. «Белковый обмен». 54
Занятие № 15. «Биохимическая детоксикация». 59
Занятие № 16. Коллоквиум II: «Обмен веществ и энергии». 62
Занятие № 17. Семинар на тему: 63
«Биологические основы, опыт и перспективы использования в животноводстве ферментных препаратов, витаминов и микроэлементов. Взаимосвязь углеводного, липидного и азотистого обменов. Биохимическая адаптация». 63
Занятие № 18. «Контроль практических навыков биохимического анализа». 65
Приложение 1. 67
Приложение 2. 68
Введение
ЦЕЛИ И ЗАДАЧИ ДИСЦИПЛИНЫ
Цель изучения дисциплины «Биологическая химия» состоит в подготовке студентов к комплексному подходу при решении таких профессиональных задач как эксплуатация животных, качество производимой продукции, проведение научных исследований.
В задачи дисциплины «Биологическая химия» входит формирование системных знаний о свойствах дисперсных систем и растворов биополимеров; энергетике и кинетике химических процессов в организме; обмене веществ и энергии в организме; обучение студентов правилам техники безопасности при работе с лабораторной посудой и техникой; получение навыков выполнения биохимических анализов; стимулирование учебно-исследовательской работы студентов; привить умение оценивать информативность результатов анализа на базе знания теоретических основ биологической химии.
ОБЪЕМ ДИСЦИПЛИНЫ И ВИДЫ УЧЕБНОЙ РАБОТЫ
Таблица 1
| Виды учебной работы
| Зачетных единиц
| Всего часов
| Семестр 3
|
| Общая трудоемкость дисциплины
| 3,0
|
|
|
| Аудиторные занятия
| |
|
|
| Лекции
|
|
|
|
| Практические занятия (ПЗ)
|
|
|
|
| Семинары (С)
|
|
|
|
| Самостоятельная работа
| |
|
|
| Вид итогового контроля (зачет, экзамен)
| | | экзамен
|
ФОРМЫ И СОДЕРЖАНИЕ ТЕКУЩЕГО И ИТОГОВОГО КОНТРОЛЯ
Текущий контроль: рейтинговая оценка знаний студентов, отчет о лабораторной работе.
Промежуточный контроль: коллоквиум.
Итоговый контроль – экзамен.
Система рейтинговой оценки
| Соответствие баллов текущей проверки знаний
традиционным оценкам
|
| Оценки:
| «Удовлетворительно»
| «Хорошо»
| «Отлично»
|
| Баллы:
| 5,0 - 7,4
| 7,5 - 8,9
| 9 - 10
|



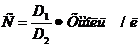 ,
,
 Концентрацию альбуминов и общего белка определите по калибровочному графику.
Концентрацию альбуминов и общего белка определите по калибровочному графику.


