Приборы для э/ф
Электофорез в свободной системе постепенно возвращается. Э/ф в тонких трубках, конвекция перестает играть существенную роль и ей можно пренебречь. Можно использовать псевдогель, если нужно что-то, что обуслаливает матрикс, трение о которой обеспечит нам нужный параметр разделения.
Цель лекции – показать, что любой метод на самом деле шире, чем он есть
Специальные методы э/ф Белков
Белки – самый сложный БП на сегодня. Заряд не коррелирует с длиной и может сильно варьировать.
Изоэлектрическая точка – рН, при котором суммарный заряд равен 0.
Полезный параметр разделения
Использование исчерпывающей денатурации приводит к нормализации заряда.
Проводится взаимодействием с избытком денатурирующих агентов, детергентов типа SDS.
После денатурации белок напоминает НК: его заряд становится в некотором роде пропорциональным массе.
DISC электрофорез
на примере электрофореза белков в присутствии SDS по U. Laemmli
(модифицированная система буферов Орнштейна и Девиса)
Состоит из двух совершенно разных совмещенных систем.
Э/ф по Лэммли – самый цитируемый на сегодня. Хотя он самой системы не сделал, а просто предложил вести в денатурирующих условиях.
Препараты содержат очень много примесей, в т.ч. ионогенных и примесей других белков, и имеют большой объем.
Очищать их трудно и нежелательно
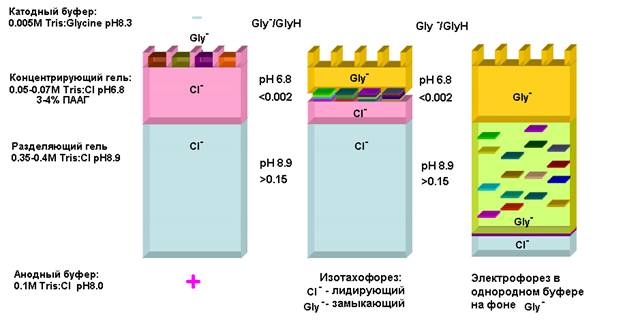
Был запрос – сделать систему, в которой бы сначала велось концентрирование проб. А непосредственное разделение никого не устраивали. Если объем большой, то ширина зоны изначально очень большая, и ионогенные примеси ее расширяют и искажают.
Давайте используем изотахофорез, каждый БП сконцентрируем в своей зоне. Добьемся такой концентрации, что от наличия ионогенных примесей уже не будет зависеть, и форма зоны будет идеальной.
А потом эти зоны нанесем на э/ф, на фоне однородного электролита.
А почему нас не усраивал изотахофорез? Зоны слишком плотно прилегают друг к другу, не разойдутся. Детектировать плохо, извлекать плохо.
Glycine: NH -CH -COOH,
pKa =2.34, pKa =9.6, pI=5.97
1 этап. Концентрирующий гель.
По сути нам не нужен, используется только для подавления конвекции.
Гель кА можно более низкой процентности.
Можно даже агарозный, но проблема с нагревм
Чаще ПААГ.
Лидирующий и замыкающий анион – 2 буфера
Для лидирующего используем хлор
С замыкающим проблема. Причем при переходе в другой гель замыкающий анион должен неожиданно увеличить подвижность и обогнать все разделяемые компоненты и убежать далеко вперед, чтобы э/ф шел на фоне этого замыкающего аниона
Делаем это просто, засчет изменения рН.
Используются глицин, например.
Пусть будет в геле рН 6.8.
Если рН сдвинем в кислую область и подавим протонирование глицина, то эффективный заряд его будет очень маленьким. И подвижность его будет соответствовать не самой маленькой частице, да еще и гидратированной, с зарядом 0.002е.
Концентрирующий гель д.б. такого объема, чтобы за время пребывания в нем система стала равновесной. Соответственно, чем больше мы наносим пробы и ем больше в ней ионогенных примесей, тем большую часть объема он должен занимать.
Этап. Разделяющий гель
Надо создать щелочную среду, чтобы резко увеличить подвижность глицина. Эффективный заряд увеличится на 2 прядка, засчет того, что заряд – логарифмическая величина.
Глицин обгонит все область БП.
Если посмотреть на свет, видны тонкие зоны – если много мажорного продукта
Разделение идет примерно по массе с поправкой на денатурацию.
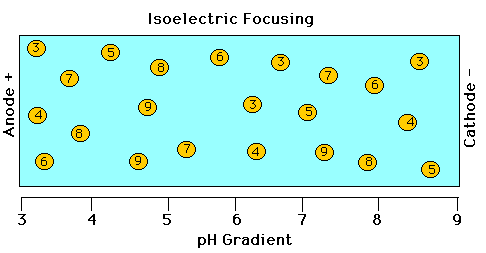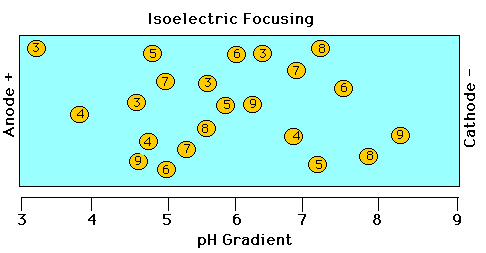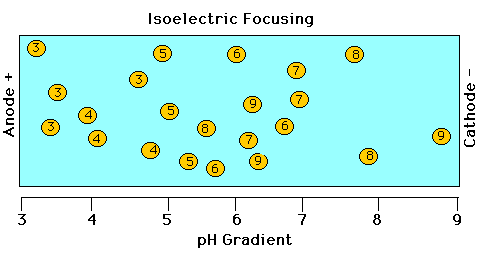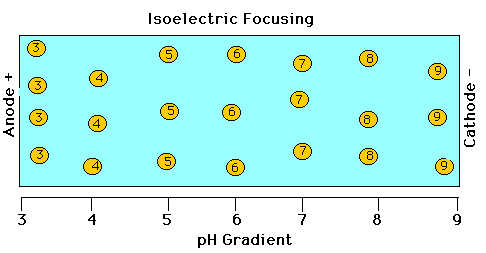 Изоэлектрофокусирование (IEF)
Изоэлектрофокусирование (IEF)
Для разделения используется изоэлектричекая точка. (ИТ)
Если создадим градиент рН, и на фоне его создадим электрическое поле нужного напрвления, то создадим систему, в которой белки создадут стабильные зона в тех местах, где рН=ИТ. Зоны будут иметь резкие границы и будут стабиьными пока приложено ЭП.
В системе существуют силы, которые следят за тем, чтобы система оставалась равновесной, при попытке, например, с помощью диффузии, это состояние нарушить.
Одна проблема – создать градиент рН, да еще с достаточной буферной емкостью.
Белки – амфолины, и учавствуют в создании градиента тоже!
Чаще всего полипептиды и использубт для созданяградиента.
Сомое веселое, создать градиент рН можно с помощью того же изоэлектрического фокусирования.
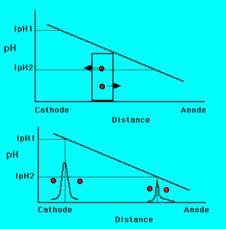 В пределе ток будет маленьким и будет обусловлен только амфолинами, вышедшими из своих зон.
В пределе ток будет маленьким и будет обусловлен только амфолинами, вышедшими из своих зон.
Надо только подобрать амфолины так, чтобы они перекрывали весь нужнй нам диапазон рН. Иначе сам белок будет этим самым амфолином и сформирует широкую зону, т.к. концентрация маленькая.
Недостаток – система нестабильна в пространстве и при небольших флуктуациях часть амфолинов может перейти в анодную или в катодную камеру.
Для подаления конвекции используется ПААГ небольшой процентности. Более того, иногда для этих целей используется бумага или вообще любая пористая структура, т.к. так же, как и изотахофорез, это процесс равновесный.
Чтобы зафиксировать в пространстве, используют иммобилизованные амфолины – гели или полоски пористого материала, изготовленные на заводе. В нужных местах уже ковалентно присоединены амфолины в нужном количестве.
Техническая проблема – отведение тепла.
Тонкий гель
Образцы можно наносить в любое место такой системы, т.к. все равно сформируется равновесное состояние, которое не зависит от исходного.
Эти 2 метода сейчас в эксперименте часто используются комбинированно.
Двумерный Э/Ф белков
Основа протеомики.
Сначала проводится изоэлектрофокусирование на тонкой полоске, а уже потом эта полоска используется как зона нанесения для ДИСК, заодно решается проблема концентрирования.
Типичный пример – разделение белков Е.соли.
СпециальныеЭ/Ф для НК
- постоянное отношение заряд / размер:
Z ~= -N (-2N) - малая зависимость заряда от pH
- денатурация:
применительно к НК – переход в одноцепочечную форму
o нагревание выше 65-70º C
o хаотропные агенты: (NH2)2CO, HCONH2
o pH > 9.5-10
Есть линейный участок в логарифмических координатах зависимости подвижности от длины.
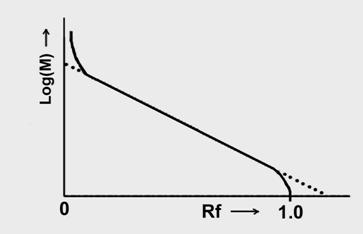
Если речь идет о структурно других НК, например, кольцевых плазмид, да еще и замкнутых, то там подвижность может значительно меняться в зависимости от структуры.
Самая подвижная – суперскрученная, причем существенно. Засчет этого большая гибкость в любом месте. Стоит сбросить супервитки – еще меньше. А у линейной подвижность относительно релаксированной м.б. как больше, так и меньше. Зависит это от длины, от условий, от состава геля,
Афинный электрофорез
на примере электрофореза tRNA, имеющих сульфосодержащие основания
Гель содержит [(N-акрилоамино)фенил]ртуть:
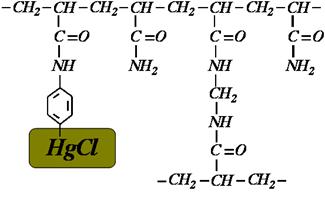
Товарищам нужно было отделять модифицированные тРНК, содержащее серу, от немодифицированных. Молекулярная масса практически одинакова, заряд одинаковый.
Ввели в состав для гуппу, которая взаимодействует с атомами серы, и резко замедлять подвижность, в разы.
В состав геля можно включить практически любой лиганд.
Электрофорез на целлюлозе с неподвижными границами (изотахофорез в равновесии с эндоэлектроосмосом)
(Абелев Г.И. и др.)
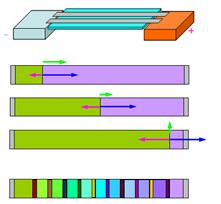 Товарищи конструировали на заказ систему для фракционирования любых АГ, полипептидов. С прицелом на использование в медицинской практике.
Товарищи конструировали на заказ систему для фракционирования любых АГ, полипептидов. С прицелом на использование в медицинской практике.
- Должна быть равновесной: включил, ушел, пришел – ничего не выкипело и не сгорело. И все правильно и не искажено.
- Должна работать с биологическим материалом: слюна и т.д. Вносимые пробы могут иметь различный объем и состав, и это не должно было влиять на результат
Согласно второму условию, это д.б. изотахофорез. Но это неравновесный метод! Уйдет все в анодную камеру
Вспомнили про эндоэлектроосмос.
Взяли подложку, к которой пришиты ионогенный группы (пористая, бумага, например). И создали его в направлении, противоположном разделению компонентов в электрическом поле. Более того, в присутствии замыкающего электролита, осмос больше, чем в присутствии замыкающего.
Т.е. в начале осмос не большой, и общий вектор в направлении разделения. Но по мере движения границ осмос нарастает.
Осмотический поток зависит от количества молекул воды, которые движутся вместе с катионами. А в обратном направлении – вместе с катионами. Если с лидирующим анионом движется больше молекул воды, чем с замыкающим, то так и будет.
При правильном расчете осмотического потока, который можно регулировать с помощью ионогенных групп, пришитых к бумажке.
Один недостаток. Все компоненты непосредственно контактируют друг с другом – в виде зон.
Как бороться? Для антител – можно прогнать через бумажку с иммобилизованными антителами, и они свяжутся. Можно проявить таким способом.
Допустим, мы некоторые зоны нам надо разнести, а проявлять мы будем каим-то другим способом.
Можно добавить в разделяеую смесь спйсеры, электролиты в извесной концентрации, которые не будут взаимодействовать с компонентами, и у которых подвижность промежуточная. Шириной зоны мы можем управлять.Можем разнести компоненты на нужное расстояние.
Преимущества:
- концентрирование проб, независимость результата от объема нанесения
- независимость результата от времени ведения процесса
- возможность легкой адаптации к самым разным задачам (разделяемым смесям)
Э/ф в псевдогеле. НК
"ГЕННЫЙ АНАЛИЗАТОР" ABI 310
(Applera = Applied Biosystems+Сelera Genomics)
Принцип тот же, трение о матрикс. Только гель не совсем честный, иначе мы его ни за что из капилляра не вытряхнем, а одноразовые капилляры – дорого.
Используется псевдогель, модифицированный линейный ПАА. Есть боковые группы, которые создают виртуальный гель засчет нековалентных взаимодействий. Начинает приближаться к агарозе. Этакий жидкий кристалл. Но никто не проверял. Хотя хорошо отфильтрованный линейный ПАА, в узком диапазоне длин, тоже работает.
Позволяет разделять продукты реакции Сенгера. Или просто разделять фрагменты – ГенСкан.
При разделении некоторые фрагменты имеют разную массу, но одинаковую подвижность – просто у флюорохромов разные заряды. Даже сдвигают подвижность до 1 звена.
Современные приборы – до 16 капилляры.
Приборы для э/ф
Электофорез в свободной системе постепенно возвращается. Э/ф в тонких трубках, конвекция перестает играть существенную роль и ей можно пренебречь. Можно использовать псевдогель, если нужно что-то, что обуслаливает матрикс, трение о которой обеспечит нам нужный параметр разделения.
Цель лекции – показать, что любой метод на самом деле шире, чем он есть




 Изоэлектрофокусирование (IEF)
Изоэлектрофокусирование (IEF) В пределе ток будет маленьким и будет обусловлен только амфолинами, вышедшими из своих зон.
В пределе ток будет маленьким и будет обусловлен только амфолинами, вышедшими из своих зон.

 Товарищи конструировали на заказ систему для фракционирования любых АГ, полипептидов. С прицелом на использование в медицинской практике.
Товарищи конструировали на заказ систему для фракционирования любых АГ, полипептидов. С прицелом на использование в медицинской практике.


