

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...
Топ:
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Обычно атомы формируют связи за счет электронов разных энергетических состояний. Например, у бериллия Ве в образовании связи принимают участие s - и p -электроны. Несмотря на различные формы электронных облаков связи равноценны и расположены симметрично. Как же неравноценные по исходному состоянию электроны образуют равноценные связи? Ответ дает теория гибридизации. Гибридизация – процесс, в результате которого происходит перестройка валентных орбиталей центрального атома и образование смешанных гибридных орбиталей, одинаковых по форме и энергии.
Гибридные орбитали асимметричны и обуславливают более сильное перекрывание с орбиталями других атомов, по сравнению с негибридными, что приводит к образованию более прочной химической связи, а следовательно, более устойчивой молекулы.
Понятие гибридизации необходимо, когда связи образуются электронами центрального атома, принадлежащими различным подуровням.
Таким образом, при гибридизации s - и p -орбиталей образуются две равноценные sp -гибридные орбитали (s + p = 2 sp). По аналогии: при комбинации одной s - и двух p -орбиталей s + p + p = 3 sp 2, образуются три равноценные sp 2-гибридные орбитали; s + p + p + p = =4 sp 3, образуются четыре равноценные sp 3-гибридные орбитали.
Гибридные орбитали центрального атома располагаются под определенным углом (валентный угол), чтобы образовалась устойчивая молекула: при гибридизации типа sp валентный угол составляет 180о; sp 2 – 120о; sp 3 – 109о. Расположение гибридных орбиталей под определенным углом показано в табл. 3.1.
Таблица 3.1
Расположение гибридных орбиталей в пространстве
при различных типах гибридизации
| Тип гибридизации: | sp | sp 2 | sp 3 |
| Расположение гибридных орбиталей в пространстве |

| 
| 
|
| Теоретический валентный угол | 180 о | 120 о | 109 о |
Разберем вопрос о пространственной структуре молекулы. Пространственная структура молекулы связана с типом гибридизации и расположением боковых атомов вокруг центрального атома (табл. 3.2).
Таблица 3.2
Пространственная структура молекул
при различных типах гибридизации
| Тип гибри- дизации | sp | sp 2 | sp 3 | sp 3 | sp 3 | ||
| Простран- ственная структура молекулы |


| 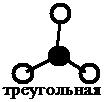
| 
| 
| 
|
Как видно из табл. 3.2, при sp 3-гибридизации может реализоваться тетраэдрическая форма, пирамидальная или угловая в зависимости от числа боковых атомов (4, 3, 2 – соответственно). В данном типе гибридизации могут оставаться неиспользованные орбитали, которые влияют на величину валентного угла.
В качестве примера рассмотрим молекулу CdI2. Выписываем валентные электроны центрального атома 48Cd и валентные электроны йода 53I:
 |
Для образования связей с двумя атомами йода необходимо 5 s электроны центрального атома перевести в возбужденное состояние.
 |
 .
.
Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис. 3.5.

Рис. 3.5. Процесс sp -гибридизации
Таким образом, в центральном атоме молекулы CdI2 реализуется sp -гибридизация, и в соответствии с данными табл. 3.1 валентный угол составляет 180о.
Образование молекулы происходит за счет перекрывания полученных гибридных орбиталей центрального атома с валентными орбиталями соседних атомов. «Подводя» валентные орбитали йода к гибридным орбиталям кадмия, получаем схему молекулы CdI2 (рис. 3.6).
I Cd I

Рис. 3.6. Линейная конфигурация молекулы CdI2
Из рис. 3.6 следует, что рассматриваемая молекула CdI2 имеет линейную форму и две ковалентные связи σ-типа, так как область перекрывания орбиталей находится по оси, соединяющей ядра атомов. Связь Cd–I является полярной, поскольку более электроотрицательным элементом является йод.
Молекула CdI2 неполярна, так как при наличии двух диполей оттягивание электронов идет в обе стороны одинаково, и дипольные моменты взаимно компенсируются.
Для примера гибридизации sp 3-типа рассмотрим молекулу OF2.
Выписываем валентные электроны центрального атома – кислорода 2 s 22 p 4 и валентные электроны фтора 2 s 22 p 5


Так как у атома кислорода в четырех орбиталях имеются лишь два неспаренных электрона, то он может образовать две связи.
У фтора имеется один неспаренный электрон. По представле-ниям Льюиса, молекула OF2 может быть изображена следующим образом:
 .
.
Далее определяем тип гибридизации центрального атома – кислорода. Для этого производим «сложение»: s + p + p + p = 4 sp 3. Рисуем четыре оси и гибридные облака. Подводим валентные орбитали фтора F (это р -элемент). Получаем угловую молекулу с валентным углом 104о, отклонение от значения теоретического валентного угла 109о связано с наличием двух неподеленных пар электронов у центрального атома (рис. 3.7).

Рис. 3.7. Угловая конфигурация молекулы OF2
Связи О–F – полярные, поскольку разность электро-отрицательностей составляет |4,0–3,5|=0,5. Молекула в целом тоже полярна, так как в вершине угла заряд со знаком «+», а в противоположной стороне «–». Происходит оттягивание электронов в сторону F, т.е. образуется диполь. Две связи О–F – ковалентные, σ-типа.
Установление типа гибридизации центрального атома и пространственной структуры молекулы соответствует определенному алгоритму.
Алгоритм определения типа гибридизации:
1) определить валентные электроны центрального атома;
2) если возможно и необходимо, изобразить возбужденное состояние атома;
3) изобразить связи с использованием формулы Льюиса;
4) провести сам процесс гибридизации (смешение, выравнивание атомных орбиталей) и определить тип гибридизации;
5) нарисовать оси, по которым расположить гибридные атомные орбитали;
6) указать неподеленные пары электронов;
7) показать образование связей в молекуле перекрыванием гибридных атомных орбиталей центрального атома с атомными орбиталями других атомов.
Определив пространственную структуру молекулы, можно приступить к оценке полярности молекулы.
Следует отличать полярность молекул от полярности связи. Для двухатомных молекул эти понятия совпадают. Для многоатомных молекул полярность оценивается исходя из:
1) полярности отдельных связей, которая учитывается по разности электроотрицательностей соединяющихся атомов либо по величине электрического момента диполя,
2) пространственной конфигурации молекулы, так как дипольный момент молекулы равен сумме векторов дипольных моментов всех связей и неподеленных пар электронов. Результат сложения зависит от конфигурации молекулы, если молекула симметрична, то она неполярна (даже если связи полярны).
3.3. Ионная связь. Механизм образования и свойства ионной связи
Ионы – положительно или отрицательно заряженные частицы, обладающие подвижностью в водных растворах.
Ионы, образующиеся из атомов, называют простыми, из групп атомов – сложными.
По характеру заряда их разделяют на анионы и катионы.
Таблица 3.3
Примеры простых и сложных катионов и анионов
| Катионы | Анионы | ||
| простые | сложные | простые | сложные |
| Na+, K+; Ca2+, Zn2+, Al3+, Sc3+ | NH4+, комплексные ионы | I  , Br , Br  ,
Cl ,
Cl  , F , F  , S , S 
| NO  , NO , NO  , OH , OH  , CN , CN  , SCN , SCN  , SO , SO  , SO , SO  , PO , PO 
|
Ионная связь – это связь между элементами, легко образующими ионы, основанная на электростатическом взаимодействии.
 Свойства ионной связи:
Свойства ионной связи:
 |  |  | |||
прочность ненаправленность ненасыщаемость полярность
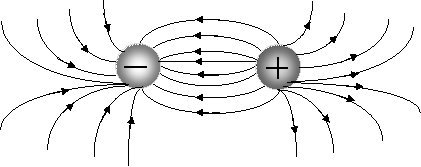
Ионная связь менее прочная, чем ковалентная. Ионы можно представить как жесткие, несжимающиеся шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве (рис. 3.8).
 | |||
 |
Рис. 3.8. Распределение электрических силовых полей двух разноименных ионов
Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, следовательно, ионная связь ненаправлена и полярна.
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей и сохраняется способность притягивать дополнительные ионы, следовательно, ионная связь ненасыщаема.
Соединения с ионной связью имеют кристаллическую структуру и обладают низкой температурой плавления. Соединения, образованные из простых ионов, малочисленны, это соединения типичных металлов с типичными неметаллами, например NaBr, CsCl, KF, RbCl.
|
|
|

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2026 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!