Химический эквивалент – это условная частица, равноценная (которая соединяется или замещается) по химическому действию одной единице водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Эквивалент можно представить в виде фактора эквивалентности. В этом случае фактор эквивалентности записывается как коэффициент перед формулой частицы:
Э(х) = f экв(х) х.
Фактор эквивалентностиf экв (х) – это число, обозначающее какая доля условной формульной частицы реагирует с одним ионом водорода в данной кислотно-основной реакции или с одним электроном в данной окислительно-восстановительной реакции.
Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Фактор эквивалентности рассчитывается для каждой реакции отдельно и равен  :
:
для элемента х z равен валентностиэлемента;
для кислот, Hn+(KO)n-z – число ионов водорода, замещающихся в данной реакции;
для оснований, Mez+(OH)z z – число ОН- -групп, вступающих в данную реакцию;
для солей, Menz+(KO)zn- z – произведение числа катионов на заряд катиона;
для окислителей (восстановителей) z – числу электронов, которое принимает (отдает) одна формульная единица окислителя (восстановителя).
Молярная масса эквивалента вещества – масса одного моля эквивалента этого вещества, равна произведению молярной массы веществах на фактор эквивалентности
М(Э(х)) = М(х) f экв (х), г/моль,
где М(х) – молярная масса вещества х,
f экв (х) – фактор эквивалентности вещества х.
Молярная масса эквивалента определяется по конкретной химической формуле и зависит от того, в реакции какого типа участвует данное вещество. Следовательно, она изменяется в зависимости от конкретной химической реакции, в которой участвует данное вещество.

а) Молярная масса эквивалента элемента х связана с атомной массой элемента соотношением: М(Э(х)) =  .
.
Для реакции: Zn + 2HCl = ZnCl2 + H2, молярная масса эквивалента цинка М(Э (Zn )) = 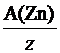 =
=  .
.
б) Молярная масса эквивалента кислоты Hn+(KO)n- может быть вычислена как частное от деления молярной массы кислоты, на число ионов водорода замещающихся в данной реакции.
М(Э(Hn+(KO)n-)) = М(Hn+(KO)n-)∙ f экв (Hn+(KO)n-). М(Э(кислоты)) = М(кислоты) f экв (кислоты).
Так, для реакций трехосновной фосфорной кислоты возможны несколько случаев взаимодействия (табл.1.2).
Таблица 1.2
Примеры расчета молярной массы эквивалента кислоты
| №
| Уравнение реакции
| f экв(Н3РО4)
| М(Э(H3PO4)) = =М(H3PO4) ∙ f экв (H3PO4)
|
|
| H3PO4 + KOH = KH2PO4 + H2O
|
|
|
|
| Н3РО4 + 2КОН =К2НРО4+ 2Н2О
| 1/2
| 98/2
|
|
| Н3РО4 + 3КОН = К3РО4 + 3Н2О
| 1/3
| 98/3
|
Молярная масса эквивалента фосфорной кислоты рассчитанная по формуле М(Э( H3PO4 )) = М( H3PO4 ) ∙ f экв ( H3PO4 ), будет равна 98/1, 98/2 и 98/3 соответственно.
в) Молярная масса эквивалента основания Men+(OH)n равна отношению молярной массы основания к числу ОН–-групп, вступающих в данную реакцию.
М(Э(Mez+(OH)z)) = М(Mez+(OH)z) ∙ f экв (Mez+(OH)z-). М(Э(основания)) = М(основания) f экв (основания)
г) Молярная масса эквивалента соли Menm+(KO)mn- находится как отношение молярной массы соли к произведению числа катионов на заряд катиона.
М(Э(Menz+(KO)zn-)) = М(Menz+(KO)zn-) ∙ f экв (Menz+(KO)zn-). М(Э(соли)) = М(соли) f экв (соли).
В окислительно-восстановительных реакциях молярная масса окислителя или восстановителя рассчитывается с учетом числа электронов, участвующих в процессе окисления или восстановления. например, с участием KMnO4 в кислой среде перманганат-ион восстанавливается до Mn (II)
MnO  + 8H+ + 5
+ 8H+ + 5  = Mn+2 + 4H2O.
= Mn+2 + 4H2O.
Поскольку в реакции участвуют 5 электронов, f экв (KMnO4) = 1/5, и тогда М (1/5 KMnO4) = 1/5·158 = 31,6 г/моль.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.1. Что выражает химическая формула вещества?
1.2. Какие оксиды называются кислотными, а какие основными? Приведите по 5 примеров.
1.3. Какие оксиды называются амфотерными? Приведите примеры.
1.4. Назовите вещества, состав которых представлен следующими формулами: P2O5, Na2O, N2O, Li2O, SO2, Cr2O3, CrO3, H2, O2. Отметьте основные и кислотные оксиды.
1.5. Укажите, какие из следующих веществ относятся к классу оксидов: негашеная известь, фосфорный ангидрид, сероводород, сернистый газ, аммиак, серный ангидрид. Приведите формулы указанных сложных веществ.
1.6. Перечислите ряд общих свойств, присущих типичным общеизвестным солям.
1.7. Приведите примеры 10 солей, в том числе кислых и основных. Назовите эти соли. В чем заключается различие между кислыми и основными солями?
1.8.. Что называется эквивалентом элемента, эквивалентом сложного вещества, молярной массой эквивалента?
1.9. Сформулируйте закон эквивалентов.
1.10. Определите молярную массу эквивалента следующих элементов:
а) серебра, если известно, что при нагревании его оксида до полного разложения масса оксида уменьшилась на 6,9 %;
б) свинца, если при нагревании 1,036 г его в токе кислорода получено 1,116 г оксида;
в)натрия и серы, если известно, что 2,3 г натрия непосредственно реагируют с 1,6 г серы и с 3,55 г хлора; молярную массу эквивалента хлора принять равной 35,5 г.
1.11. Определите молярную массу эквивалента металла в следующих соединениях: Mn2O7, Mg2P2O7, Ba(OH)2, Al2(SO4)3, Ag2O, Ca3(PO4)2.
1.12. Как изменяются окислительные свойства кислот хлора в ряду HClO, HClO2, HClO3, HClO4? Укажите причину этой закономерности.
СТРОЕНИЕ АТОМА



 :
: 
 .
.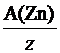 =
=  .
. + 8H+ + 5
+ 8H+ + 5  = Mn+2 + 4H2O.
= Mn+2 + 4H2O.


