

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
(распределение Больцмана)
Основное уравнение МКТ и распределение Максвелла не учитывают действия внешних сил на молекулы.
На молекулы реального газа действует поле тяготения Земли. При этом давление газа, обусловленное полем тяготения Земли и тепловым движением молекул, убывает с увеличением высоты на величину  .
.
Решая это уравнение, получим; 
Учитывая, что на уровне моря h1 = 0; Р1 = Ро = 760 мм рт ст,
получим Барометрическую формулу (зависимость давления газа от высоты)
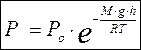
Из основного уравнения МКТ Р = n k T, концентрация может быть выражена через давление  . Тогда можно записать:
. Тогда можно записать:

где: n и no - концентрация молекул газа на высоте h и ho
M = mo NA
R = k NA

Тогда Распределение Больцмана (распределение молекул по высоте)

Из формулы следует, что на высоте h концентрация молекул (плотность газа) уменьшается с уменьшением температуры. При Т = 0 n = 0, т.е. при температуре абсолютного нуля все молекулы располагались бы на поверхности Земли.
Между распределением Больцмана и Максвелла большое сходство в основном множителе:
Распределение Максвелла 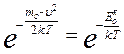
Распределение Больцмана 
где  и
и  - кинетическая и потенциальная энергия молекулы;
- кинетическая и потенциальная энергия молекулы;
kT - энергия теплового движения молекулы.
§ 6. Реальные газы. Уравнение Ван-дер-Ваальса
Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона — Менделеева pV m =RT (для моля газа), описывающее идеальный газ, для реальных газов непригодны.
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальс (1837—1923) вывел уравнение состояния реального газа. Ван-дер-Ваальсом в уравнение Клапейрона — Менделеева введены две поправки.
|
|
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не V m, а V m — b, где b — объем,занимаемый самими молекулами.
Объем b равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.

где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, V m — молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):

Для произвольного количества вещества v газа (v=m/M) с учетом того, что V=vV m, уравнение Ван-дер-Ваальса примет вид

где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
Изотермы Ван-дер-Ваальса.
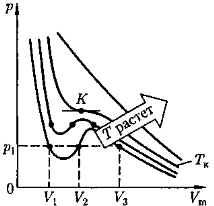 При высоких температурах (T > T к) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре T к изотерма имеет одну точку перегиба К. Ей соответствуют V к и р к.
При высоких температурах (T > T к) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре T к изотерма имеет одну точку перегиба К. Ей соответствуют V к и р к.
Эта изотерма называется критической, а состояние с критическими параметрами (p к, V к, T к) - критическим состоянием
|
|
При низких температурах (Т < T к) изотермы имеют волнообразный участок.

На участках 1 — 3 и 5 — 7 при уменьшении объема V m давление р возрастает.
На участке 3—5 сжатие вещества приводит к уменьшению давления (для газа такие состояния в природе не осуществляются). Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы.
Таким образом, истинная изотерма будет иметь вид ломаной линии 7-6-2-1.
Участок:
6–7 - газообразное состояние;
2 – 1 - жидкое состояние;
6—2 - равновесие жидкой и газообразной фаз.
Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
ОСНОВЫ ТЕРМОДИНАМИКИ
Первое начало термодинамики
Средняя энергия молекул
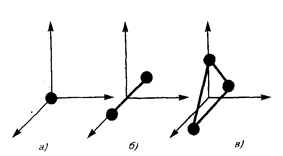
Число степеней свободы молекулы ( i ) - это число независимых координат, определяющих положение молекулы в пространстве.
Только поступательно движутся одноатомные молекулы. Двух- и многоатомные молекулы могут совершать еще и вращательное движение.
а) Для одноатомных молекул (Ne, Ar,He)
i1 = 3 (поступательное движение вдоль x, y, z).
б) Для двухатомных газов (H2, O2, CO, N2)
i2 = 3пост. + 2вращат. = 5 (поступательное движение вдоль x, y,z и
вращательное движение вокруг х, у)
в) Для трех и более атомных газов (СО2, Н2О, NH4, NO2)
i2 = 3пост. + 3вращат. = 6
Из сравнения формул  и
и  следует, что
следует, что 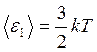 , т.е. средняя энергия молекул зависит только от температуры и не зависит от массы молекулы.
, т.е. средняя энергия молекул зависит только от температуры и не зависит от массы молекулы.
Т.к. 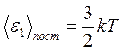 , то на одну степень свободы поступательного движения
, то на одну степень свободы поступательного движения
приходится энергия 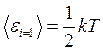 .
.
Закон Больцмана о равномерном распределении энергии по степеням свободы:
На каждую степень свободы (поступательного и вращательного движения) приходится одинаковая энергия, равная 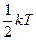 , а полная энергия одной молекулы
, а полная энергия одной молекулы
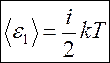
|
|
|

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!