

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Уравнение состояния идеального газа
(уравнение Менделеева – Клапейрона)
1) уравнение Клапейрона для постоянной массы идеального газа:
 или
или 
2) Менделеев объединил уравнение Клапейрона с законом Авогадро и получил уравнение состояния для одного моля идеального газа
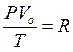
3) уравнение Менделеева - Клапейрона для любой массы газа:
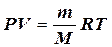 или
или 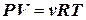
4) Основное следствиеиз уравнения из уравнения Менделеева-Клапейрона:
Учитывая, что 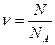 иk =
иk = 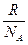 , это уравнение можно представить в виде
, это уравнение можно представить в виде
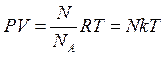 или
или  ,
,
т.е. давление идеального газа при данной температуре прямо пропорционально концентрации его молекул: P = nkT
При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. (При н.у. оно равно числу Лошмидта)
Основные законы идеального газа
Изопроцессы –это процессы, протекающие при каком-либо постоянном параметре.
1. Изотермический процесс (Т = const).
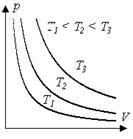
Уравнение изотермы идеального газа
 или
или 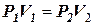
Это уравнение выражает закон Бойля-Мариотта.
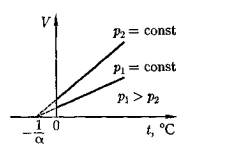 2. Изобарный процесс (Р = const).
2. Изобарный процесс (Р = const).
Уравнение изобары идеального газа: 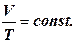 или
или 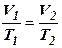
Уравнение изобары может быть записано в виде закона Гей – Люссака:
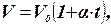
где V0 - объём при 00 С,
a = 1/273 0С-1- термический коэффициент объёмного расширения, который
одинаков для всех газов:
.Закон Гей-Люссака выполняется только при достаточно высоких температурах, когда корректными могут считаться ограничения модели идеального газа. При понижении температуры, когда расстояния между молекулами становятся соизмеримыми с их размерами, наблюдается отклонение зависимости от линейной и на графиках эта область изображена пунктиром.
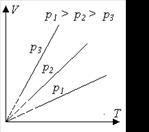
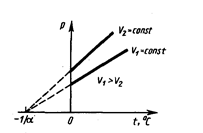
3. Изохорный процесс (V = const)

|
|
Уравнение изохоры идеального газа 
Уравнение изохорного процесса может быть записано в виде закона Шарля:

где р0 - давление при 00 С,
b = 1/273 0С-1 - термический коэффициент давления.
Закон выполняется только в области достаточно высоких температур, где действительно можно пренебрегать в расчётах размерами молекул. При понижении температуры, когда межмолекулярное взаимодействие становится существенным, наблюдается отклонение зависимости от линейной (пунктирная обл.).
Основное уравнение МКТ
Изотермы Ван-дер-Ваальса.
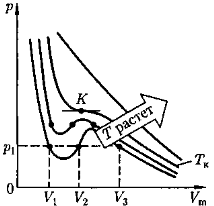 При высоких температурах (T > T к) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре T к изотерма имеет одну точку перегиба К. Ей соответствуют V к и р к.
При высоких температурах (T > T к) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре T к изотерма имеет одну точку перегиба К. Ей соответствуют V к и р к.
Эта изотерма называется критической, а состояние с критическими параметрами (p к, V к, T к) - критическим состоянием
При низких температурах (Т < T к) изотермы имеют волнообразный участок.

На участках 1 — 3 и 5 — 7 при уменьшении объема V m давление р возрастает.
На участке 3—5 сжатие вещества приводит к уменьшению давления (для газа такие состояния в природе не осуществляются). Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы.
Таким образом, истинная изотерма будет иметь вид ломаной линии 7-6-2-1.
Участок:
6–7 - газообразное состояние;
2 – 1 - жидкое состояние;
6—2 - равновесие жидкой и газообразной фаз.
Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
ОСНОВЫ ТЕРМОДИНАМИКИ
Первое начало термодинамики
Средняя энергия молекул
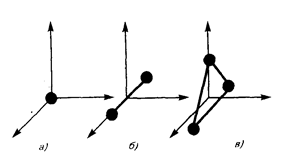
Число степеней свободы молекулы ( i ) - это число независимых координат, определяющих положение молекулы в пространстве.
|
|
Только поступательно движутся одноатомные молекулы. Двух- и многоатомные молекулы могут совершать еще и вращательное движение.
а) Для одноатомных молекул (Ne, Ar,He)
i1 = 3 (поступательное движение вдоль x, y, z).
б) Для двухатомных газов (H2, O2, CO, N2)
i2 = 3пост. + 2вращат. = 5 (поступательное движение вдоль x, y,z и
вращательное движение вокруг х, у)
в) Для трех и более атомных газов (СО2, Н2О, NH4, NO2)
i2 = 3пост. + 3вращат. = 6
Из сравнения формул  и
и  следует, что
следует, что 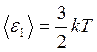 , т.е. средняя энергия молекул зависит только от температуры и не зависит от массы молекулы.
, т.е. средняя энергия молекул зависит только от температуры и не зависит от массы молекулы.
Т.к. 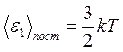 , то на одну степень свободы поступательного движения
, то на одну степень свободы поступательного движения
приходится энергия 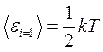 .
.
Закон Больцмана о равномерном распределении энергии по степеням свободы:
На каждую степень свободы (поступательного и вращательного движения) приходится одинаковая энергия, равная 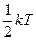 , а полная энергия одной молекулы
, а полная энергия одной молекулы
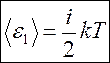
Первое начало термодинамики
(закон сохранения энергии в тепловых процессах)
Изменение внутренней энергии может быть достигнуто двумя путями:
a) Путем теплопередачи (нагрев или охлаждение);
b) Путем совершения над системой работы сжатия или расширения.
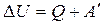
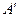 - работа, которую совершают над газом
- работа, которую совершают над газом
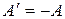 А – газ совершает работу против внешних сил
А – газ совершает работу против внешних сил
Тогда:
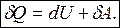 или
или 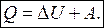
(в дифференциальной форме) (в интегральной форме)
| Бесконечно малое приращение внутренней энергии является полным дифференциаломdU функции. Элементарные работа и количество теплоты не являются полными дифференциалами и для них приняты обозначения dA и dQ. |
4. Работа газа при изменении объема

Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде. Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу 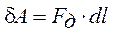
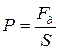
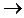
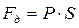
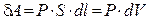
 Полную работу А, совершаемую газом при изменении его объема от V 1 до V 2, найдем интегрированием
Полную работу А, совершаемую газом при изменении его объема от V 1 до V 2, найдем интегрированием 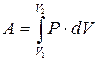
при P = const: 
Если  , то
, то 
(на графике работа равна площади под кривой)
§ 8 Теплоемкость и ее зависимость от вида процесса
Теплоемкост ь - это количество теплоты, которое нужно подвести к газу для изменения его температуры на один градус.
 [Дж / К]
[Дж / К]
Различают:
a) Удельная теплоемкость – это количество теплоты для нагревания 1 кг на один градус

 [Дж /кг К]
[Дж /кг К]
b) Молярная теплоемкость - это количество теплоты для нагревания 1 моля на один градус
|
|
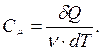 [Дж /моль К]
[Дж /моль К]



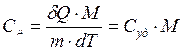

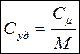
Теплоемкость зависит от вида процесса:
1. V = const
Для 1 моля газа 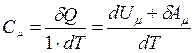
при V = const  ;
; 
 →
→ 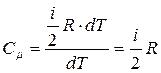

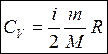
(для одного моля) (для газа массой m)
2. P = const
Для 1 моля газа: 
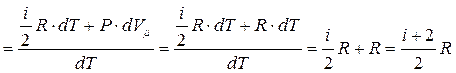
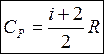

(для одного моля) (для газа массой m)
Связь между молярной CP и CV дает уравнение Майера: 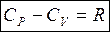
Физический смысл универсальной газовой постоянной R = 8,31 [Дж / К]: это работа изобарного расширения, которую совершает 1 моль идеального газа при его нагревании на 1 градус.
Вывод 1: Чтобы нагреть 1 моль газа на 1 градус при постоянном давлении (Ср) нужно затратить больше теплоты, чем при постоянном объеме 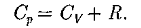 .
.
Это объясняется тем, что при изохорном процессе тепло расходуется только на изменение внутренней энергии газа, а при изобарном процессе кроме изменения внутренней энергии газа необходимо еще дополнительное количество теплоты на работу по расширению газа.
Для каждого газа характерной величиной является отношение CP и CV:
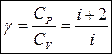 при i = 3 γ = 1,67
при i = 3 γ = 1,67
i =5 γ = 1,4
i = 6 γ = 1,33
Вывод 2: Чтобы нагреть 1 моль газа на 1 градус при постоянном давлении, нужно в γ раз больше теплоты, чем при постоянном объеме.
К различным изопроцессам
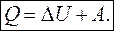 или
или 
1. Изохорный процесс (V = const)
А = P·ΔV =0 (т.к. ΔV = 0)

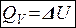 или
или 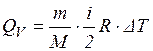
То есть все количество теплоты идет на изменение внутренней энергии (на повышение температуры).
2. Изобарный процесс (P = const)
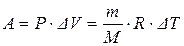
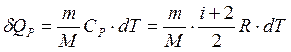
 или
или 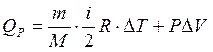
То есть количество теплоты идет на изменение внутренней энергии и на работу по расширению газа.
3. Изотермический процесс (T = const)
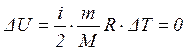 (т.к. ΔT = 0)
(т.к. ΔT = 0)
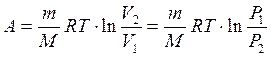
 или
или 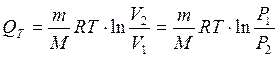
То есть количество теплоты идет только на совершение работы по расширению газа.
4. Адиабатический процесс (Q = 0)
Это процесс, идущий без теплообмена с окружающей средой.:
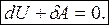 или
или 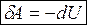
То есть система совершает работу вследствие уменьшения внутренней энергии.
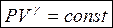 уравнение Пуассона (уравнение адиабаты)
уравнение Пуассона (уравнение адиабаты)
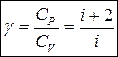 показатель адиабаты
показатель адиабаты
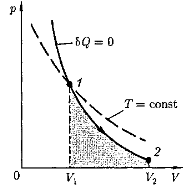
График зависимости между параметрами состояния идеального газа при Q =.0 называется адиабатой. Адиабата в координатах р, V изображается гиперболой. На рисунке видно, что адиабата более крутая, чем изотерма. Это объясняется тем, что при адиабатном сжатии увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры
|
|
Работа при адиабатном процессе:
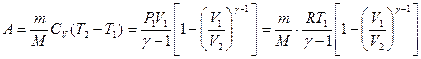
Круговые процессы (циклы)
Это процессы, в результате которых термодинамическая система возвращается в исходное состояние. На диаграмме процессов цикл изображается замкнутой кривой. Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1 — 2) и сжатия (2 — 1) газа.
 |
а) б)
Работа расширения (определяется площадью фигуры 1a2V 2 V 1 1) положительна (d V >0), работа сжатия (определяется площадью фигуры 2b1V 1 V 2 2) отрицательна (d V< 0 ). Следовательно, работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой.
Если за цикл совершается положительная работа A= 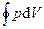 > 0 (цикл протекает по часовой стрелке), то он называется прямым (рис. а), если за цикл совершается отрицательная работа A=
> 0 (цикл протекает по часовой стрелке), то он называется прямым (рис. а), если за цикл совершается отрицательная работа A= 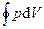 < 0 (цикл протекает против часовой стрелки), то он называется обратным (рис. б).
< 0 (цикл протекает против часовой стрелки), то он называется обратным (рис. б).
Прямой цикл используется в тепловых двигателях — периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах — периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой
Цикл Карно и его КПД
Французский физик Никола Леонард Сади Карно, (1796 - 1832 г.г.) разработал теоретические основы и принцип действия тепловых машин. По назначению они делятся на тепловые двигатели (а) и холодильные машины (б)
 Тепловые двигатели (рис. а) трансформируют теплоту в работу. При этом рабочее тело совершает прямой цикл, получает теплоту Q1 от нагревателя, совершает работу A = Q1 - | Q2 | и отдаёт теплоту Q2 холодильнику.
Тепловые двигатели (рис. а) трансформируют теплоту в работу. При этом рабочее тело совершает прямой цикл, получает теплоту Q1 от нагревателя, совершает работу A = Q1 - | Q2 | и отдаёт теплоту Q2 холодильнику.
В холодильных машинах (рис. б) при выполнении работы внешними телами тепло от охлаждаемого тела передаётся во внешнюю среду.
Теорема Карно: наибольшим КПД обладают машины, работающие по обратимому циклу. При этом КПД определяется только температурами нагревателя и холодильника и не зависит от конструкции машины.
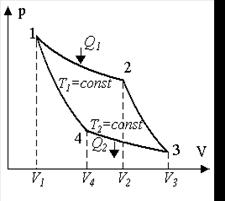
Наиболее экономичным Карно предложил цикл, состоящий из двух изотерм и двух адиабат.
1 – 2 - изотермическое расширение при Т1
2 – 3 – адиабатное расширение
3 – 4 - изотермическое сжатие при Т2
4 – 1 – адиабатное сжатие
КПД цикла Карно: 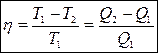
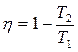 → КПД меньше 1 (100%) даже для идеального процесса.
→ КПД меньше 1 (100%) даже для идеального процесса.
Энтропия
Второе начало термодинамики
1) Формулировка Клаузиуса (1850 г.): теплота не может сама собою переходить от менее нагретого тела к более нагретому.
2) Формулировка Кельвина (1851 г.): нельзя создать тепловую машину, действующую периодически, которая бы непрерывно преобразовывала теплоту в работу только вследствие охлаждения одного тела так, чтобы в окружающих телах не происходило одновременно определённых изменений.
|
|
3) Формулировка Оствальда: вечный двигатель второго рода невозможен. (вечный двигатель - это тепловая машина, которая бы могла работать вопреки формулировке Клаузиуса).
4) Второе начало термодинамики – это закон возрастания энтропии:
Уравнение состояния идеального газа
(уравнение Менделеева – Клапейрона)
1) уравнение Клапейрона для постоянной массы идеального газа:
 или
или 
2) Менделеев объединил уравнение Клапейрона с законом Авогадро и получил уравнение состояния для одного моля идеального газа
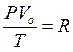
3) уравнение Менделеева - Клапейрона для любой массы газа:
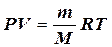 или
или 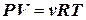
4) Основное следствиеиз уравнения из уравнения Менделеева-Клапейрона:
Учитывая, что 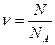 иk =
иk = 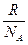 , это уравнение можно представить в виде
, это уравнение можно представить в виде
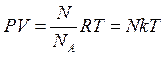 или
или  ,
,
т.е. давление идеального газа при данной температуре прямо пропорционально концентрации его молекул: P = nkT
При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. (При н.у. оно равно числу Лошмидта)
|
|
|

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!