

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
Топ:
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Дисциплины:
|
из
5.00
|
Заказать работу |
Определение на основании экспериментальных данных о зависимости концентраций от времени проведения процесса параметров кинетического уравнения – порядка реакции и значения константы скорости – составляет так называемую обратную задачу химической кинетики.
Знание кинетического уравнения реакции в дифференциальной форме позволяет определить время достижения некоторой заданной концентрации реагирующего вещества (или продукта реакции).
Пусть, например, протекает реакция
aA + bB + … → продукты,
кинетическое уравнение которой:

Тогда время достижения некоторой концентрации вещества А можно определить, интегрируя кинетическое уравнение реакции в дифференциальной форме:

Решая дифференциальное уравнение

можно получить зависимость концентрации реагирующего вещества (или продукта реакции) от времени проведения процесса – так называемых кинетических кривых.
Определение – на основании феноменологической модели процесса – концентраций реагентов от времени проведения реакции составляет прямую задачу химической кинетики.
Отметим сразу, что аналитически не всегда удаётся решить дифференциальное уравнение, особенно в случае сложной кинетики.
В этом случае прибегают к численным методам решения и использование компьютерной математики. В частности, применение математических пакетов, например, таких, как Mathcad, становится незаменимым инструментом в исследовательской практике и в процессе обучения.
Реакция первого порядка
Реакция первого порядка может быть записана в общем виде:
аA®продукты
Примером такой реакции может служить реакция разложения диметилового эфира:
CH3OCH3® CH4 + H2 + CO
Кинетическое уравнение реакции первого порядка можно представить дифференциальным уравнением
 (1.5)
(1.5)
Тогда время t достижения некоторой концентрации диметилового эфира CH3OCH3 можно определить, интегрируя соотношение (1.5):
 ,
,
где С и C0 – концентрация CH3OCH3 в момент времени t и t=0.
Интегрирование приводит к выражению
 (1.6)
(1.6)  И тогда зависимость концентрации исходного вещества CH3OCH3 от времени проведения процесса:
И тогда зависимость концентрации исходного вещества CH3OCH3 от времени проведения процесса:
 . (1.7)
. (1.7)
Из (1.7) следует, что концентрация исходного вещества со временем изменяется по экспоненциальному закону:
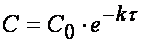
Проиллюстрируем изменение концентрации в зависимости от времени на примере реакции первого порядка
A ----> B
с начальной концентрацией  моль/л и константой скорости при некоторой температуре k=0.05 1/c
моль/л и константой скорости при некоторой температуре k=0.05 1/c



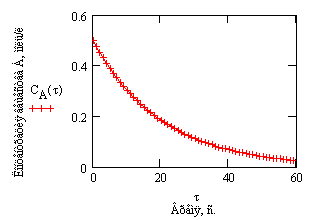
Рис.1. Зависимость концентрации
от времени в реакции первого порядка.
и, в логарифмических координатах, согласно зависимости


|


|

|

Рис.2. Зависимость логарифма концентрации
исходного вещества от времени в реакции
первого порядка.
Поскольку
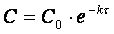
и скорость реакции по веществу А определяется как
 ,
,
то зависимость скорости реакции первого порядка можно выразить соотношением
 ,
,
иллюстрацией которого служит рис.3.



Рис.3.Зависимость скорости реакции первого
порядка от времени протекания процесса.
Здесь можно посмотреть Mathcad документ >>>>>>>>
Итак, если реакция протекает по первому порядку, то концентрация реагирующего вещества во времени меняется по уравнению (1.7)
 (1.7)
(1.7)
Графически в координатах (lnc, t) эта зависимость линейна с тангенсом угла наклона, равным tgά= –  (рис.1.).
(рис.1.).
Немного преобразовав (1.7)

получим

откуда
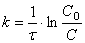 (1.9)
(1.9)
или
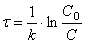 (1.10)
(1.10)
Соотношение (1.10) позволяет определить время достижения некоторой заданной концентрации исходного вещества при протекании реакции первого порядка.
Рассчитаем период полупревращения (или полураспада) τ1/2, т.е. время, необходимое для того, чтобы прореагировала половина исходного количества вещества.
Подставляя C =(1/2)C0 в (1.9), получим

откуда
 (1.11)
(1.11)
Степень превращения  вводится соотношением
вводится соотношением
 (1.12) где
(1.12) где  - исходная концентрация и С – концентрация в момент времени
- исходная концентрация и С – концентрация в момент времени 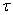 .
.
Таким образом, степень превращения определяет долю исходного вещества, прореагировавшую к моменту времени 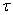 .
.
Естественно, что
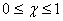
Тогда текущую концентрацию реагента в момент времени 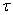 можно выразить через степень превращения
можно выразить через степень превращения  :
:

и кинетическое уравнение реакции первого порядка

можно выразить через степень превращения

и
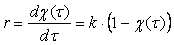 (1.13)
(1.13)
Соотношение (1.13) позволяет определить время достижения некоторой заданной степени превращения исходного вещества при протекании реакции первого порядка
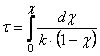 (1.14)
(1.14)
После интегрирования (1.13) получим:
 (1.15)
(1.15)
Степень превращения в зависимости от времени проведения процесса изменяется согласно
 (1.16)
(1.16)
Особенностью реакции первого порядка является независимость периода полупревращения от концентрации реагента.
Обратная величина константы скорости реакции первого порядка имеет физический смысл средней продолжительности жизни отдельной молекулы.
Попробуйте доказать это положение.
Рассмотрим применение выведенных соотношений на конкретном примере.
Здесь можно посмотреть Mathcad документ >>>>>>>
Реакция разложения глюкозы является реакцией первого порядка, и ее кинетическое уравнение в дифференциальной форме при 350К описывается соотношением:

Или через степень превращения
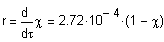
Кинетическое уравнение в интегральной форме
 ,
,
где  - начальная концентрация исходного вещества.
- начальная концентрация исходного вещества.
Или через степень превращения 
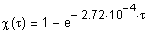
Из уравнения
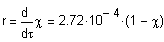
можно определить время достижения некоторой заданной степени превращения:
 (1.15)
(1.15)
Теперь, согласно уравнению

определим зависимость степени превращения от времени проведения реакции:
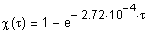 (1.16)
(1.16)
Определим зависимость времени достижения степени превращения 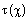 согласно (1.15), используя возможности, предоставляемые Mathcad.
согласно (1.15), используя возможности, предоставляемые Mathcad.

|
Ввод степени превращения – исследуется
зависимость времени достижения степени
превращения 
 Ввод расчётной формулы.
Ввод расчётной формулы.
Вывод результата счёта.



Рис.4. Зависимость времени достижения заданной степени превращения глюкозы от степени превращения в реакции ее разложения при температуре 350К.
Определим зависимость степени превращения от времени проведения реакции согласно (1.16)
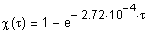 ,
,
используя возможности, предоставляемые Mathcad.
Здесь можно посмотреть Mathcad документ >>>>

|
Ввод значения константы
скорости реакции.
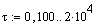
|
Ввод временного интервала,
в течении которого будем
исследовать изменение степени
превращения в зависимости от
времени проведения процесса.
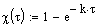 Ввод расчётной формулы
Ввод расчётной формулы
Вывод результат счёта.



Рис.5. Зависимость степени превращения
глюкозы от времени проведения процесса
в реакции её разложения при 350К.
Реакции второго порядка
К таким реакциям относят реакции, скорость которых пропорциональна концентрации каждого из реагирующих веществ или квадрату концентрации одного из них.
Рассмотрим вначале достаточно простой случай реакций вида
A + B → продукты,
тогда скорость такой реакции можно описать кинетическим уравнением
 (1.17)
(1.17)
или, если CA=CB=С, то
 (1.18)
(1.18)
Пусть  и
и  – начальные концентрации вещества A и B и пусть C – концентрация веществ А в момент времени
– начальные концентрации вещества A и B и пусть C – концентрация веществ А в момент времени 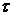 .
.
Тогда
A + B → продукты
Начальная концентрация, 

моль/л
Прореагировало к  -C
-C  -C
-C
моменту 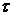
Концентрация C 
в момент 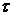
и уравнение (1.17) можно записать
 (1.19)
(1.19)
Или через степень превращения вещества А 

И после упрощений
 (1.20)
(1.20)
Если начальные концентрации веществ А и В равны, т.е., если  , тогда (1.20) превращается в
, тогда (1.20) превращается в
 (1.21)
(1.21)
Сравнив кинетические уравнения первого

и второго порядка
 ,
,
вы, наверное, обратили внимание, что размерность константы скорости реакции зависит от порядка реакции. Размерность константы скорости реакции второго порядка  .
. 
Найдем кинетическое уравнение реакции второго порядка в интегральной форме, т.е. зависимость концентрации реагирующих веществ от времени протекания процесса.
Если начальные концентрации реагирующих веществ реакции
A + B -à Продукты
равны, то, как мы показали

Тогда

И после интегрирования получим
 (1.22)
(1.22)
или
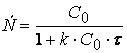
Соотношение (1.22) позволяет определить время достижения некоторой заданной концентрации исходного вещества при протекании реакции второго порядка – по-прежнему мы пока ограничиваемся случаем равенства начальных концентраций исходных веществ:
 (1.23)
(1.23)
И тогда время полупревращения для реакции второго порядка (подставляя C =(1/2)C0 в 1.23))
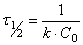 (1.24)
(1.24)
и в отличие от реакции первого порядка зависит от начальной концентрации.
Подставив в (1.22)

найдём зависимость степени превращения от времени протекания процесса:
 (1.25)
(1.25)
Напомним, что такой результат мы получим только в случае равенства начальных концентраций веществ А и В.
Проиллюстрируем изменение концентрации в зависимости от времени на примере реакции второго порядка
2A ------> B
с начальной концентрацией  =0.5моль/л и константой скорости при некоторой температуре Т
=0.5моль/л и константой скорости при некоторой температуре Т 
Согласно (1.22) зависимость концентрации исходного вещества от времени проведения процесса определяется соотношением:

Нетрудно заметить, что в координатах «обратная концентрация- – время» зависимость линейна.
Действительно, обозначим:

Тогда зависимость обратной концентрации от времени:

и зависимость скорости реакции от времени

Иллюстрацией полученных зависимостей служат рис. 6-8.

Рис. 6. Зависимость концентрации исходного вещества от времени проведения процесса

Рис.7. Зависимость обратной концентрации исходного вещества
от времени проведения процесса

Рис.8. Зависимость скорости реакции второго порядка от времени проведения процесса.
Сравним ход зависимостей концентрации исходного вещества от времени проведения процесса для реакции первого и второго порядка, разумеется, при одинаковых значениях начальных концентраций и одинаковых числовых значениях констант скоростей.

|

|

|
Соотношения, определяющие
зависимость концентрации
исходного вещества от времени
для реакции первого

|
и второго порядка

|

|
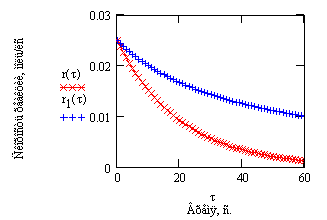
Рис.9 Зависимость концентрации исходного вещества от времени проведения процесса.  - реакция первого порядка A --->B - реакция первого порядка A --->B  - реакция второго порядка 2A -->B Начальные концентрации исходных веществ - реакция второго порядка 2A -->B Начальные концентрации исходных веществ  =0.5моль/л. Константы скорости численно равны 0.05 =0.5моль/л. Константы скорости численно равны 0.05
|
Такой ход зависимостей концентрации от времени становится понятным после сравнения зависимостей скорости реакций от времени проведения процесса.

|
Соотношения, определяющие

|

|
зависимость концентрации
исходного вещества от времени
для реакции первого

|
и второго порядка

|
|
Рис.10. Зависимость скорости реакции от времени проведения процесса.  - реакция первого порядка A --->B - реакция первого порядка A --->B  - реакция второго порядка 2A -->B Начальные концентрации исходных веществ - реакция второго порядка 2A -->B Начальные концентрации исходных веществ  =0.5моль/л. Константы скорости численно равны 0.05 =0.5моль/л. Константы скорости численно равны 0.05
|
Сравним теперь зависимости степени превращения от времени в реакции первого

и второго
порядка.
Здесь можно посмотреть Mathcad документ >>>>>>>>>>>
Ввод константы скорости реакции и начальной концентрации:


Ввод временного интервала, в котором будет исследована зависимость
степени превращения от времени проведения процесса:

Расчётные соотношения, определяющие зависимость степени превращения в
реакции первого  и второго
и второго  порядка:
порядка:

Вывод результата счёта.
Зависимость степени превращения от времени проведения процесса в реакции первого  и второго
и второго  порядка.
порядка.


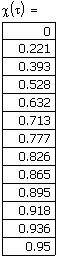

Рис.11. Зависимость степени превращения от времени проведения процесса в реакции первого  и второго
и второго  порядка.
порядка.
Если начальные концентрации реагирующих веществ не равны, необходимо интегрировать уравнение (1.14)
 (1.14)
(1.14)
Интегрирование (1.14) по частям или методом неопределённых коэффициентов приводит к выражению:
 (1.21)
(1.21)
или
 (1.22),
(1.22),
где  ,
,  и x – число молей в 1л, которое прореагировало за время τ.
и x – число молей в 1л, которое прореагировало за время τ.
Заметим попутно, что наличие современных компьютерных математических пакетов, например, таких, как Mathcad, практически устраняет трудности, возникающие при решении подобных задач.
Проиллюстрируем это небольшим примером.
Как уже упоминалось, в случае неравенства начальных концентраций при протекании процесса
A + B → продукты
кинетическое уравнение имеет вид (1.14)

|
и время, за которое прореагирует x молей, может быть рассчитано по соотношению

Тогда с помощью символьного процессора Mathcad этот интеграл легко вычисляется.
Для вычисления неопределенного интеграла от некоторого выражения, например, рассматриваемого

по определенной переменной (в нашем случае переменной является Х) выделяют в этом выражении переменную и выполняют команду Symbolcs/Variable/Integrate.
После выполнения команды появляется вычисленное аналитическое представление неопределенного интеграла:

Сравните это выражение с полученными ранее соотношениями (1.21) или (1.22)
Расчеты, основанные на аналитическом интегрировании соотношения

представлены в >>>>>>> Здесь можно посмотреть Mathcad документ
Рассмотрим еще один подход к решению задач по определению зависимости концентрации реагирующих веществ от времени проведения процесса.
Рассмотрим реакцию омыления эфира в щелочном растворе >>>>> Здесь можно посмотретьMathcad документ

Исследуемая реакция является типичной реакций второго порядка, а, значит, ее скорость описывается кинетическим уравнением (введя обозначения  и
и  )
)

При 298К константа скорости равна 
Пусть начальные концентрации равны  и
и 
Рассчитаем изменение концентраций реагирующих веществ в зависимости от времени протекания процесса.
Запишем кинетические уравнения:


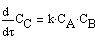
Решим систему дифференциальных уравнений, т.е. найдем зависимость концентраций исходных веществ и продуктов реакции в зависимости от времени.
Определим систему через формальную запись в Mathcad.
 ,
,
где  ,
,  .
.
Определим начальные условия
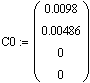
Введем значение константы скорости исследуемой реакции
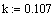
Результаты решения (с помощью имеющейся в Mathcad встроенной функции, позволяющей решать систему методом Рунге-Кутты с фиксированным шагом) представлены в матрице результатов и на рис.12.
В левом столбце матрицы находятся значения аргумента 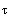 ,деля-
,деля-
щие интервал на равномерные шаги, в остальных столбцах - значения  ,
,  ,
,  и
и 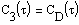 .
.

|
В левом столбце матрицы находятся значения аргумента 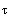 ,делящие интервал на равномерные шаги, в остальных столбцах - значения
,делящие интервал на равномерные шаги, в остальных столбцах - значения  ,
,  ,
,  и
и 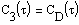 .
.

|
Рис.12. Зависимость концентрации реагирующих веществ от времени
 - концентрация эфира,
- концентрация эфира,
 - концентрация щелочи,
- концентрация щелочи,
 - концентрация спирта и
- концентрация спирта и
 - концентрация ацетат иона
- концентрация ацетат иона
в реакции омыления эфира  при 298К.
при 298К.
Начальные концентрации эфира  и щелочи
и щелочи 
Здесь можно посмотреть Mathcad документ >>>>>>>>>>>
Период полупревращения для реакции второго порядка найдем из (1.20)

Подставив C = ½ C0, получим

Откуда время полупревращения для реакции второго порядка в случае равенства начальных концентраций веществ А и В
 (1.23)
(1.23)
Для реакции второго порядка время полураспада обратно пропорционально начальной концентрации исходного вещества.
Рассмотрим общий случай реакции второго порядка:
pA + qB ------> ПРОДУКТЫ,
причём 
pA + qB ------> ПРОДУКТЫ,
Исходная концентрация,
моль/л 

Концентрация в
момент 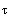


Поскольку для реакции
aA + bB +......> cC + dD +...
скорости, измеренные по компонентам реакции равны
 ,
,
то для рассматриваемого процесса
pA + qB ------> ПРОДУКТЫ
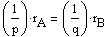
и
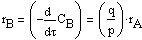
Тогда система кинетических уравнений в дифференциальной форме:

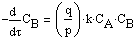 ,
,
решение которой даёт возможность исследовать изменение концентраций реагирующих веществ в зависимости от времени протекания процесса.
Для решения воспользуемся возможностями, которые предоставляет математический пакет Mathcad.
Для формальной записи в Mathcad. введём обозначения:
концентрация вещества  ,
, 

|

|
Ввод стехиометрических
коэффициентов
| Ввод начальных концентраций реагентов. | ||||||||||

| ||||||||||

| ||||||||||
| Ввод числа шагов, на которых численный метод находит решение. | ||||||||||

| ||||||||||
| Ввод системы кинетических уравнений в дифференциальной форме. | ||||||||||

| ||||||||||
| Ввод начальных концентраций. | ||||||||||

| ||||||||||
| В вод значения константы скорости реакции. | ||||||||||
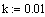
| ||||||||||

| ||||||||||

| ||||||||||
Вывод решения - здесь:  - время, - время,  - концентрация вещества А - концентрация вещества А   - концентрация вещества B - концентрация вещества B 
| ||||||||||

Рис.13. Зависимость концентраций исходных веществ от времени протекания процесса в реакции pA + qB ------> ПРОДУКТЫ  - время,
- время,  - концентрация вещества А
- концентрация вещества А  и
и  - концентрация вещества B
- концентрация вещества B 
Исследуем теперь зависимость степени превращения исходных веществ от времени протекания процесса
pA + qB ------> ПРОДУКТЫ
Поскольку текущие концентрации связаны со степенью превращения 

и
 ,
,
кинетические уравнения можно представить:


Для формальной записи в Mathcad системы дифференциальных уравнений введём обозначения:
степень превращения вещества A  ,
, 
Решим систему дифференциальных уравнений и тем самым найдём зависимость степени превращения исходных веществ от времени протекания процесса
pA + qB ------> ПРОДУКТЫ
Ввод стехиометрических коэффициентов.



 Ввод начальных концентраций реагентов.
Ввод начальных концентраций реагентов.
Ввод системы кинетических уравнений в дифференциальной форме

 Ввод начальных степеней превращения.
Ввод начальных степеней превращения.
 Ввод числа шагов, на которых численный метод находит решение.
Ввод числа шагов, на которых численный метод находит решение.
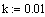 Ввод значения константы скорости реакции.
Ввод значения константы скорости реакции.

Вывод решения - здесь:  - время, - время,  - степень превращения вещества А - степень превращения вещества А   - степень превращения вещества B - степень превращения вещества B 
|


Рис. 14. Зависимость степени превращения исходных веществ от времени проведения процесса
pA + qB ------> ПРОДУКТЫ
 - время,
- время,  - степень превращения вещества А
- степень превращения вещества А  ;
;  - степень превращения вещества B
- степень превращения вещества B 
Определим теперь время достижения некоторой степени превращения  исходного вещества A при протекании реакции
исходного вещества A при протекании реакции
pA + qB ------> ПРОДУКТЫ
Кинетическое уравнение реакции

Интегрируя кинетическое уравнение, найдём соотношение, определяющее связь между степенью превращения и временем её достижения:

| Ввод стехиометрических коэффициентов. |
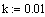
|

|

|


| В вод значения константы скорости реакции. | |||
| Ввод начальных концентраций реагентов. | |||
Ввод соотношения, определяющего интервал степени превращения  . Степень превращения изменяется от 0 до . Степень превращения изменяется от 0 до  =0.95 с шагом 0.05 =0.95 с шагом 0.05
| |||

| |||

Ввод соотношения, определяющего связь между степенью превращения и временем её достижения.

| |||

| |||
| В ывод результата - время достижения некоторой степени превращения | |||
Вывод результата - время достижения степени превращения  Разумеется, вы можете вывести результат и при другом значении степени превращения. Разумеется, вы можете вывести результат и при другом значении степени превращения.
| |||

| |||

Рис. 15. Зависимость времени достижения степени превращения  при проведении процесса
при проведении процесса
pA + qB ------> ПРОДУКТЫ
То, что соотношение между начальными концентрациями влияет на степень превращения, следует из анализа кинетического уравнения реакции. Однако степень

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!