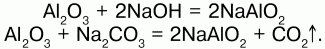Области применения многоатомных спиртов различны. Эритрит используют для приготовления взрывчатых веществ, быстросохнущих красок. Ксилит широко используется в пищевой промышленности при приготовлении диабетических продуктов, а также в производстве смол, олиф и ПАВ. Из пентаэритрита получают пластификаторы для ПВХ, синтетических масел. Манит входит в состав некоторых косметических изделий. А сорбит нашел применение в медицине в качестве заменителя сахарозы.
Представители:
Представилели многоатомных спиртов- этиленгликоль и глицерин. Двухатомные спирты, содержащие две гидроксильные группы- OH, навязываются гликолями, или диолами, трехатомные спирты, содержащие три гидроксильные группы,- глицеринами, или триолами.
Блет 3
1)Оксид алюминия – Al2O3. Физические свойства: оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы. Молекулярная масса = 101,96, плотность – 3,97 г/см3, температура плавления – 2053 °C, температура кипения – 3000 °C.
Химические свойства: оксид алюминия проявляет амфотерные свойства – свойства кислотных оксидов и основных оксидов и реагирует и с кислотами, и с основаниями. Кристаллический Аl2О3 химически пассивен, аморфный – более активен. Взаимодействие с растворами кислот дает средние соли алюминия, а с растворами оснований – комплексные соли – гидроксоалюминаты металлов:

При сплавлении оксида алюминия с твердыми щелочами металлов образуются двойные соли – метаалюминаты (безводные алюминаты):
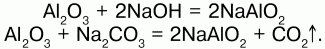
Оксид алюминия не взаимодействует с водой и не растворяется в ней.
Получение: оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия, открытый Бекетовым:

Применение: оксид алюминия применяется для производства алюминия, в виде порошка – для огнеупорных, химически стойких и аб-разивных материалов, в виде кристаллов – для изготовления лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов – Сr2О3 (красный цвет), Тi2О3 и Fe2О3 (голубой цвет).
Гидроксид алюминия – А1(ОН)3. Физические свойства: гидроксид алюминия – белый аморфный (гелеобразный) или кристаллический. Почти не растворим в воде; молекулярная масса – 78,00, плотность – 3,97 г/см3.
Химические свойства: типичный амфотерный гидроксид реагирует:
1) с кислотами, образуя средние соли: Al(ОН)3 + 3НNO3 = Al(NO3)3 + 3Н2О;
2) с растворами щелочей, образуя комплексные соли – гидроксоалюминаты: Al(ОН)3 + КОН + 2Н2О = К[Al(ОН)4(Н2О)2].
При сплавлении Al(ОН)3 с сухими щелочами образуются метаалюминаты: Al(ОН)3 + КОН = КAlO2 + 2Н2О.
Получение:
1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?;
3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-;
4) действием на соли Аl гидратом аммиака; при комнатной температуре образуется Аl(ОН)3.
2) Карбоновые кислоты – органические вещества, содержащие в молекуле одну или несколько карбоксильных групп. Карбоновыми кислотами называются производные углеводородов, которые содержат одну или несколько карбоксильных групп – С = О.
Состав карбоновых кислот.
Все органические кислоты содержат функциональную группу. Она называется карбоксильной, потому что состоит из карбонильной и гидроксильной групп.
Классификаци
Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа -СООН), дикарбоновые, или двухосновные (две группы -СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В таблице указаны некоторые представители карбоновых кислот.
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
ароматические (бензойная кислота)
алифатические (в том числе предельные (капроновая кислота) и непредельные (акриловая кислота))
алициклические (хинная кислота)
гетероциклические (никотиновая кислота).
По числу карбоксильных групп кислоты могут быть:
одноосновными (уксусная кислота)
двухосновными (щавелевая кислота)
многоосновными (лимонная кислота).
При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
Строение. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
В свою очередь, группа ОН "гасит" положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Полезно подчеркнуть следующее важное обстоятельство, часто ускользающее от внимания читателей: карбоновые кислоты не единственный (хотя и самый многочисленный) класс органических веществ, обладающих кислотными свойствами. Очень сильными органическими кислотами являются сульфокислоты — органические соединения, содержащие сульфогруппу -SО3Н (например, метансульфокислота СН3SО3Н). Особенно важное значение имеют сульфокислоты ароматического ряда и их производные. Они являются промежуточными продуктами для синтеза различных органических веществ (например, получение фенолов из сульфокислот).
Билет 5
Основные понятия химии
Химический элемент, простое и сложное вещество, аллотропия. Относительная атомная и молекулярная массы, моль, молярная масса. Валентность, степень окисления, химическая связь, структурная формула.
Практикум: Расчеты по химическим формулам, химическим уравнениям.Решение задач на нахождение химической формулы вещества. Решение задач с использованием понятия «молярная масса». Вычисления по химическим уравнениям, если одно из веществ взято в избытке, если одно из веществ содержит примеси. Решение задач на определение выхода продукта реакции
Основные представители.
Первого представителя, как правило, называют по тривиальной номенклатуре, фенол (оксибензол, устар. карболовая кислота).
При построении названий фенолов атомы углерода в бензольном кольце принято обозначать от 1 до 6, начиная с углерода, связанного с ОН-группой (номенклатура схожа с ароматическими углеводородами). Цифрами и приставками указывают положение и число заместителей, с добавлением основы – фенол.
Например:
3,5-диметилфенол 4-этилфенол
Часто для фенолов разной степени замещенности употребляют тривиальные названия.
Получение
1) Выделение из продуктов сухой каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
2) Через бензолсульфокислоту. Сначала бензол обрабатывают при нагревании концентрированной серной кислотой
C6H6 + H2SO4 = C6H5SO3H + H2O
Полученную бензолсульфокислоту сплавляют со щёлочью
C6H5SO3H + 3NaOH = C6H5ONa + 2H2O + Na2SO3
После обработки фенолята сильной кислотой получают фенол.
3) Кумольный способ (основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4). Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон (нужно рассмотреть самостоятельно).
Применение фенолов
На основе фенола получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений. Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота).
Двухатомные фенолы – пирокатехин, резорцин, а также гидрохинон (пара-дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол, полиамидов, полиэпоксидов.