Билет 2
1) Фосфор: общая характеристика элемента
Положение в периодической системе можно описать в нескольких пунктах.
Пятая группа, главная подгруппа.
Третий малый период.
Порядковый номер - 15.
Атомная масса - 30,974.
Электронная конфигурация атома 1s22s22p63s23p3.
Возможные степени окисления от -3 до +5.
Химический символ - Р, произношение в формулах "пэ". Название элемента - фосфор.
Многоатомные спирты - обширная группа химических соединений, молекулы которых имеют в своем составе более одной гидроксильной группы. Данные вещества имеют широкое практическое применение в различных отраслях.
Свойства:
Физические свойства
Данные свойства во многом зависят от строения углеводородного радикала спирта, количества гидроксильных групп, а также их положения. Таким образом, первые представители гомологического ряда – это жидкости, а высшие – это твердые вещества.
Если одноатомные спирты легко смешиваются с водой, то у многоатомных этот процесс происходит медленнее и при увеличении молекулярной массы вещества постепенно сходит на нет. За счет более сильной ассоциации молекул в подобных веществах, а значит и возникновения довольно прочных водородных связей, температура кипения спиртов высока. Диссоциация на ионы протекает в столь малой степени, что спирты дают нейтральную реакцию – окраска лакмуса или фенолфталеина не изменяется.
Химические свойства
Химические свойства данных спиртов аналогичны таковым одноатомных, то есть они вступают в реакции нуклеофильного замещения, дегидратации и окисления до альдегидов или кетонов. Последнее исключено у трехатомных спиртов, окисление которых сопровождается разрушением углеводородного скелета.
Качественная реакция на многоатомные спирты проводится с гидроксидом меди (II). При добавлении индикатора в спирт, выпадает хелатный комплекс ярко-синего цвета.
Способы получения многоатомных спиртов
Синтез данных веществ возможен путем восстановления моносахаридов, а также конденсации альдегидов с формалином в щелочной среде. Нередко многоатомные спирты получаю и из природного сырья – плодов рябины.
Наиболее употребительный многоатомный спирт – глицерин – получают путем расщепления жиров, а с внедрением новых технологии в химическую промышленность – синтетическим способом из пропилена, образующегося в процессе крекинга нефтепродуктов.
Применение многоатомных спиртов
Области применения многоатомных спиртов различны. Эритрит используют для приготовления взрывчатых веществ, быстросохнущих красок. Ксилит широко используется в пищевой промышленности при приготовлении диабетических продуктов, а также в производстве смол, олиф и ПАВ. Из пентаэритрита получают пластификаторы для ПВХ, синтетических масел. Манит входит в состав некоторых косметических изделий. А сорбит нашел применение в медицине в качестве заменителя сахарозы.
Представители:
Представилели многоатомных спиртов- этиленгликоль и глицерин. Двухатомные спирты, содержащие две гидроксильные группы- OH, навязываются гликолями, или диолами, трехатомные спирты, содержащие три гидроксильные группы,- глицеринами, или триолами.
Блет 3
1)Оксид алюминия – Al2O3. Физические свойства: оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы. Молекулярная масса = 101,96, плотность – 3,97 г/см3, температура плавления – 2053 °C, температура кипения – 3000 °C.
Химические свойства: оксид алюминия проявляет амфотерные свойства – свойства кислотных оксидов и основных оксидов и реагирует и с кислотами, и с основаниями. Кристаллический Аl2О3 химически пассивен, аморфный – более активен. Взаимодействие с растворами кислот дает средние соли алюминия, а с растворами оснований – комплексные соли – гидроксоалюминаты металлов:

При сплавлении оксида алюминия с твердыми щелочами металлов образуются двойные соли – метаалюминаты (безводные алюминаты):
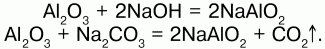
Оксид алюминия не взаимодействует с водой и не растворяется в ней.
Получение: оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия, открытый Бекетовым:

Применение: оксид алюминия применяется для производства алюминия, в виде порошка – для огнеупорных, химически стойких и аб-разивных материалов, в виде кристаллов – для изготовления лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов – Сr2О3 (красный цвет), Тi2О3 и Fe2О3 (голубой цвет).
Гидроксид алюминия – А1(ОН)3. Физические свойства: гидроксид алюминия – белый аморфный (гелеобразный) или кристаллический. Почти не растворим в воде; молекулярная масса – 78,00, плотность – 3,97 г/см3.
Химические свойства: типичный амфотерный гидроксид реагирует:
1) с кислотами, образуя средние соли: Al(ОН)3 + 3НNO3 = Al(NO3)3 + 3Н2О;
2) с растворами щелочей, образуя комплексные соли – гидроксоалюминаты: Al(ОН)3 + КОН + 2Н2О = К[Al(ОН)4(Н2О)2].
При сплавлении Al(ОН)3 с сухими щелочами образуются метаалюминаты: Al(ОН)3 + КОН = КAlO2 + 2Н2О.
Получение:
1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?;
3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-;
4) действием на соли Аl гидратом аммиака; при комнатной температуре образуется Аl(ОН)3.
2) Карбоновые кислоты – органические вещества, содержащие в молекуле одну или несколько карбоксильных групп. Карбоновыми кислотами называются производные углеводородов, которые содержат одну или несколько карбоксильных групп – С = О.
Состав карбоновых кислот.
Все органические кислоты содержат функциональную группу. Она называется карбоксильной, потому что состоит из карбонильной и гидроксильной групп.
Классификаци
Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа -СООН), дикарбоновые, или двухосновные (две группы -СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В таблице указаны некоторые представители карбоновых кислот.
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
ароматические (бензойная кислота)
алифатические (в том числе предельные (капроновая кислота) и непредельные (акриловая кислота))
алициклические (хинная кислота)
гетероциклические (никотиновая кислота).
По числу карбоксильных групп кислоты могут быть:
одноосновными (уксусная кислота)
двухосновными (щавелевая кислота)
многоосновными (лимонная кислота).
При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
Строение. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
В свою очередь, группа ОН "гасит" положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Полезно подчеркнуть следующее важное обстоятельство, часто ускользающее от внимания читателей: карбоновые кислоты не единственный (хотя и самый многочисленный) класс органических веществ, обладающих кислотными свойствами. Очень сильными органическими кислотами являются сульфокислоты — органические соединения, содержащие сульфогруппу -SО3Н (например, метансульфокислота СН3SО3Н). Особенно важное значение имеют сульфокислоты ароматического ряда и их производные. Они являются промежуточными продуктами для синтеза различных органических веществ (например, получение фенолов из сульфокислот).
Билет 5
Основные понятия химии
Химический элемент, простое и сложное вещество, аллотропия. Относительная атомная и молекулярная массы, моль, молярная масса. Валентность, степень окисления, химическая связь, структурная формула.
Практикум: Расчеты по химическим формулам, химическим уравнениям.Решение задач на нахождение химической формулы вещества. Решение задач с использованием понятия «молярная масса». Вычисления по химическим уравнениям, если одно из веществ взято в избытке, если одно из веществ содержит примеси. Решение задач на определение выхода продукта реакции
Основные представители.
Первого представителя, как правило, называют по тривиальной номенклатуре, фенол (оксибензол, устар. карболовая кислота).
При построении названий фенолов атомы углерода в бензольном кольце принято обозначать от 1 до 6, начиная с углерода, связанного с ОН-группой (номенклатура схожа с ароматическими углеводородами). Цифрами и приставками указывают положение и число заместителей, с добавлением основы – фенол.
Например:
3,5-диметилфенол 4-этилфенол
Часто для фенолов разной степени замещенности употребляют тривиальные названия.
Получение
1) Выделение из продуктов сухой каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
2) Через бензолсульфокислоту. Сначала бензол обрабатывают при нагревании концентрированной серной кислотой
C6H6 + H2SO4 = C6H5SO3H + H2O
Полученную бензолсульфокислоту сплавляют со щёлочью
C6H5SO3H + 3NaOH = C6H5ONa + 2H2O + Na2SO3
После обработки фенолята сильной кислотой получают фенол.
3) Кумольный способ (основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4). Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон (нужно рассмотреть самостоятельно).
Применение фенолов
На основе фенола получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений. Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота).
Двухатомные фенолы – пирокатехин, резорцин, а также гидрохинон (пара-дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол, полиамидов, полиэпоксидов.
Билет 6
1)Корро́зия, ржавление, ржа — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево илиполимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде:
Гидроксид железа Fe(OH)3 и является тем, что называют ржавчиной.
В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозииполимеров. Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.
Меры борьбы с коррозией
Коррозия приводит ежегодно к миллиардным убыткам, и решение этой проблемы является важной задачей. Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией. Вот почему ежегодные потери от неё в промышленно развитых странах столь велики. Истинные убытки от неё нельзя определить, оценив только прямые потери, к которым относятся стоимость разрушившейся конструкции, стоимость замены оборудования, затраты на мероприятия по защите от коррозии. Ещё больший ущерб составляют косвенные потери. Это простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов.
Идеальная защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материалов и способом их нанесения.[6]. Наиболее производительным и эффективным методом подготовки поверхности перед дальнейшей защитой субстрата являетсяабразивоструйная очистка.
Применение альдегидов.
Из альдегидов наибольшее применение имеет формальдегид. Особенности применения формальдегида: используется обычно в виде водного раствора – формалина; многие способы применения формальдегида основаны на свойстве свертывать белки; в сельском хозяйстве формалин необходим для протравливания семян; формалин применяется в кожевенном производстве; формалин оказывает дубящее действие на белки кожи, делает их более твердыми, негниющими; формалин применяется также для сохранения биологических препаратов; при взаимодействии формальдегида с аммиаком получается широко известное лекарственное вещество уротропин.
Основная масса формальдегида идет на получение фенолформальдегидных пластмасс, из которых изготавливаются: а) электротехнические изделия; б) детали машин и др. Ацетальдегид (уксусный альдегид) в больших количествах используется для производства уксусной кислоты.
Восстановлением ацетальдегида в некоторых странах получают этиловый спирт.
Получение альдегидов:
1) общим способом получения альдегидов служит окисление спиртов;
2) если накалить в пламени спиртовки спираль из медной проволочки и опустить ее в пробирку со спиртом, то проволочка, которая покрывается при нагревании темным налетом оксида меди (II), в спирте становится блестящей;
3) обнаруживается также запах альдегида.
С помощью такой реакции получается формальдегид в промышленности.
Для получения формальдегида через реактор с раскаленной сеткой из меди или серебра пропускается смесь паров метилового спирта с воздухом;
4) при лабораторном получении альдегидов для окисления спиртов могут быть использованы и другие окислители, например перманганат калия;
5) при образовании альдегида спирт, или алкоголь, подвергается дегидрированию.
Особенности реакции гидратации ацетилена:
а) сначала идет присоединение воды к ацетилену по месту одной π-связи;
б) образуется виниловый спирт;
в) непредельные спирты, в которых гидроксильная группа находится у атома углерода, который связан двойной связью, неустойчивы и легко изомеризуются;
г) виниловый спирт превращается в альдегид:
д) реакция легко осуществляется, если пропускать ацетилен в нагретую воду, которая содержит серную кислоту и оксид ртути (II);
е) через несколько минут в приемнике можно обнаружить раствор альдегида.
В последние годы разработан и получает распространение способ получения ацетальдегида окислением этилена кислородом в присутствии хлоридов палладия и меди.
Свойства
В химическом отношении это высоко реакционноспособные вещества, что обусловлено наличием в их молекуле карбонильной группы.
Высокая реакционная способность альдегидов объясняется:
а) наличием поляризованной двойной связи
б) дипольным моментом карбонила
в) наличием частичного положительного заряда на атоме углерода карбонила
Двойная связь между С и О, в отличие от двойной связи между двумя углеродами, сильно поляризована, так как кислород обладает значительно большей электроотрицательностью, чем углерод, и электронная плотность π-связи смещается к кислороду. Такая высокая поляризация определяет электрофильные свойства углерода карбонильной группы и его способность реагировать с нуклеофильными соединениями (вступать в реакции нуклеофильного присоединения). Кислород группы обладает нуклеофильными свойствами.
Характерны реакции окисления и нуклеофильного присоединения
Билет 7
1) Аминокислоты — органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы -NH2.
Простейший представитель — аминоуксусная кислота H2N-CH2-COOH (глицин)
Некоторые представители аминокислот:
1) аминоуксусная кислота Н2N-СН2-СООН;
2) аминопропионовая кислота Н2N-СН2-СН2-СООН;
3) аминомасляная кислота Н2N-СН2-СН2-СН2-СООН;
4) аминовалериановая кислота Н2N-(СН2)4-СООН;
5) аминокапроновая кислота Н2N-(СН2)5-СООН.
5. Чем больше атомов углерода в молекуле аминокислоты, тем больше может существовать изомеров с различным положением аминогруппы по отношению к карбоксильной группе.
6. Чтобы в названии изомеров можно было указывать положение группы – NH2 по отношению к карбоксилу, атомы углерода в молекуле аминокислоты обозначаются последовательно буквами греческого алфавита: а)?-аминокапроновая кислота; б)?-аминокапроновая кислота.
Получение
Аминокислоты получают различными методами, нек-рые из них предназначены специально для получения тех или иных А. Наиболее распространенными общими методами химического синтеза А. являются следующие.
1. Аминирование галоидопроизводных органических кислот. На галоидопроизводное (обычно бромзамещенную кислоту) действуют аммиаком, в результате чего галоид замещается на аминогруппу.
2. Получение А. из альдегидов путем обработки их аммиаком и цианистым водородом или цианидами. В результате такой обработки получается циангидрин, к-рый далее аминируется, образуя аминонитрил; омыление последнего дает А.
3. Конденсация альдегидов с производными глицина с последующим восстановлением и гидролизом.
Отдельные А. могут быть получены из гидролизатов белков в виде труднорастворимых солей или других производных. Напр., цистин и тирозин легко осаждаются в изо электрической точке; диаминокислоты осаждают в виде солей фосфорно-вольфрамовой, пикриновой (лизин), флавпановой (аргинин) и других кислот; дикарбоновые А. осаждают в виде кальциевых или бариевых солей, глутаминовая к-та выделяется в виде гидрохлорида в кислой среде, аспарагиновая к-та — в виде медной соли и т. д. Для препаративного выделения ряда А. из гидролизатов белка применяют также методы хроматографии и электрофореза. Для промышленных целей многие А. получают методами микробиологического синтеза, выделяя их из культуральной среды определенных штаммов бактерий.
Свойства аминокислот
Для любого спортсмена важны не только тренировки, но и теоретическая подкованность, благодаря которой можно получать высокие результаты тренировок. Для этого стоит знать свойства аминокислот, ведь этот вид спортивного питания является одним из наиболее востребованных.
Применение аминокислот
Аминокислоты широко используются в современной фармакологии. Являясь не только структурными элементами белков и других эндогенных соединений, они имеют большое функциональное значение. Некоторые из них выступают в качестве нейромедиаторных веществ. Некоторые аминокислоты нашли самостоятельное применение в качестве лекарственных средств.
Аминокислоты применяют также в качестве парентерального питания больных, то есть минуя желудочно-кишечный тракт, с заболеваниями пищеварительных и других органов; а также для лечения заболеваний печени, малокровия, ожогов (метионин), язв желудка (гистидин), при нервно-психических заболеваниях (глутаминовая кислота и т. п.). Аминокислоты применяются в животноводстве и ветеринарии для питания и лечения животных, а также в микробиологической, медицинской и пищевой промышленности.
Важно принимать аминокислоты с кофакторами, которыми обычно являются витамины, минеральные соли или другие питательные вещества, которые помогают аминокислотам в ходе процессов метаболизма в организме человека. Также важно принимать аминокислоты в комплексе, а не просто какую-то одну аминокислоту, поскольку в действие аминокислот вовлечены сложные метаболические пути, для которых необходимы разные кофакторы и другие аминокислоты.
Билет 2
1) Фосфор: общая характеристика элемента
Положение в периодической системе можно описать в нескольких пунктах.
Пятая группа, главная подгруппа.
Третий малый период.
Порядковый номер - 15.
Атомная масса - 30,974.
Электронная конфигурация атома 1s22s22p63s23p3.
Возможные степени окисления от -3 до +5.
Химический символ - Р, произношение в формулах "пэ". Название элемента - фосфор.
Многоатомные спирты - обширная группа химических соединений, молекулы которых имеют в своем составе более одной гидроксильной группы. Данные вещества имеют широкое практическое применение в различных отраслях.
Свойства:
Физические свойства
Данные свойства во многом зависят от строения углеводородного радикала спирта, количества гидроксильных групп, а также их положения. Таким образом, первые представители гомологического ряда – это жидкости, а высшие – это твердые вещества.
Если одноатомные спирты легко смешиваются с водой, то у многоатомных этот процесс происходит медленнее и при увеличении молекулярной массы вещества постепенно сходит на нет. За счет более сильной ассоциации молекул в подобных веществах, а значит и возникновения довольно прочных водородных связей, температура кипения спиртов высока. Диссоциация на ионы протекает в столь малой степени, что спирты дают нейтральную реакцию – окраска лакмуса или фенолфталеина не изменяется.
Химические свойства
Химические свойства данных спиртов аналогичны таковым одноатомных, то есть они вступают в реакции нуклеофильного замещения, дегидратации и окисления до альдегидов или кетонов. Последнее исключено у трехатомных спиртов, окисление которых сопровождается разрушением углеводородного скелета.
Качественная реакция на многоатомные спирты проводится с гидроксидом меди (II). При добавлении индикатора в спирт, выпадает хелатный комплекс ярко-синего цвета.
Способы получения многоатомных спиртов
Синтез данных веществ возможен путем восстановления моносахаридов, а также конденсации альдегидов с формалином в щелочной среде. Нередко многоатомные спирты получаю и из природного сырья – плодов рябины.
Наиболее употребительный многоатомный спирт – глицерин – получают путем расщепления жиров, а с внедрением новых технологии в химическую промышленность – синтетическим способом из пропилена, образующегося в процессе крекинга нефтепродуктов.