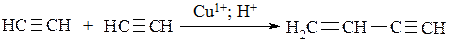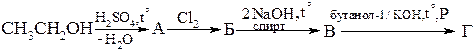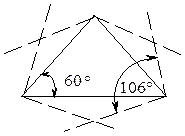В присутствии катализаторов алкины образует димеры, а также циклические тримеры и тетрамеры. Очень важное промышленное значение имеет димер – винилацетилен, который широко используется при синтезе каучуков:
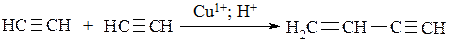
При циклотримеризации алкинов можно получить бензол (из ацетилена) или его гомологи:

Ацетилен вступает и в реакции циклотетрамеризации с образованием циклооктатетраена-1,3,5,7:
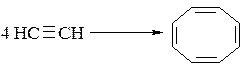
Возможна и линейная полимеризация алкинов, приводящая к полисопряжённым системам, характеризующимися полупроводниковыми свойствами.
Вопросы для самоподготовки
1. Напишите формулы трех алкинов состава C6H10, имеющих в молекулах СН-кислотные центры. Объясните причину этих свойств. Охарактеризуйте их химические свойства.
2. Используя в качестве исходных веществ СаС2 , Н2О и продукты их взаимодействия, получите уксусный альдегид, бензол, винилацетилен.
3. Напишите реакции, с помощью которых двухстадийными синтезами можно получить: а) из пропина –бутин-2; б) из ацетилена – циклогексан; в) из метана – винилхлорид; г) из карбида кальция – щавелевую кислоту
4. Из бутена-1 путём последовательных превращений получите бутин-2. Напишите для бутина-2 реакции гидратации, бромирования, гидрогалогенирования (с 1 и 2 молями HCl). Назовите все продукты реакций.
5. Установите строение двух алкинов, если известно, что при окислении их раствором перманганата калия в кислой среде из одного образовалась уксусная кислота, а из другого – пропионовая кислота и выделился CO2. Напишите уравнения качественной реакции, которой можно различить эти алкины.
6. Запишите уравнениями реакций следующие превращения. Назовите все вещества.
Глава 9. ЦИКЛОАЛКАНЫ
Циклоалканы – предельные углеводороды, в молекулах которых атомы углерода образуют циклы.
Моноциклические углеводороды, о которых будет идти речь в данной главе, классифицируют в соответствии с величиной (размером) карбоцикла. Так, если цикл построен из трёх или четырёх атомов углерода (циклопропан и циклобутан), то такие циклы называют малыми; если цикл включает пять, шесть или семь углеродных атомов, то его называют обычным; циклы, содержащие 8 – 11 углеродных атомов – средние, а 12 и более – макроциклы. Все они отвечают одной общей формуле – CnH2n.
Строение
Циклические структуры характеризуются рядом особенностей, которые не присущи алифатическим соединениям нециклического строения. Эти особенности связаны с существованием различных видов напряжения, под влиянием которых изменяются отдельные параметры молекул.
Циклопропан
Теоретически следовало бы ожидать, что в циклопропане атомы углерода, соединясь между собой, образуют правильный треугольник, в котором валентные углы С – С – С равны 60° (Рис. 9.1.). Уместно напомнить, что величина валентного угла С – С – С, типичного для sp3-гибридного состояния атома углерода равна 109,5°.
В действительности валентные углы в циклопропане равны 106°, что показано на рис. 9.1.
Это объясняется тем, что при формировании С-С связей из-за взаимного отталкивания электроных облаков перекрывание гибридных орбиталей осуществляется не вдоль оси, соединяющей центры атомов углерода, а отклоненны от этой оси в сторону. За счет этого угол увеличивается до 106°.
Рисунок 9.1. Валентные углы в циклопропане
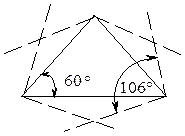
В циклопропане максимальная электронная плотность сосредоточена не между атомами углерода в цикле, а в стороне от цикла. Таким образом, углерод-углеродные связи в циклопропане «изогнуты», напоминая банан. Отсюда название «банановая» или τ-связь (Рис. 9.2.).
Следует отметить еще одну важную особенность, касающуюся вкладов атомных орбиталей в формировании С-С связи циклопропана: гибридные орбитали углеродных атомов не равноценны. Две гибридные орбитали, которые образуют углерод-углеродные связи цикла на 83% имеют р–характер, а s–характер у этих орбиталей выражен на 17%.
Рисунок 9.2. Перекрывание атомных орбиталей и образование банановых связей в циклопропане (а); распределение максимальной электронной плотности (б).

Циклобутан
Для молекулы циклобутана характерны следующие параметры: длина С–С–связи 0,155 нм, С–Н–связи 0,110 нм, угол Н–С–Н = 107°. Характерной особенностью циклобутана является то, что четыре атома углерода не находятся в одной плоскости и поэтому он существует в неплоской складчатой конформации, где одна СН2–группа отклонена под углом 25° - 30° от плоскости, в которой расположены другие три атома углерода (Рис.9.3.)

Циклопентан
Молекула циклопентана непланарна (неплоская): из-за отталкивания между атомами водорода два атома углерода выходят из плоскости цикла. Атомы углерода жестко не фиксированы, поэтому для цикла характерно постоянное волнообразное движение – псевдовращение.

Таким образом, циклопентан является неплоской молекулой и по форме напоминает «открытый конверт» (Е-конформация, от англ. envelope – конверт). Циклопентан принято называть динамической структурой: за счет внутреннего вращения по связи С – С происходит взаимный переход одной конформации в другую через Т-конформацию (Т – от англ. twisted – скрученный), называемую также конформацией «полукресла». В Т-конформации (твист – конформация) три атома углерода расположены в одной плоскости, а два других атома выведены из плоскости вверх и вниз. Более устойчивой является твист-конформация, менее устойчива – конформация конверта. Конформационные переходы возникают вследствие стереохимической нежёсткости большинства молекул, когда происходит свободное вращение вокруг простых σ-связей или деформация валентных углов.
Циклогексан
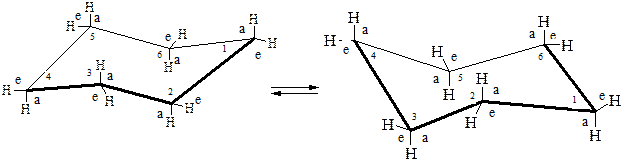
Для данной молекулы термодинамически наиболее выгодной является конформация кресла, поскольку в ней практически отсутствует как угловое, так и торсионное напряжение[1]. Характерно, что у такого конформера четыре атома углерода расположены в одной плоскости, а два других атома выведены из нее вверх и вниз. Длины С–С связей равны 0,153 нм, С–Н – 0,112 нм. Углы С–С–С составляют 111°.
В конформации кресла циклогексан имеет ось симметрии третьего порядка. Шесть связей С – Н параллельны этой оси, из них три направлены вверх, а три – вниз. Такое расположение называется аксиальным; атомы водорода находятся в аксиальном (а) положении.
Шесть других С – Н связей почти перпендикулярны указанной оси симметрии, что принято называть экваториальным (е) расположением; в этом случае говорят об экваториальном (е) положении атомов водорода.

Если происходит согласованное вращение вокруг углерод-углеродных связей, то имеет место конверсия цикла, то есть вновь образуется кресловидная конформация, но с той разницей, что все аксиальные атомы водорода становятся экваториальными, а все экваториальные – аксиальными.
При определенных условиях возможен переход циклогексана из конформации «кресла» в конформацию «ванны», энергия которой выше на 29 кДж/моль по сравнению с первой, т.е. конформация «ванны» на 29 кДж/моль менее выгодна.
Наконец, если конформацию «ванны» скручивать по центральной оси, то она переходит в твист-форму.