УДК 60–7: 001.8 (076.5)
ББК 28
Ф50
Рецензент:
Е. В. Кайгородова – доктор химических наук, профессор Кубанского государственного аграрного университета
Составители:
С. Б. Хусид, Ю. А. Лысенко, И. С. Жолобова, А. В. Лунева, С. А. Волкова
| Ф50
| Физико-химические методы анализа в биотехнологии: лаб. практикум / сост. С. Б. Хусид, Ю. А. Лысенко, И. С. Жолобова, А. В. Лунева. – Краснодар: КубГАУ, 2014. – 60 с.
|
| |
Лабораторный практикум содержит краткую теорию, схему выполнения работы, место для отчета с контрольными вопросами. После изучения теории, выполняются практические задания, их результаты заносятся в необходимые поля отчета. Каждый протокол подписывается преподавателем, ведущим лабораторное занятие.
Издание предназначено для студентов, обучающихся по специальности 110900.62 «Технология производства и переработки сельскохозяйственной продукции» и, изучающих дисциплину «Физико-химические методы анализа в биотехнологии».
УДК 60–7: 001.8 (076.5)
ББК 28
|
© Хусид С. Б., Лысенко Ю. А.,
Жолобова И. С., Лунева А. В., сост., 2014
© ФГБОУ ВПО «Кубанский
государственный аграрный
университет», 2014
ЛАБОРАТОРНАЯ РАБОТА № 1
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ В ФИЗИКО-ХИМИЧЕСКОЙ ЛАБОРАТОРИИ. ХИМИЧЕСКАЯ ПОСУДА И ЕЕ НАЗНАЧЕНИЕ.
ПОНЯТИЕ О РАСТВОРАХ, ИХ ПРИГОТОВЛЕНИЕ
Цель работы – ознакомиться с правилами техники безопасности при работе в физико-химической лаборатории, изучить основные виды химической посуды и ее назначение. Приготовить растворы различных концентраций.
Материалы и оборудование – пробирки; лабораторные стаканы; колбы плоскодонные, конические, мерные; воронки; пипетки градуированные, Мора; капельницы, мензурки; бюксы; мерные цилиндры; фарфоровые тигли; ступка и пестик; штатив; держатель для пробирок; химические реактивы; аналитические весы.
КРАТКАЯ ТЕОРИЯ
Оказание первой медицинской помощи в физико-химической лаборатории
При работе в физико-химической лаборатории наиболее вероятными случаями являются порезы стеклом, ожоги термические и химические, ингаляционные поражения парами токсических веществ, а также поражения электрическим током. Доврачебная помощь должна быть оказана пострадавшему самостоятельно или товарищами по работе.
При порезах рук стеклом в первую очередь необходимо пинцетом, промытым спиртом, удалить из раны видимые осколки стекла, затем промыть рану 2%-м раствором перманганата калия и, смазав рану 5%-м раствором йода, забинтовать.
При термических ожогах рекомендуется вначале делать примочки из 2%-го раствора перманганата калия или 96%-го этилового спирта, а затем смазать обожженный участок мазью от ожогов и наложить повязку. Причинами термических ожогов могут быть прикосновение к сильно нагретым предметам, воспламенение горючих жидкостей и сильный электрический разряд.
При химических ожогах кожи необходимо, прежде всего, удалить вызвавшее ожог вещество соответствующим растворителем. При ожогах кислотами и фенолом обожженное место обильно промывают проточной водой, а затем 2%-м раствором NaHCO3. При ожогах щелочами после обильной промывки прочной водой промывают обожженное место 2%-м раствором уксусной или борной кислоты. При попадании на кожу агрессивных органических веществ пораженный участок следует быстро промыть 96%-м этиловым спиртом, а затем смазать мазью от ожогов.
При химических ожогах глаз необходимо до обращения в медпункт промыть пострадавшему глаза вначале большим объемом воды, затем 2%-м раствором NaHCO3 (при попадании кислоты) или 2%-м раствором борной кислоты (при попадании щелочи).
При ингаляционных поражениях пострадавшего необходимо немедленно вывести (вынести) на свежий воздух, освободить от стягивающей одежды, создать ему абсолютный покой, положить на спину, тепло укутать и вызвать врача.
При поражении электрическим током, если пострадавший остается в соприкосновении с токоведущими частями, необходимо немедленно выключить свет при помощи пускателя, или перерубить токопроводящий привод изолированным инструментом.
К пострадавшему, пока он находится под током, нельзя прикасаться незащищенными руками (без резиновых перчаток)!
Если пострадавший потерял сознание, после отключения тока нужно немедленно, не дожидаясь прибытия врача, применить ему искусственное дыхание.
ВЫПОЛНЕНИЕ РАБОТЫ
1. Рассчитать и приготовить весовой 1 % раствор NaCI.
2. Рассчитать и приготовить весо-объемный 1 % раствор медного купороса.
3. Рассчитать и приготовить 0,4 % раствор NaCI из 1 %.
4. Рассчитать и приготовить 0,1 М раствор NaCI.
5. Рассчитать и приготовить 0,1 н раствор CuSO4 × 5H2O.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие правила техники безопасности необходимо соблюдать при работе в физико-химической лаборатории?
2. Правила работы с реактивами.
3. Правила работы с кислотами и щелочами.
4. Правила оказания первой медицинской помощи при порезах и ожогах.
5. Виды посуды, используемой в лаборатории.
6. Мерная посуда, ее виды и назначение.
7. Немерная посуда, ее виды и назначение.
8. Посуда специального назначения
9. Фарфоровая и пластмассовая посуда, ее назначение.
10. Дать понятие «растворам».
11. Дать понятие «величине растворимости вещества».
12. Виды растворов в зависимости от величины концентрации вещества.
13. Виды растворов в зависимости от выражения концентрации вещества.
14. Виды процентных растворов.
15. Виды титрованных растворов.
ЛАБОРАТОРНАЯ РАБОТА № 2
КРАТКАЯ ТЕОРИЯ
Электрофорез на протяжении последних десятилетий традиционно занимает важное место при исследовании белков и нуклеиновых кислот (НК). Метод позволяет разделять макромолекулы по размерам, пространственной конфигурации, вторичной структуре и заряду, что в сочетании с простотой и удобством в использовании делает его незаменимым не только для качественного, но и для количественного анализа макромолекул. Впервые, данный подход был применён шведским химиком Арне Тизелиусом в 1930-х годах для разделения белков сыворотки крови, а уже в 1948 году, эта работа была отмечена нобелевской премией. С тех пор электрофорез успешно применяется для разделения почти всех известных органических и неорганических соединений. Наибольшие успехи метода электрофореза связаны с его способностью разделять заряженные биологические макромолекулы, что нашло широкое применение не только в биологических и биохимических исследованиях, но и в биотехнологии. На протяжении многих лет электрофорез является основным методом разделения белков и нуклеиновых кислот, оставаясь одним из самых чувствительных методов.
В основе метода электрофореза лежат следующие основные принципы. В составе всех нуклеиновых кислот и белковых молекул присутствуют химические группы, обладающие в водном растворе электрическим зарядом. Под действием внешнего электрического поля заряженные молекулы могут перемещаться к катоду или аноду, в зависимости от их суммарного заряда. Такое явление и носит название электрофореза. Скорость движения молекулы в поле единичной напряжённости называется электрофоретической подвижностью и является важной характеристикой вещества. Именно различия в электрофоретической подвижности различных биологических молекул очень часто используется для разделения их смесей в аналитических или препаративных целях.
Окраска и фиксация
Для анализа результатов электрофореза, после его завершения, требуется, прежде всего, визуализовать картину распределения полос в геле. С этой целью могут применяться два основных подхода. Первый способ состоит в окрашивании ДНК специфическими красителями. Для этой цели существует большое разнообразие красителей, способных специфически окрашивать двунитевые или однонитевые участки ДНК, ДНК в составе различных комплексов или в определённой конформации. К достоинствам такого подхода можно отнести высокую чувствительность, избирательность окрашивания и дешевизну метода. Среди недостатков можно упомянуть относительную трудоёмкость процедуры, невозможность следить за ходом электрофореза в реальном времени, токсичность некоторых из широко применяемых красителей, воздействие красителей на структуру ДНК, и необходимую иногда предварительную фиксацию ДНК в геле.
Другой путь основан на способности самой ДНК поглощать свет в УФ диапазоне. Поэтому можно просканировать гель в УФ-свете и определить местоположение ДНК в геле. В настоящее время промышленностью выпускаются специальные комплексы, позволяющие следить за миграцией ДНК в геле в автоматическом режиме непосредственно в ходе электрофореза и получать оцифрованное изображение в любой момент времени. При использовании этого подхода предварительная фиксация ДНК в геле не требуется. К недостаткам подхода можно отнести малую избирательность метода и относительную дороговизну оборудования.
Наиболее распространенным красителем ДНК в экспериментах по электрофорезу является бромистый этидий. Этот краситель относится к соединениям, способным интеркалировать между парами оснований ДНК. Вещество является сильным канцерогеном и мутагеном, способным проникать через кожу. По этой причине работа с ним требует особой осторожности и соблюдения повышенных мер безопасности. При работе с бромистым этидием всегда необходимо использовать перчатки и маску. Отходы, содержащие бромистый этидий, требуют специальной утилизации.
ВЫПОЛНЕНИЕ РАБОТЫ
1. Для приготовления 1%-го геля ‒ смешайте 100 мл воды и 1 г агарозы и доведите раствор до кипения. Размешайте до ресуспендирования осевшей агарозы. В пластиковую кювету для геля установите гребенку под будущие лунки. Влейте агарозу в кювету. Агароза должна заполнить куветю полностью. Когда гель затвердеет, осторожно удалите гребенку.
2. Готовим камеру ‒ кладем пластиковую кювету с гелем в камеру, заливаем буфером так, чтобы гель скрылся под ним.
3. Вносим 5–10 мкл образца в лунки и закрываем верхней крышкой.
4. К черному штекеру присоединяем отрицательный полюс, а к красному положительный.
5. Включаем форез ‒ 120 В 20–30 мин. Возле электродов должны быть небольшие пузырьки, как индикатор, что форез пошел. ДНК двигается от минуса к плюсу, поэтому лунки с ДНК должны быть возле черного штекера (минуса).
6. Через 20–30 мин, выключаем прибор, открываем крышку и вытаскиваем кувету с гелем шипцапи или используем перчатки. В случае наличия в образце красителя, разделение можно будет увидеть невооруженным глазом, а при его отсутствии просматривают гель в УФ-свете на трансиллюминаторе и фотографируют.
ОТЧЕТ
Сделать вывод о проделанной работе. Зарисовать электрофореграмму.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте понятие электрофорезу.
2. Дайте понятие электрофорезу в агарозном геле.
3. Физические принципы электрофореза в агарозном геле.
4. Перечислите параметры, от которых зависит движение заряженных частиц в агарозном геле.
5. Перечислите компоненты, необходимые для электрофореза в агарозном геле.
6. Основные элементы установки для электрофореза в агарозном геле.
7. Объясните методы анализа результатов электрофореза, их достоинства и недостатки.
8. К какому полюсу происходит движение молекул ДНК при электрофорезе в агарозном геле и почему?
ЛАБОРАТОРНАЯ РАБОТА № 3
КРАТКАЯ ТЕОРИЯ
рН-метрия – это метод измерения в растворах концентрации ионов водорода.
Для определения величины pH существуют два основных метода: колориметрический и потенциометрический.
Колориметрический метод основан на изменении окраски индикатора, добавленного к исследуемому раствору. На сегодняшний день, существует индикаторная (универсальная) бумага, на которую нанесены индикаторные растворы. Этот метод недостаточно точен, требует введения солевых и температурных поправок, дает значительную погрешность при очень малой минерализации и при определении pH окрашенных и мутных растворов. Метод нельзя применять для растворов, содержащих сильные окислители или восстановители. Используется обычно в экспедиционных условиях и для ориентировочных определений.
Потенциометрический метод намного точнее, лишен в значительной мере всех перечисленных недостатков, но требует оборудования лабораторий специальными приборами - pH-метрами (рисунок 8). Потенциометрический метод основан на измерении ЭДС электродной системы, состоящей из индикаторного электрода и электрода сравнения. Электрод сравнения иногда называют вспомогательным электродом.
Наибольшее практическое применение нашел стеклянный индикаторный электрод, который можно использовать в широком диапазоне pH и в присутствии окислителей.
Кроме стеклянного электрода, для определения величины pH применяются также водородный, хингидронный, сурьмяный и другие электроды. Однако широкого распространения они не получили.


 Стеклянный электрод
Стеклянный электрод
Стеклянный электрод изготовляется из специальных сортов стекла, обладающих некоторой электропроводностью, достаточной, чтобы тонкую пленку из такого стекла можно было бы включить в качестве составляющей электрической цепи. Для измерения pH используется стекло, электропроводность которого обусловлена перемещением в стекле ионов H+.
Собственно стеклянный электрод представляет собой стеклянную трубку с выдутым на ее конце шариком с очень тонкой стенкой, в которую залита суспензия AgCl в растворе HCl и погружена серебряная проволока. Таким образом, внутри трубки с шариком находится хлорсеребряный электрод. Для измерения pH стеклянный электрод погружают в испытуемый раствор (тем самым не внося в него никаких посторонних веществ). В этот же раствор напрямую или через электролитический ключ погружают электрод сравнения.
Таким образом, образуется гальванический элемент, состоящий из хлорсеребрянного электрода и электрода сравнения, но внутренняя электролитическая цепь этого элемента включает электропроводную стеклянную пленку, а также исследуемый раствор. В полученной системе перенос электронов от хлорсеребрянного электрода к электроду сравнения, происходящий под действием непосредственно измеряемой разности потенциалов, неизбежно сопровождается переносом эквивалентного количества протонов из внутренней части стеклянного электрода в испытуемый раствор. Если считать концентрацию ионов H+ внутри стеклянного электрода постоянной, то измеряемая ЭДС является функцией только активности ионов водорода, т. е. pH исследуемого раствора.
Электрод сравнения
Основная задача электрода сравнения - создание стабильного опорного потенциала. Конструктивно электрод сравнения представляет собой ионоселективный электрод (например, на ионы Cl-) погруженный в электролит постоянного состава, контакт с анализируемым раствором осуществляется через специальный барьер (волокно, пористая керамика, шлиф), препятствующий смешиванию этих двух жидкостей. Для заполнения электродов сравнения должны применяться строго определенные электролиты. Например, для описанной выше конструкции одноключевого электрода сравнения электролит должен содержать, во-первых, ионы необходимые для работы потенциалопределяющего полуэлемента (для хлорсеребряных электродов это ионы Cl-), а во-вторых, он должен быть «равнопереносящим». Это означает, что ионы, входящие в состав электролита, должны иметь равные (близкие) подвижности. Если это требование не выполняется, то в месте контакта двух жидкостей различного состава возникает скачок потенциала, называемый диффузионным потенциалом, который приводит к ошибке измерений. Чаще всего для заполнения электродов сравнения используют растворы KCl различной концентрации. Однако в некоторых случаях попадание KCl в анализируемый раствор мешает проведению измерений, например. В этом случае должны применяться двухключевые электроды сравнения. В этих электродах между рабочим объемом электрода сравнения, заполненным KCl, и анализируемой средой размещается дополнительная емкость для электролита, снабженная вторым электролитическим ключом. В эту емкость может заливаться любой равнопереносящий электролит.
ВЫПОЛНЕНИЕ РАБОТЫ
Приготовить питательные среды по прописи, предложенные преподавателем, и определить их рН.
ОТЧЕТ
Записать название среды, её состав, классификацию и рН.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте понятие рН-метрии.
2. Методы определения величины pH.
3. Строение измерительного электрода.
4. Строение электрода-сравнения.
5. Дайте понятие питательным средам.
6. Классификация питательных сред.
Требования, предъявляемые к питательным средам.
ЛАБОРАТОРНАЯ РАБОТА № 4
КРАТКАЯ ТЕОРИЯ
Титриметрический анализ (титрование) – метод количественного/массового анализа, который часто используется в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом. Титрование – процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать, начиная от других отметок, не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования (точку эквивалентности) определяют индикаторами или физико-химическими методами (по электропроводности, светопропусканию, потенциалу индикаторного электрода). По количеству пошедшего на титрование рабочего раствора рассчитывают результаты анализа.
Типы титрования
Различают прямое, обратное титрование и титрование заместителя.
При прямом титровании к раствору определяемого вещества (аликвоте или навеске, титруемому веществу) добавляют небольшими порциями раствор титранта (рабочий раствор).
При обратном титровании к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют его остаток, не вступивший в реакцию.
При заместительном титровании к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют один из продуктов реакции между анализируемым веществом и добавленным реагентом.
Кислотно-основное титрование
Кислотно-основное титрование – титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации:
Н3O+ + ОН− ® 2Н2О.
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты – ацидиметрией.
При количественном определении кислот – ацидиметрия – рабочим раствором является раствор щелочи NaOH или КОН. При количественном определении щелочи – алкалиметрия – рабочим раствором является раствор сильной кислоты (обычно НСl или H2SO4). Приготовить титрованный раствор кислоты исходя из концентрированной кислоты невозможно.
Если титровать раствор любой кислоты раствором щелочи, происходит связывание ионов Н+ кислоты ионами ОН– и концентрация ионов Н+ постепенно уменьшается, а рН раствора возрастает. При определенном значении рН достигается точка эквивалентности и титрование должно быть закончено. При титровании раствора щелочи раствором кислоты связываются ионы ОН–, концентрация их в растворе уменьшается, а концентрация ионов Н+ увеличивается и рН раствора уменьшается. Однако величина рН в точке эквивалентности не во всех случаях имеет одно и то же значение, она зависит от природы реагирующей кислоты и основания.
ВЫПОЛНЕНИЕ РАБОТЫ
1. Установление концентрации раствора NaOH:
Концентрацию (С, Т) NaOH устанавливают по первичному стандартному раствору исходного вещества, например, по щавелевой кислоте.
 Для этого бюретку тщательно промывают водой и ополаскивают приготовленным раствором NaOH, затем, подставив под неё стакан, открывают зажим и заполняют раствором оттянутый кончик бюретки, чтобы в нем не осталось пузырьков воздуха. Устанавливают уровень NaOH в бюретке на нуле.
Для этого бюретку тщательно промывают водой и ополаскивают приготовленным раствором NaOH, затем, подставив под неё стакан, открывают зажим и заполняют раствором оттянутый кончик бюретки, чтобы в нем не осталось пузырьков воздуха. Устанавливают уровень NaOH в бюретке на нуле.
Мерную пипетку ополаскивают стандартным раствором щавелевой кислоты, после чего отмеряют 10,0 мл его и переносят в коническую колбу; прибавляют 2–3 капли фенолфталеина и титруют при непрерывном помешивании раствором NaOH до появления бледно-розовой окраски, не исчезающей около 30 с.
При этом протекает реакция по уравнению:
H2C2O4 + NaOH → Na2C2O4 + 2H2O.
Титрование проводят не менее трех раз до получения сходящихся результатов (+/– 0,1 мл).
При этом учитывают следующие показатели:
- объем раствора щавелевой кислоты взятый для титрования;
- объем раствора щелочи, пошедший на первое титрование;
- объем раствора щелочи, пошедший на второе титрование;
- объем раствора щелочи, пошедший на третье титрование;
- средний объем раствора щелочи.
Расчет результатов работы
1. Расчет молярной концентрации эквивалента щелочи:

2. Расчет титра гидроксида натрия:
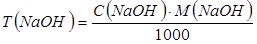
3. Расчет поправочного коэффициента:
 .
.
2. Определение содержания серной кислоты в растворе:
Полученный объем анализируемого раствора серной кислоты в мерной колбе доводят дистиллированной водой до метки и тщательно перемешивают. Мерную пипетку ополаскивают приготовленным раствором серной кислоты, отбирают 10 мл этого раствора в коническую колбу и добавляют 2–3 капли фенолфталеина.
Титрант – раствор гидроксида натрия NaOH – наливают в бюретку и устанавливают уровень раствора на нуле, заполнив кончик бюретки. Раствор серной кислоты титруют при перемешивании раствором NaOH до появления, неисчезающей в течение 30 сек. бледно-розовой окраски. Титрование повторяют 2–3 раза.
При этом учитывают следующие показатели:
- объем раствора H2SO4, взятый для титрования;
- объем раствора NaOH, пошедший на первое титрование;
- объем раствора NaOH, пошедший на второе титрование;
- объем раствора NaOH, пошедший на третье титрование;
- средний раствор объем щелочи.
Расчет результатов работы
Расчет молярной концентрации эквивалента H2SO4:
 .
.
Расчет титра гидроксида натрия по серной кислоте:
 .
.
Содержание (масса) H2SO4 в объёме мерной колбы:
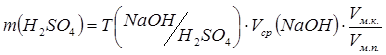 .
.
ОТЧЕТ
Установлена точная концентрация NaOH с K = _____ к 0,1 н.
Содержание (масса) H2SO4 в объеме мерной колбы
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте понятие титриметрическому методу анализа.
2. Виды титриметрического анализа и на чем они основаны.
3. Объясните процесс прямого титрования.
4. Объясните процесс обратного титрования.
5. Объясните процесс заместительного титрования.
6. На чем основано кислотно-основное титрование?
7. Дайте понятие алкалиметрии и ацидиметрии.
КОНТРОЛЬНЫЕ РАБОТЫ
Контрольная работа выполняется в виде письменного ответа на указанные в индивидуальном задании задачи и вопросы. Вариант определяется по двум последним цифрам зачетной книжки. Объем контрольной работы не должен превышать 16-18 страниц рукописного текста.
Вопросы для выполнения контрольной работы
Задание 1.
Рассчитайте массу вещества, необходимого для приготовления водного раствора А вещества и Б концентрации в объеме 330 мл.
|
|
|
|
|
|
|
|
|
|
|
|
|
| А=NaCl Б = 7 %
| А= C2H5OH Б =1 М
| А=Fe(OH)3 Б =1,4 Н
| А= NaOH Б =0,25 М
| А= Fe(OH)3 Б =0,25 Н
| А= CuSO4 Б =1 М
| А= К2НРО4 Б м=0,33 Н
| А= NaOH Б =20 %
| А= HCl Б =1,8 Н
| А= К2НРО4 Б =7 %
|
|
| А=CuSO4 Б = 1 М
| А=HCl Б =7 %
| А= NaCl Б =20 %
| А= C2H5OH Б =20 %
| А= Al(OH)3 Б =1,4 Н
| А= Fe(OH)3 Б =0,33 М
| А= Al(OH)3 Б =0,31 М
| А= HCl Б =1,4 Н
| А= Al(OH)3 Б =4,5 %
| А= HCl Б =1 М
|
|
| А= NaCl Б =1 М
| А= CuSO4 Б =1,4 Н
| А= NaCl Б =0,1 М
| А= HCl Б =1,6 Н
| А= C2H5OH Б =70 %
| А= NaOH Б =0,33 М
| А= Fe(OH)3 Б =5 %
| А= CuSO4 Б =2 М
| А= CH3COOH Б =1,4 Н
| А= NaOH Б =1,28 М
|
|
| А=NaOH Б =1,4 Н
| А= К2НРО4 Б =1 М
| А= CuSO4 Б =5 %
| А= NaOH Б =7 %
| А= HCl Б =0,81 М
| А= Al(OH)3 Б =5 %
| А= C2H5OH Б =0,31 Н
| А= Fe(OH)3 Б =1,4 Н
| А= NaOH Б =0,52 %
| А= CuSO4 Б =1,28 Н
|
|
| А=KCl Б = 5,5 %
| А= Fe(OH)3 Б =1 М
| А= HCl Б =1 Н
| А= К2НРО4 Б =20 %
| А= NaCl Б =, %
| А= HCl Б =0,33 М
| А= К2НРО4 Б =0,31 М
| А= NaOH Б =10 %
| А= Al(OH)3 Б =3,12 Н
| А= К2НРО4 Б =0,2 %
|
|
| А=C2H5OH Б =3, 5 %
| А=Al(OH)3 Б =1,2 Н
| А= NaOH Б =0,1 М
| А= CH3COOH Б =5 %
| А= CuSO4 Б =0,81 Н
| А= К2НРО4 Б =7 %
| А= NaCl Б =1,4 Н
| А= C2H5OH Б =70 %
| А= Fe(OH)3 Б =5 %
| А= CuSO4 Б =1,8 Н
|
|
| А= Fe(OH)3 Б = 1,4 Н
| А=CH3COOH Б =3,5 М
| А= KCl Б =1 М
| А= NaOH Б =0,5 Н
| А= Fe(OH)3 Б =1,25 М
| А= CuSO4 Б =8%
| А= К2НРО4 Б =0,31 Н
| А= NaCl Б =5 %
| А= C2H5OH Б =40 %
| А= NaOH Б =0,6 %
|
|
| А=LiCl Б =3,4 %
| А= Fe(OH)3 Б =1,2 М
| А= CH3COOH Б =,5 %
| А= Al(OH)3 Б =0,1 Н
| А= KCl Б =0,1 М
| А= NaOH Б =2 М
| А= Fe(OH)3 Б =7 %
| А= HCl Б =2 %
| А= NaCl Б =15 %
| А= C2H5OH Б =20 %
|
|
| А= HCl Б =0,1 М
| А= LiCl Б =3 %
| А= Fe(OH)3 Б =2 Н
| А= CH3COOH Б =1,4 Н
| А= Al(OH)3 Б =4,5 %
| А= Al(OH)3 Б =,5 %
| А= KCl Б =0,5 %
| А= KCl Б =7 %
| А= CuSO4 Б =10 %
| А= NaCl Б =5 М
|
|
| А= К2НРО4 Б =1,8 Н
| А= CH3COOH Б =5 М
| А= CH3COOH Б = 20 %
| А= LiCl Б =8,1 %
| А= Fe(OH)3 Б =4,5 %
| А= NaOH Б =4,1 %
| А= CH3COOH Б =3,5 М
| А= Al(OH)3 Б =0,7 Н
| А= NaOH Б =1 М
| А= KCl Б =5 М
|
| Номер по горизонтали – последняя цифра номера зачетки
|
| Номер по вертикали – предпоследняя цифра номер зачетки
|
Задание 2
Дайте письменные ответы на поставленные вопросы
|
|
|
|
|
|
|
|
|
|
|
|
|
| 65, 12, 72
| 2, 49, 50
| 16, 51, 18
| 57, 5, 15
| 8, 11, 11
| 22, 28, 57
| 55, 77, 68
| 80, 13, 50
| 31, 69, 36
| 30, 46, 26
|
|
| 36, 61, 76
| 72, 32, 67
| 8, 55, 55
| 28, 43, 54
| 17, 48, 19
| 64, 1, 4
| 45, 34, 60
| 21, 70, 3
| 32, 42, 18
| 47, 46, 44
|
|
| 33, 74, 51
| 43, 34, 14
| 6, 64, 7
| 59, 64, 5
| 48, 33, 49
| 19, 4, 69
| 29, 3, 64
| 26, 69, 49
| 15, 11, 20
| 68, 58, 20
|
|
| 60, 38, 65
| 71, 61, 16
| 37, 57, 28
| 47, 32, 21
| 4, 61, 36
| 44, 23, 54
| 33, 79, 21
| 36, 52, 25
| 5, 39, 50
| 32, 17, 47
|
|
| 67, 15, 75
| 57, 50, 39
| 19, 80, 53
| 10, 62, 38
| 41, 61, 59
| 58, 25, 54
| 4, 37, 30
| 30, 57, 7
| 6, 27, 63
| 26, 72, 31
|
|
| 56, 10, 49
| 63, 22, 58
| 72, 79, 1
| 57, 8, 21
| 52, 25, 49
| 2, 29, 32
| 80, 25, 61
| 45, 46, 45
| 15, 37, 80
| 19, 36, 35
|
|
| 21, 77, 50
| 73, 75, 79
| 75, 2, 30
| 60, 46, 46
| 23, 70, 7
| 60, 56, 40
| 63, 51, 2
| 3, 41, 26
| 29, 61, 2
| 39, 59, 40
|
|
| 79, 3, 44
| 46, 44, 16
| 40, 22, 73
| 55, 64, 67
| 42, 57, 54
| 25, 18, 48
| 12, 5, 56
| 34, 49, 30
| 34, 24, 25
| 73, 7, 17
|
|
| 2, 49, 50
| 72, 32, 67
| 43, 34, 14
| 71, 61, 16
| 57, 50, 39
| 63, 22, 58
| 73, 75, 79
| 46, 44, 16
| 30, 57, 7
| 6, 27, 63
|
|
| 22, 28, 57
| 64, 1, 4
| 19, 4, 69
| 44, 23, 54
| 58, 25, 54
| 2, 29, 32
| 60, 56, 40
| 25, 18, 48
| 59, 64, 5
| 48, 33, 49
|
| Номер по горизонтали – последняя цифра номера зачетки
|
| Номер по вертикали – предпоследняя цифра номер зачетки
|
1. Организация работы в химико-бактериологической лаборатории
2. Классификация методов аналитической химии.
3. Методы разделения веществ. Центрифугирование.
4. Методы разделения веществ. Электрофорез.
5. Спектроскопические методы.
6. Общие аналитические методы биотехнологии: потенциометрические, электрометрические и полярографические.
7. Хроматографические методы. Тонкослойная хроматография.
8. Хроматографические методы. Жидкостная хроматография.
9. Хроматографические методы. Газовая хроматография.
10. Стерилизация. Способы стерилизации.
11. Классификация микроорганизмов.
12. Методы микроскопии.
13. Биофизические факторы роста микроорганизмов.
14. Биохимические факторы роста микроорганизмов.
15. Методы хранения культур микроорганизмов.
16. Электрофорез. Теория. Общие методы применения.
17. Общие принципы хроматографии.
18. Методы физической, химической и биологической стерилизации.
19. Фламбирование, кипячение, стерилизация сухим жаром.
20. Эффективность стерилизации. Параметр D.
21. Составление сред.
22. Методы анализа генома и его экспрессии.
23. Полимеразная цепная реакция.
24. Виды ПЦР.
25. Исследование РНК,
26. Получение генетических конструкций.
27. Пробоподготовка материала для биохимического и молекулярно-генетического анализа.
28. Гомогенизация.
29. Правила работы в микробиологической лаборатории.
30. Методы микроскопии.
31. Препаративное центрифугирование.
32. Методы белковой химии и гистохимии.
33. Классификация методов анализа по аналитическому сигналу.
34. Чувствительность методов анализа.
35. ПДК загрязняющих веществ (в воде, почве).
36. Предел обнаружения различных методов анализа.
37. Градуировочный график.
38. Классификация ошибок.
39. Закон распределения Гаусса.
40. Критерий Стьюдента.
41. Классификация спектральных методов анализа.
42. Электронные спектры.
43. Кривые поглощения.
44. Закон Бугера- Ламберта – Бера.
45. Схема фотоэлектроколориметра.
46. Схема спектрофотометра.
47. Правила Уолша.
48. Схема атомизации пробы.
49. Источники излучения в ААС.
50. Схема ААС – спектрофотометра.
51. Кривая турбидиметрического титрования.
52. Эффект Тиндаля.
53. Схема нефелометра.
54. Схема процессов флуориметрии.
55. Схема флуориметра.
56. Виды эмиссионного спектрального анализа.
57. Схема однолучевого эмиссионного спектра.
58. Цвета видимого излучения.
59. Классификация ЭХМА.
60. Виды электродов.
61. Гальваническая цепь.
62. Кривые потенциометрического титрования.
63. Электроды сравнения.
64. Установка для потенциометрического титрования.
65. Схема иономера.
66. Эквивалентная электропроводимость ионов.
67. Кривые кондуктометрического титрования.
68. Виды электролитических сосудов.
69. Произведение растворимости малорастворимых электролитов.
70. Двух- и трех- электродные системы в полярографии.
71. Полярограммы.
72. Измерение высоты волны.
73. Схема вольтамперометрического анализатора.
74. Виды хроматографических систем.
75. Параметры хроматограммы.
76. Блок –схема газового хроматографа.
77. Типы детекторов в газовой хроматографии.
78. Ионные хроматографы.
79. Хроматограмма ТСХ.
80. Схема ВЭЖХ.
УДК 60–7: 001.8 (076.5)
ББК 28
Ф50
Рецензент:
Е. В. Кайгородова – доктор химических наук, профессор Кубанского государственного аграрного университета
Составители:
С. Б. Хусид, Ю. А. Лысенко, И. С. Жолобова, А. В. Лунева, С. А. Волкова
| Ф50
| Физико-химические методы анализа в биотехнологии: лаб. практикум / сост. С. Б. Хусид, Ю. А. Лысенко, И. С. Жолобова, А. В. Лунева. – Краснодар: КубГАУ, 2014. – 60 с.
|
| |
Лабораторный практикум содержит краткую теорию, схему выполнения работы, место для отчета с контрольными вопросами. После изучения теории, выполняются практические задания, их результаты заносятся в необходимые поля отчета. Каждый протокол подписывается преподавателем, ведущим лабораторное занятие.
Издание предназначено для студентов, обучающихся по специальности 110900.62 «Технология производства и переработки сельскохозяйственной продукции» и, изучающих дисциплину «Физико-химические методы анализа в биотехнологии».
УДК 60–7: 001.8 (076.5)
ББК 28
|
© Хусид С. Б., Лысенко Ю. А.,
Жолобова И. С., Лунева А. В., сост., 2014
© ФГБОУ ВПО «Кубанский
государственный аграрный
университет», 2014
ЛАБОРАТОРНАЯ РАБОТА № 1
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ В ФИЗИКО-ХИМИЧЕСКОЙ ЛАБОРАТОРИИ. ХИМИЧЕСКАЯ ПОСУДА И ЕЕ НАЗНАЧЕНИЕ.






 Стеклянный электрод
Стеклянный электрод Для этого бюретку тщательно промывают водой и ополаскивают приготовленным раствором NaOH, затем, подставив под неё стакан, открывают зажим и заполняют раствором оттянутый кончик бюретки, чтобы в нем не осталось пузырьков воздуха. Устанавливают уровень NaOH в бюретке на нуле.
Для этого бюретку тщательно промывают водой и ополаскивают приготовленным раствором NaOH, затем, подставив под неё стакан, открывают зажим и заполняют раствором оттянутый кончик бюретки, чтобы в нем не осталось пузырьков воздуха. Устанавливают уровень NaOH в бюретке на нуле.
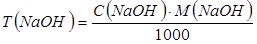
 .
. .
. .
.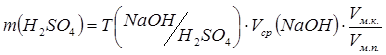 .
.


