

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
Топ:
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Термограммой называется зависимость температуры образца от времени. Термографический метод изучения процессов термического разложения веществ получил широкое распространение после того, как были обнаружены характерные особенности таких зависимостей: «температурные остановки» и «наклонные температурные площадки». Это характерные участки зависимости, в пределах которых в течение некоторого времени (Dt) температура либо остается постоянной (T = const), либо увеличивается на небольшую величину (DТ) с постоянной скоростью (DТ/Dt).
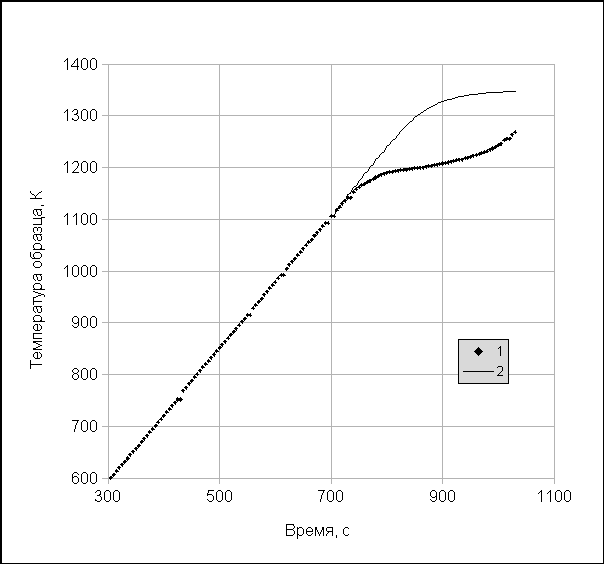
Рисунок 16.1 – Иллюстрация термограммы:
Точки – результат измерений на образце кальцита, тонкая кривая – результат моделирования нагрева образца, в котором не происходит разложения при тех же теплофизических параметрах
Применяя численное или графическое дифференцирование можно с хорошей точностью определить моменты времени и температуры начала и конца температурной площадки или остановки.
В предлагаемой лабораторной работе такую зависимость получают при непрерывном нагревании природного материала кальцита, основной составляющей которого является карбонат кальция. Горная порода, состоящая, главным образом из кальцита, называется известняк. Известняк в больших количествах используется в металлургии.
В результате обжига (термической обработки) известняка по эндотермической реакции
CaCO3 = CaO + CO2
получают известь (СаО) – необходимый компонент шлакового расплава. Процесс проводят при температурах, ниже температур плавления и известняка, и извести. Известно, что карбонаты и образующиеся из них оксиды взаимно практически не растворимы, поэтому продуктом реакции является новая твердая фаза и газ. Выражение для константы равновесия, в общем случае, имеет вид:
|
|

| (16.1) |
Здесь a – равновесные активности твердых реагентов,  – равновесное парциальное давление газообразного продукта реакции. В металлургии широко используется и другая горная порода, называемая доломит. Она, в основном, состоит из минерала с таким же названием, представляющим из себя двойную соль угольной кислоты CaMg(CO3)2.
– равновесное парциальное давление газообразного продукта реакции. В металлургии широко используется и другая горная порода, называемая доломит. Она, в основном, состоит из минерала с таким же названием, представляющим из себя двойную соль угольной кислоты CaMg(CO3)2.
Температурные остановки и площадки имеют термодинамическое объяснение. При известном составе фаз можно термодинамическими методами предсказать температуру остановки. Реализоваться температурные остановки и площадки могут только при выполнении определенных требований в отношении кинетики процесса. Естественно ожидать, что это требования практически равновесных составов фаз в месте протекания реакции и пренебрежимо малых градиентов в диффузионных слоях. Соблюдение таких условий оказывается возможным, если скорость процесса контролируется не внутренними факторами (сопротивление диффузии и сопротивление самой химической реакции), а внешними – скоростью подвода тепла к месту реакции. В дополнении к определенным в физической химии основным режимам гетерогенной реакции: кинетическому и диффузионному, такой режим процесса называют тепловым.
Заметим, что тепловой режим твердофазного процесса диссоциации оказывается возможным из-за своеобразия реакции, которая требует подвода большого количества тепла, и при этом в ней отсутствуют этапы подвода исходных веществ к месту реакции (поскольку происходит разложение одного вещества) и отвода твердого продукта реакции от границы раздела фаз (поскольку перемещается эта граница). Остается только два этапа, связанных с диффузией: отвод СО2 через газовую фазу (очевидно, с очень малым сопротивлением) и диффузия СО2 через оксид, которая сильно облегчается растрескиванием оксида, заполняющим объем, ранее занятый улетучившимся оксидом углерода.
Рассмотрим термодинамическую систему при температурах ниже температурной остановки. Допустим, что навеска исследуемого порошкового кальцита составлена из одинаковых сферических частиц радиусом r 0. Границу термодинамической системы проведем на некотором расстоянии от поверхности одной из частиц кальцита, небольшом по сравнению с ее радиусом, и таким образом включим в состав системы некоторый объем газовой фазы.
|
|
В рассматриваемой системе находятся 3 реагента одной реакции: СаО, СаСО3, СО2 и газы (азот и кислород), которые ни с чем не взаимодействуют, поэтому неразличимы и могут считаться одним нейтральным газом. Итого 4 вещества и одна реакция. Эти вещества распределены по трем фазам: СаО, СаСО3, газовая фаза. Каждая фаза характеризуется присущими только ей значениями различных свойств и отделена от других видимой (хотя бы под микроскопом) границей раздела. Процесс проводим в негерметичной установке, поэтому давление постоянно и внешним параметром, который может меняться, является только температура. Таким образом, все слагаемые для расчета числа степеней свободы (с) определены:
с = (4 – 1) + 1 – 3 = 1.
Полученная величина означает, что при изменении температуры (одного параметра) система будет переходить от одного равновесного состояния к другому и при этом число и природа фаз меняться не будут. Будут меняться параметры состояния системы: температура и равновесное давление углекислого и нейтрального газов (Т, РСО2, РN).
Строго говоря, сказанное справедливо не для любых температур ниже температурной остановки, а только для того интервала, когда реакция, первоначально происходящая в кинетическом режиме, перешла в тепловой режим и можно действительно говорить о близости параметров системы к равновесным. При более низких температурах система может быть существенно не равновесна, но на характере зависимости температуры образца от времени это никакими особенностями не проявляется.
С самого начала эксперимента – при комнатной температуре система находится в состоянии равновесия, но только потому, что в ней отсутствуют вещества, которые могли бы взаимодействовать. Имеется в виду отсутствие оксида кальция, который при этих условиях (парциальное давление углекислого газа в атмосфере примерно 3×10–4 атм, равновесное давление – 10–23 атм) мог бы карбонизироваться. Согласно уравнению изотермы для реакции, записанному с учетом выражения константы равновесия (16.1) при активностях конденсированных веществ, равных единице:
|
|

| (16.2) |
изменение энергии Гиббса положительно, что означает, что реакция должна происходить в обратном направлении, но это невозможно, поскольку в системе изначально отсутствует оксид кальция.
При увеличении температуры упругость диссоциации (равновесное давление СО2 над карбонатом) растет, как это следует из уравнения изобары:
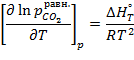
| (16.3) |
поскольку тепловой эффект реакции больше нуля.
Только при температуре примерно 520 С реакция диссоциации станет термодинамически возможной, но начнется она со значительной задержкой по времени (инкубационный период), необходимой для зарождения оксидной фазы. Первоначально реакция будет происходить в кинетическом режиме, но, за счет автокатализа сопротивление кинетического этапа довольно быстро понизится настолько, что реакция перейдет в тепловой режим. Именно с этого момента становится справедливым термодинамический анализ, приведенный выше, а температура образца начнет отставать от температуры гипотетического образца сравнения, в котором не происходит диссоциация (см. рис. 16.1).
Рассмотренный термодинамический анализ будет оставаться справедливым до момента, когда упругость диссоциации достигнет значения 1 атм. При этом на реакционной поверхности непрерывно выделяется углекислый газ под давлением 1 атм. Выделяясь в месте реакции, он оттесняет воздух. При этом давление углекислого газа увеличиться сверх одной атмосферы не может, поскольку газ свободно уходит в окружающую атмосферу.
Система принципиально меняется, поскольку в газовой фазе вокруг образца теперь отсутствует воздух и в системе стало одним компонентом меньше. Число степеней свободы в такой системе
с = (3 – 1) + 1 – 3 = 0
оказывается равно нулю, и при сохранении равновесия в ней не могут меняться никакие параметры состояния, в том числе и температура.
Наступает температурная остановка, когда все поступающее тепло расходуется только на процесс диссоциации. Система работает как очень хороший регулятор температуры, когда небольшое случайное ее изменение приводит к противоположному изменению скорости диссоциации, что возвращает температуру к прежнему значению. Высокое качество регулирования объясняется тем, что такая система практически безинерционна.
|
|
В описываемой реализации эксперимента в лабораторном практикуме, к моменту установления теплового режима процесса фронт реакции уже сместился с поверхности вглубь образца. Поскольку образовавшийся слой твердого продукта реакции (оксида кальция) обладает тепловым сопротивлением, измеряемая нами температура поверхности образца будет выше температуры на фронте. Разницу температур можно вычислить, поскольку корректное значение температуры остановки известно из более точных измерений на исследовательских установках. Оно было учтено при формировании справочных термодинамических данных и теперь может быть извлечено из них с использованием обычных термодинамических функций.
Рассмотрим эту задачу подробнее. Допустим, что фронт реакции диссоциации, находящийся внутри сферического образца радиусом r 0, имеет радиус r. Температура на фронте реакции – термодинамическая температура остановки для кальцита Т 0. Температура на поверхности образца, фиксируемая термопарой – Т. Скорость подвода тепла к фронту реакции определяется уравнением сферической теплопередачи:

| (16.4) |
в котором l – коэффициент теплопроводности.
Учтем, что все тепло в момент температурной остановки расходуется только на разложение кальцита, поэтому

| (16.5) |
Здесь v – скорость процесса диссоциации, D H – тепловой эффект этой реакции. Определив степень диссоциации (a), можно оценить радиус фронта реакции:

| (16.6) |
Для вычисления удельной скорости реакции (на единицу поверхности) получим следующую формулу:

| (16.7) |
По мере развития процесса диссоциации фронт реакции смещается вглубь образца, при этом уменьшается поверхность взаимодействия и увеличивается толщина твердого продукта реакции, что затрудняет диффузию углекислого газа от места реакции на поверхность образца. Начиная с какого-то момента времени тепловой режим процесса переходит в смешанный, а затем – в диффузионный. Уже в смешанном режиме система станет существенно неравновесной и выводы, полученные при термодинамическом анализе потеряют практический смысл.
Из-за уменьшения скорости процесса диссоциации требуемое количество тепла уменьшится настолько, что часть поступающего теплового потока вновь начнет расходоваться на нагрев системы. С этого момента температурная остановка прекратится, хотя процесс диссоциации еще будет продолжаться до полного разложения карбоната.
|
|
Привлекая справочное значение коэффициента теплопроводности кальцита (2,3 Вт/(м·К)), по формуле (16.7) можно рассчитать важную технологическую характеристику – скорость процесса в момент температурной остановки.
|
|
|

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!