

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
При нормальных условиях йод представляет собой черно-серое кристаллическое вещество с металлическим блеском. Уже при обычной температуре он испаряется, а при слабом нагревании возгоняется, образуя фиолетовые пары с резким запахом. Цвет паров йода обусловлен сильным поглощением ими желтых и зеленых лучей и меньшим поглощением красных и синих.
Атом йода имеет полностью заполненные K-, L-, M-, N-оболочки и 7 валентных электронов на внешней O-оболочке с конфигурацией 5s25p5. Такую же конфигурацию имеет ион ксенона Xe+. Недостаток одного электрона в оболочке 5p можно рассматривать как наличие в ней дырки со спином 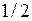 . Поэтому электронной конфигурации 5p5 йода, как и атому натрия с валентным электроном в состоянии 3р (см. работу 9) соответствует дублет из термов 2P3/2 и 2P1/2. У возбужденного атома натрия верхняя электронная оболочка 3р заполнена единственным электроном менее чем наполовину. Поэтому меньшую энергию имел терм 2P1/2. У атома йода электронная оболочка 5p5 заполнена более чем наполовину. Поэтому меньшую энергию имеет терм 2P3/2, он соответствует основному состоянию атома йода. Подобные дублеты называются обращенными. Сравнительно большое значение разности энергии дублетных уровней
. Поэтому электронной конфигурации 5p5 йода, как и атому натрия с валентным электроном в состоянии 3р (см. работу 9) соответствует дублет из термов 2P3/2 и 2P1/2. У возбужденного атома натрия верхняя электронная оболочка 3р заполнена единственным электроном менее чем наполовину. Поэтому меньшую энергию имел терм 2P1/2. У атома йода электронная оболочка 5p5 заполнена более чем наполовину. Поэтому меньшую энергию имеет терм 2P3/2, он соответствует основному состоянию атома йода. Подобные дублеты называются обращенными. Сравнительно большое значение разности энергии дублетных уровней 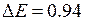 эВ обусловлено сильным спин-орбитальным взаимодействием (см. работы 9, 10 и табл. 10.3).
эВ обусловлено сильным спин-орбитальным взаимодействием (см. работы 9, 10 и табл. 10.3).
Ядро йода с внутренними электронами образует атомный остов с полным зарядом +7e, в поле которого движутся валентные электроны. При образовании молекулы йода I2 14 валентных электронов занимают молекулярные орбитали (МО) в поле двух атомных остовов, расположенных довольно далеко друг от друга. Вблизи атомных остовов волновые функции электронов (молекулярные орбитали) не очень сильно отличаются от атомных волновых функций (атомных орбиталей, АО). Поэтому хорошим приближением для МО являются линейные комбинации атомных орбиталей (сокращенно МО ЛКАО) вида
|
|
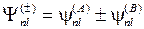 (12.17)
(12.17)
где индексами А и В указаны АО двух атомов йода молекулы. В обозначениях таких МО квантовые числа n и l (значения l =0, 1, 2 ,… указываются буквами s, p, d,…) записываются после греческих букв 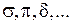 , означающих равенство модуля проекции орбитального момента электрона на ось молекулы
, означающих равенство модуля проекции орбитального момента электрона на ось молекулы 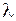 значениям
значениям  , например:
, например: 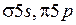 . Молекула I2 – гомоядерная, поэтому ее МО, либо четные (g) – симметричные относительно плоскости, проходящей через середину оси молекулы и перпендикулярной к ней, либо нечетные (u) – несимметричные. Из пары молекулярных орбиталей, определенных формулой (12.11), МО с меньшей энергией называется связывающей, а МО с большей энергией − разрыхляющей. Разрыхляющие МО обозначаются символом “*”, например,
. Молекула I2 – гомоядерная, поэтому ее МО, либо четные (g) – симметричные относительно плоскости, проходящей через середину оси молекулы и перпендикулярной к ней, либо нечетные (u) – несимметричные. Из пары молекулярных орбиталей, определенных формулой (12.11), МО с меньшей энергией называется связывающей, а МО с большей энергией − разрыхляющей. Разрыхляющие МО обозначаются символом “*”, например, 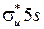 и
и 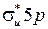 . Схематичные изображения МО ЛКАО валентных электронов йода и АО 5s показаны на рис. 12.3.
. Схематичные изображения МО ЛКАО валентных электронов йода и АО 5s показаны на рис. 12.3.
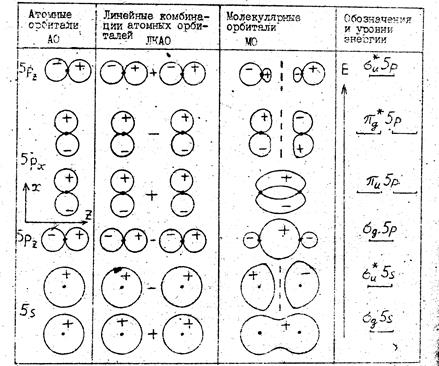
Рис. 12.3. Схематичные изображения МО ЛКАО валентных электронов йода и АО 5s , 5p
МО располагаются снизу вверх в порядке возрастания энергий. Для АО показаны диаграммы угловых частей вещественных волновых функций 5s, 5pz, 5px с указанием их знаков. Изменение знака радиальных частей волновых функций не учитывается. Для МО знаки проставлены для иллюстрации свойств четности или нечетности. В случае 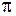 -орбиталей имеется двукратное вырождение – одному уровню энергии соответствуют две эквивалентные орбитали (волновые функции), переходящие друг в друга при замене координат
-орбиталей имеется двукратное вырождение – одному уровню энергии соответствуют две эквивалентные орбитали (волновые функции), переходящие друг в друга при замене координат 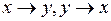 (ось z − ось молекулы). Поэтому на
(ось z − ось молекулы). Поэтому на  -орбиталях по принципу Паули не может находиться более двух электронов с противоположными спинами (
-орбиталях по принципу Паули не может находиться более двух электронов с противоположными спинами ( 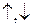 ), а на
), а на 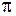 -орбиталях – более четырех (по два на каждый из эквивалентных МО). Заполнение молекулярных орбиталей четырнадцатью валентными электронами в основном (а) и возбужденном (б) состоянии молекулы йода показано на рис. 12.4.
-орбиталях – более четырех (по два на каждый из эквивалентных МО). Заполнение молекулярных орбиталей четырнадцатью валентными электронами в основном (а) и возбужденном (б) состоянии молекулы йода показано на рис. 12.4.
|
|
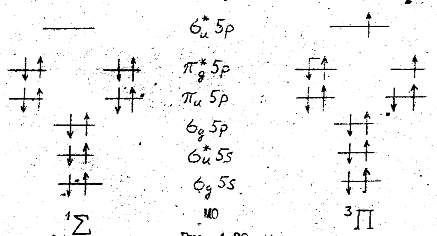
а б
Рис. 12.4. Заполнение молекулярных орбиталей четырнадцатью валентными электронами в основном (а) и возбужденном (б) состоянии молекулы йода
В основном состоянии все занятые МО полностью заполнены, поэтому суммарная проекция 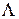 орбитального момента электронов на ось молекулы равна нулю (
орбитального момента электронов на ось молекулы равна нулю (  ). Полный спин всех электронов также равен нулю (S=0), мультиплетность 2S+1=1, на нечетных МО (
). Полный спин всех электронов также равен нулю (S=0), мультиплетность 2S+1=1, на нечетных МО ( 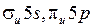 ) находится четное число электронов, поэтому основному состоянию соответствует четный терм
) находится четное число электронов, поэтому основному состоянию соответствует четный терм 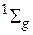 . Возбуждение молекулы связано с переходом одного из электронов с МО
. Возбуждение молекулы связано с переходом одного из электронов с МО 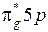 на МО
на МО 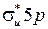 . В возбужденном состоянии две МО не заполнены полностью:
. В возбужденном состоянии две МО не заполнены полностью: 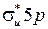 и
и 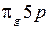 . Поскольку на нечетной МО
. Поскольку на нечетной МО 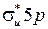 находится нечетное МО электронов (один), возбужденному состоянию соответствует нечетный терм (
находится нечетное МО электронов (один), возбужденному состоянию соответствует нечетный терм ( 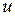 ). На первой МО
). На первой МО 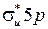 имеется один электрон с нулевой проекцией орбитального момента на ось молекулы,
имеется один электрон с нулевой проекцией орбитального момента на ось молекулы, 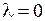 , на второй МО
, на второй МО 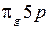 – «дырка» (отсутствие электрона) в состоянии с
– «дырка» (отсутствие электрона) в состоянии с 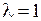 . Поэтому значение квантового числа
. Поэтому значение квантового числа 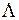 для всех электронов молекулы также равно единице:
для всех электронов молекулы также равно единице: 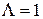 . Полный спин S всех электронов может принимать два значения: S=1 и S=0. Поэтому такой электронной конфигурации соответствуют термы
. Полный спин S всех электронов может принимать два значения: S=1 и S=0. Поэтому такой электронной конфигурации соответствуют термы 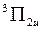 ,
, 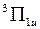 ,
, 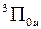 и
и  (см. рис. 12.5).
(см. рис. 12.5).
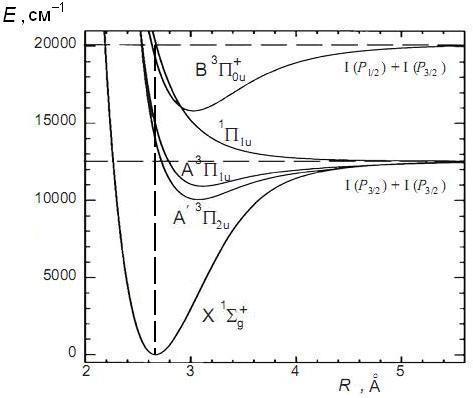
Рис. 12.5. Потенциальные кривые для основного (Х) и возбужденных ( 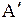 , А, В) электронных состояний молекулы йода. Расстояние между атомами указано в ангстремах, 1Å=0.1 нм, по вертикальной оси отложены волновые числа, для получения энергия молекулы их нужно умножить на
, А, В) электронных состояний молекулы йода. Расстояние между атомами указано в ангстремах, 1Å=0.1 нм, по вертикальной оси отложены волновые числа, для получения энергия молекулы их нужно умножить на 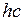 (по данным из *)
(по данным из *)
По правилам Хунда наименьшую энергию имеет терм с наибольшим спином и с наибольшим полным электронным моментом 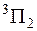 . При переходах
. При переходах 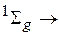
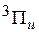 ,
, 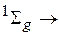
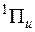 с поглощением света выполняются правила отбора
с поглощением света выполняются правила отбора 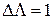 и
и 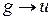 (для гомоядерных молекул). При слабом спин-орбитальном взаимодействии оптические переходы с изменением спина маловероятно и более вероятным являлся бы переход с
(для гомоядерных молекул). При слабом спин-орбитальном взаимодействии оптические переходы с изменением спина маловероятно и более вероятным являлся бы переход с 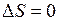 :
: 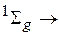
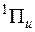 . При заметном спин-орбитальном взаимодействии, что типично для соединений тяжелых элементов, волновые функции теряют определенное значение S и Λ. В этом случае действует правило отбора по проекции суммарного электронного момента импульса
. При заметном спин-орбитальном взаимодействии, что типично для соединений тяжелых элементов, волновые функции теряют определенное значение S и Λ. В этом случае действует правило отбора по проекции суммарного электронного момента импульса 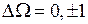 . Такой характер связи спиновых и орбитальных моментов электронов в молекуле йода сходен с
. Такой характер связи спиновых и орбитальных моментов электронов в молекуле йода сходен с 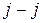 -связью, имеющей место для атомов с большими атомными номерами (см. работу 9). Наибольшую интенсивность имеет переход с
-связью, имеющей место для атомов с большими атомными номерами (см. работу 9). Наибольшую интенсивность имеет переход с 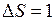 :
: 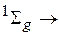
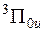 , вносящий основной вклад в спектр поглощения паров в видимой области.
, вносящий основной вклад в спектр поглощения паров в видимой области.
|
|
При переходе электрона с МО 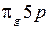 на МО
на МО 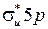 меняется распределение плотности вероятности
меняется распределение плотности вероятности 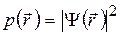
 нахождения электрона в точке
нахождения электрона в точке 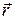 . Это изменение можно интерпретировать как изменение плотности заряда электронного облака
. Это изменение можно интерпретировать как изменение плотности заряда электронного облака 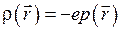 . Большая энергия МО
. Большая энергия МО 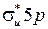 по сравнению с МО
по сравнению с МО 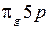 и форма МО (см. рис. 12.3 ) указывают на то, что в состоянии
и форма МО (см. рис. 12.3 ) указывают на то, что в состоянии 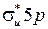 электрон в среднем находится дальше от положительно заряженных остовов, чем в состоянии
электрон в среднем находится дальше от положительно заряженных остовов, чем в состоянии 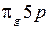 . Уменьшение плотности отрицательного заряда между остовами приводит к увеличению равновесного межъядерного расстояния R0 у терма
. Уменьшение плотности отрицательного заряда между остовами приводит к увеличению равновесного межъядерного расстояния R0 у терма 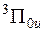 по сравнению с термом
по сравнению с термом 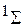 .
.
|
|
|

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!