Рассмотрим причины сложного спектра излучения неона, использованного при градуировке монохроматора. Источником излучения атомов неона является область тлеющего электрического разряда в неоновой лампе. При неупругих столкновениях атома инертного элемента с электроном (например, при электрическом разряде) один из шести электронов его
р-оболочки переходит в вышележащие состояния (возбуждение) или покидает атом (ионизация). Рассмотрим свойства образующейся при этом электронной конфигурации р5, ее имеют однозарядные ионы инертных элементов и атомы галогенов (фтор F, хлор Cl, бром Br, йод I). Атом фтора F и ион Ne+ имеют одинаковую электронную конфигурацию
1s22s22p5. (10.14)
Электронная конфигурация 2p5 при добавлении шестого электрона достраивается до замкнутой оболочки с равными нулю полным орбитальным моментом 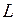 =0 и полным спином
=0 и полным спином 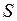 =0. Поэтому вакансию (отсутствие) электрона на оболочке 2p5 называют дыркой (аналогично дырке в полупроводниках, см. работы 15-17) и приписывают ей те же значения орбитального момента и спина, что и у добавляемого электрона
=0. Поэтому вакансию (отсутствие) электрона на оболочке 2p5 называют дыркой (аналогично дырке в полупроводниках, см. работы 15-17) и приписывают ей те же значения орбитального момента и спина, что и у добавляемого электрона 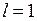 ,
, 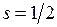 . Двум возможным значениям полного момента системы
. Двум возможным значениям полного момента системы
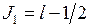 ,
, 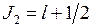 , (10.15)
, (10.15)
соответствует обращенный дублет, в котором уровень 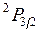 лежит ниже уровня
лежит ниже уровня 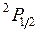 . Обращение дублета связано с тем, что 2p-оболочка заполнена более чем наполовину (пятью электронами). Разность энергий
. Обращение дублета связано с тем, что 2p-оболочка заполнена более чем наполовину (пятью электронами). Разность энергий 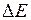 уровней приблизительно пропорциональна квадрату числа электронов на незаполненной оболочке, поэтому для галогенов и ионов инертных элементов она примерно в
уровней приблизительно пропорциональна квадрату числа электронов на незаполненной оболочке, поэтому для галогенов и ионов инертных элементов она примерно в 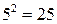 раз выше, чем у атомов щелочных элементов (см. табл. 8.1 и 8.2). Разность энергий
раз выше, чем у атомов щелочных элементов (см. табл. 8.1 и 8.2). Разность энергий  возрастает с ростом атомного номера
возрастает с ростом атомного номера 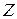 приблизительно пропорционально
приблизительно пропорционально 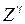 ,
, 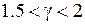 , см. табл. 10.3.
, см. табл. 10.3.
Таблица 10.3
| Ион инертного элемента
| 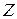
| 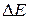 , эВ , эВ
|
| Ne+
| 10
| 0,08
|
| Ar+
| 18
| 0,2
|
| Xe+
| 54
| 1,1
|
Структура энергетических уровней возбужденных состояний атомов инертных элементов (с конфигурацией типа электрон+дырка) усложнена из-за четырех основных добавок к энергии взаимодействия электронов с ядром атома:
1) обменного взаимодействия - электростатического взаимодействия двух электронов, энергия которого зависит от их полной волновой функции, которая, в свою очередь, зависит от полного спина системы 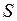 ;
;
2) взаимодействия орбитальных моментов электронов;
3) спин-орбитального взаимодействия для каждого электрона, в некоторых случаях существенно взаимодействие спина с орбитальными моментами других электронов;
4) спин-спинового взаимодействия – взаимодействия собственных магнитных моментов электронов.
В результате энергия атома оказывается зависящей от квантового числа полного момента 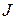 , получаемого в результате сложения орбитальных и спиновых моментов двух внешних электронов. Зависимость от других свойств приближенно определяется в двух взаимно дополняющих моделях, называемых моделью
, получаемого в результате сложения орбитальных и спиновых моментов двух внешних электронов. Зависимость от других свойств приближенно определяется в двух взаимно дополняющих моделях, называемых моделью 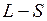 -связи и моделью
-связи и моделью 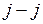 -связи. Энергия терма
-связи. Энергия терма 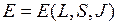 зависит от квантовых чисел
зависит от квантовых чисел 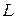 ,
, 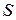 и
и 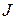 сложным образом. Для определения основного состояния (с наименьшей энергией) применяются эмпирические правила Хунда.
сложным образом. Для определения основного состояния (с наименьшей энергией) применяются эмпирические правила Хунда.
Рассмотрим структуру и спектр атома неона. В его основном состоянии 10 электронов находятся на полностью заполненных оболочках с электронной конфигурацией:
1s22s22p6. (10.16)
Разность энергий основного и первого возбужденного состояния атома неона довольно велика – 16,6 эВ. При возбуждении атома неона один из электронов переходит с 2р-оболочки в вышележащие состояния 3s, 3p, 3d, 4s, 4p,… и т.д. В таких состояниях он движется в поле атомного остова Ne+, сходного с остовом Na+ атома натрия (см. работу 6). Электронные конфигурации таких состояний:
2p53s, 2p53p, 2p53d, 2p54s, 2p54p,…, (10.17)
можно записать в эквивалентном виде как конфигурации системы электрон+дырка, для которых удобнее складывать моменты
2р3s, 2p3p, 2p3d, 2p4s, 2p4p,… . (10.18)
Для каждой из таких конфигураций существует несколько термов с близкими энергиями. Для конфигурации 2p 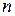 s,
s, 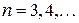 это четыре терма (табл. 10.2). Для конфигурации 2p
это четыре терма (табл. 10.2). Для конфигурации 2p 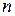 р,
р, 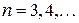 это десять термов (табл. 10.4).
это десять термов (табл. 10.4).
Таблица 10.4
Сравнительные схемы энергетических уровней атомов натрия и неона, являющего соседями по периодической таблице Менделеева, показаны на рис. 10.6. Расщепление уровней на рис. 10.6 показано условно, с большим увеличением.
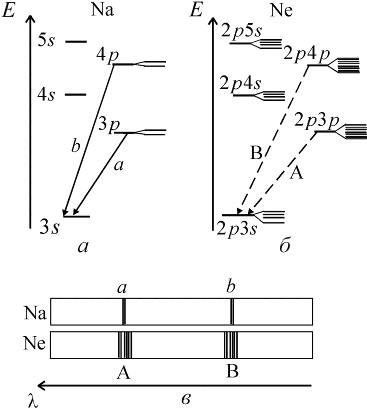
| Рис. 10.6. Сравнительные схемы энергетических уровней атомов натрия (а) и неона (б). Показаны переходы между уровнями, приводящие к наличию в спектрах (в) двух первых линий главной серии спектра натрия и двух групп линий неона
|
Переходы между подуровнями неона дают большое число спектральных линий, объединенных в компактные группы. На рис. 10.6 сплошными и штриховыми стрелками показаны переходы с близкими 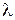 , приводящие к излучению наиболее интенсивных линий: а – известный желтый дублет натрия, b – вторая (ультрафиолетовая) линия главной серии натрия (см. рис. 6.3, 6.4), А – красно-оранжевые линии неона, В – группа линий неона в ближней ультрафиолетовой области, менее интенсивная, чем группа А. При переходах 2р55s
, приводящие к излучению наиболее интенсивных линий: а – известный желтый дублет натрия, b – вторая (ультрафиолетовая) линия главной серии натрия (см. рис. 6.3, 6.4), А – красно-оранжевые линии неона, В – группа линий неона в ближней ультрафиолетовой области, менее интенсивная, чем группа А. При переходах 2р55s 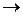 2р54p испускаются инфракрасные линии с
2р54p испускаются инфракрасные линии с 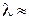 3390 нм, при переходах 2р54s
3390 нм, при переходах 2р54s 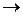 2р53p и 2р55s
2р53p и 2р55s 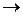 2р53p испускаются линии с
2р53p испускаются линии с 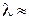 1170 нм и
1170 нм и 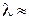 632,8 нм. Последнее красное излучение является основным для гелий-неонового лазера [6,7].
632,8 нм. Последнее красное излучение является основным для гелий-неонового лазера [6,7].
Контрольные вопросы
1. Расскажите об электронных конфигурациях элементов периодической системы Менделеева, запишите их для атомов неона и ртути.
2. Расскажите о правиле сложения моментов и обозначениях термов в случаях 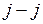 -связи и
-связи и 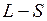 -связи.
-связи.
3. Какие термы атома ртути, соответствуют электронным конфигурациям 6sn р, 6snd? Расположите их в порядке возрастания энергии по правилам Хунда.
4. Объясните происхождение желтого дублета спектра ртути, сравните его с желтым дублетом натрия.
5. Объясните происхождение дублетов и триплета (см. рис. 10.8) в ультрафиолетовой области спектра ртути.
6. Энергия электрона в состоянии 6d атома ртути около –1,6 эВ. Сравните это значение с минимальной энергией d-состояния атома водорода (см. работу 5). Укажите квантовые числа такого состояния. Дайте физическую интерпретацию результату сравнения.
7. Расскажите о физических и химических свойствах атомов инертных элементов.
8. Расскажите о правиле сложения моментов, 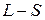 -связи и обозначениях термов на примере электронных конфигураций 2p5
-связи и обозначениях термов на примере электронных конфигураций 2p5 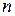 р,
р, 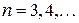 .
.
9. Расскажите о свойствах спектров и термов атома неона, сравните их со спектрами и термами атома натрия. Объясните причину оранжевого цвета свечения неоновой лампы.



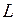 =0 и полным спином
=0 и полным спином 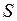 =0. Поэтому вакансию (отсутствие) электрона на оболочке 2p5 называют дыркой (аналогично дырке в полупроводниках, см. работы 15-17) и приписывают ей те же значения орбитального момента и спина, что и у добавляемого электрона
=0. Поэтому вакансию (отсутствие) электрона на оболочке 2p5 называют дыркой (аналогично дырке в полупроводниках, см. работы 15-17) и приписывают ей те же значения орбитального момента и спина, что и у добавляемого электрона 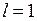 ,
, 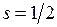 . Двум возможным значениям полного момента системы
. Двум возможным значениям полного момента системы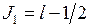 ,
, 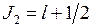 , (10.15)
, (10.15)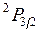 лежит ниже уровня
лежит ниже уровня 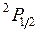 . Обращение дублета связано с тем, что 2p-оболочка заполнена более чем наполовину (пятью электронами). Разность энергий
. Обращение дублета связано с тем, что 2p-оболочка заполнена более чем наполовину (пятью электронами). Разность энергий 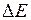 уровней приблизительно пропорциональна квадрату числа электронов на незаполненной оболочке, поэтому для галогенов и ионов инертных элементов она примерно в
уровней приблизительно пропорциональна квадрату числа электронов на незаполненной оболочке, поэтому для галогенов и ионов инертных элементов она примерно в 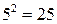 раз выше, чем у атомов щелочных элементов (см. табл. 8.1 и 8.2). Разность энергий
раз выше, чем у атомов щелочных элементов (см. табл. 8.1 и 8.2). Разность энергий 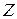 приблизительно пропорционально
приблизительно пропорционально 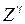 ,
, 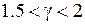 , см. табл. 10.3.
, см. табл. 10.3.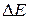 , эВ
, эВ
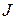 , получаемого в результате сложения орбитальных и спиновых моментов двух внешних электронов. Зависимость от других свойств приближенно определяется в двух взаимно дополняющих моделях, называемых моделью
, получаемого в результате сложения орбитальных и спиновых моментов двух внешних электронов. Зависимость от других свойств приближенно определяется в двух взаимно дополняющих моделях, называемых моделью 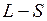 -связи и моделью
-связи и моделью 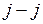 -связи. Энергия терма
-связи. Энергия терма 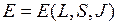 зависит от квантовых чисел
зависит от квантовых чисел 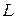 ,
, 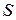 и
и 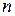 s,
s, 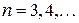 это четыре терма (табл. 10.2). Для конфигурации 2p
это четыре терма (табл. 10.2). Для конфигурации 2p 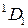
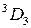
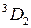
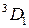
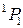
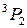
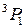
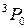
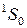
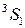

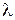 , приводящие к излучению наиболее интенсивных линий: а – известный желтый дублет натрия, b – вторая (ультрафиолетовая) линия главной серии натрия (см. рис. 6.3, 6.4), А – красно-оранжевые линии неона, В – группа линий неона в ближней ультрафиолетовой области, менее интенсивная, чем группа А. При переходах 2р55s
, приводящие к излучению наиболее интенсивных линий: а – известный желтый дублет натрия, b – вторая (ультрафиолетовая) линия главной серии натрия (см. рис. 6.3, 6.4), А – красно-оранжевые линии неона, В – группа линий неона в ближней ультрафиолетовой области, менее интенсивная, чем группа А. При переходах 2р55s  2р54p испускаются инфракрасные линии с
2р54p испускаются инфракрасные линии с 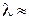 3390 нм, при переходах 2р54s
3390 нм, при переходах 2р54s 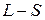 -связи и обозначениях термов на примере электронных конфигураций 2p5
-связи и обозначениях термов на примере электронных конфигураций 2p5 


