Цель работы – ознакомление с одним из методов исследования химического равновесия. Определение состава равновесной смеси, расчет константы равновесия и стандартных термодинамических параметров реакции.
В данной работе для изучения равновесия используются реакции
2FeCl3 +2 KI →2 FeCl2 +I2 + 2 KCl
или Fe2(SO4)2 + 2 KI →2 Fe SO4 +I2 + 2 K2 SO4
Оборудование и реактивы
1. Термостат.
2. 4 конические колбы для титрования емкостью 100 мл.
3. 2 колбы с притертыми пробками емкостью 100 мл.
4. Пипетка на 15 мл.
5. 0,0128 М раствор сульфата железа (III) Fe2(SO4)2 .
6. 0,025 М раствор иодида калияKI.
7. Бюретка с 0,015 М раствором тиосульфата натрия Na2S2O3.
8. Раствор крахмала.
9. Баня со льдом.
Порядок выполнения работы
Для проведения реакции необходимо задаться определенным исходным составом реагирующей смеси (вариант I или вариант II):
| Раствор
| Вариант I
| Вариант II
|
| Колба 1
| Колба 2
| Колба 1
| Колба 2
|
| Fe2(SO4)2
0,0128 М
| 50 мл
| -
| 55 мл
| -
|
| KI
0,025 М
| -
| 50 мл
| -
| 45 мл
|
1. Налить в две сухие колбы с притертыми пробками емкостью100 мл выбранные количества растворов исходных веществ.
2. Поместить колбы на 30 мин в водяной термостат при температуре 25оС.
3. За это время приготовить для титрования 4 конические колбы емкостью 100 мл, в каждую из которых налить по 30 мл дистиллированной воды и поставить их на лед.
4. По истечении 30 мин слить вместе содержимое колб 1 и 2 (момент слива отметить по часам), закрыть реакционную колбу пробкой и установить в термостат.
5. Определить момент наступления равновесия в реакционной смеси, для чего:
5.1. Через определенные промежутки времени от начала реакции (15, 30, 45 мин), не вынимая колбу из термостата, отобрать пипеткой пробу (15 мл) и перенести ее в охлажденную коническую колбу для титрования. Временем отбора пробы считать момент слива раствора из пипетки в колбу для титрования.
5.2. Сразу же после сливания пробы оттитровать выделившийся иод 0,015 М раствором тиосульфата натрия Na2S2O3 до бледно-желтой окраски раствора.
5.3. Добавить в раствор несколько капель раствора крахмала и продолжать титровать раствором тиосульфата до исчезновения синей окраски (светло-синяя окраска раствора, появляющаяся через некоторое время после титрования, не учитывается).
5.4. Перед отбором следующей пробы сполоснуть пипетку дистиллированной водой.
6. Построить график зависимости объема раствора тиосульфата, пошедшего на титрование проб от времени τ. Моменту наступления равновесия будет отвечать точка перегиба на кривой.
7. Рассчитать равновесную концентрацию иода по формуле, вытекающей из закона эквивалентов
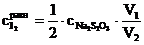 ,
,
где 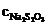 − молярная концентрация раствора тиосульфата натрия; V1 − объем раствора тиосульфата, пошедший на титрование иода в момент равновесия, мл; V2 − объем взятой пробы, мл.
− молярная концентрация раствора тиосульфата натрия; V1 − объем раствора тиосульфата, пошедший на титрование иода в момент равновесия, мл; V2 − объем взятой пробы, мл.
8. Рассчитать равновесный состав смеси, построив следующую таблицу:
| Вещество
| Начальный состав, моль/л
| Прореагировало (образовалось)
к моменту
равновесия, моль/л
| Равновесный состав, моль/л
|
| Fe2(SO4)3
| 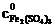
| 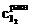
| 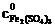 
|
| KI
| 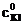
| 2 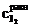
| 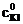 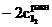
|
| I2
| 0
| 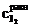
| 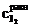
|
| FeSO4
| 0
| 2 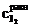
| 2 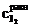
|
| K2SO4
| 0
| 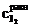
| 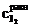
|
9. Рассчитать константу равновесия К при температуре опыта Т1, используя найденные значения равновесных концентраций участников реакции по формуле закона действия масс:
 .
.
10. В такой же последовательности (пункты 1.9) провести опыт при температуре Т2 и рассчитать константу равновесия при этой температуре  .
.
11. Рассчитать стандартные термодинамические параметры реакции:
● тепловой эффект ΔН0 по формуле
 ;
;
● изобарно-изотермический потенциал реакции (изменение свободной энергии Гиббса)
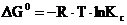 ;
;
● изменение энтропии реакции:
 .
.



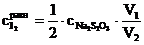 ,
,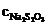 − молярная концентрация раствора тиосульфата натрия; V1 − объем раствора тиосульфата, пошедший на титрование иода в момент равновесия, мл; V2 − объем взятой пробы, мл.
− молярная концентрация раствора тиосульфата натрия; V1 − объем раствора тиосульфата, пошедший на титрование иода в момент равновесия, мл; V2 − объем взятой пробы, мл.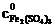
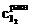
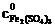

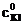
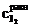
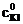
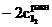
 .
. .
. ;
;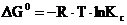 ;
; .
.


