Постарайтесь представить себе достаточно несложный по сегодняшним возможностям эксперимент. Прежде всего, что Вы будете делать, чтобы померить напряжение в сети, от которой питается Ваша настольная лампа? Думается, многим из Вас знаком прибор под названием тестер (официально он называется омампервольтметр или как-то похуже), в котором есть непосредственно измеритель (в простейшем варианте струнный гальванометр) и два провода — электрода, кончики которых мы можем аккуратно ввести в электрическую розетку. Обнаружив, что измеритель показал 205—210 В (на 220 рассчитывать не очень приходится, учитывая, что в нашей стране всё воруют), мы сразу успокаиваемся: напряжение измерено. А теперь представьте себе, что Вам надо померить напряжение (давайте начнём пользоваться более «физиологичным» понятием — потенциал) на мембране нейрона. Принцип-то измерения будет точно таким же: нужен измеритель и нужны электроды. Только надо учесть миниатюрность всего того, что мы собрались измерять, поэтому и электроды будут особо тонкими (микроэлектроды), и сам измеритель гораздо чувствительнее, чем для бытовых нужд. Ведь в нейронах (забегаем вперёд) потенциалы на 3 порядка слабее, чем в розетке: милливольты (мВ), а не вольты.
Как раз теперь самое время поговорить о методах измерений электрических процессов в живых системах. В принципе не так уж и важно, что мы меряем: потенциалы отдельных нейронов (или даже участков их мембраны), их больших или сравнительно небольших скоплений — модулей (так называемые фокальные потенциалы), суммарные потенциалы больших участков мозга (например, ЭЭГ — электроэнцефалография), потенциалы сердца (ЭКГ — электрокардиография), или что-то другое. Подход к измерениям достаточно стандартен (рис. 18).
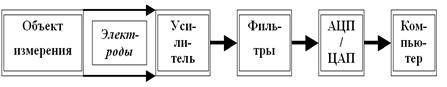
Рис. 18. Принципиально необходимые компоненты современной электрофизиологической аппаратуры (объяснения в тексте).
Нужны электроды для отведения потенциала от объекта измерения. Если объект маленький, используются микроэлектроды (как правило, стеклянная микропипетка, заполненная каким-то электролитом, например, KCl), если покрупнее — макроэлектроды. Так как потенциалы и токи в живых системах очень слабы, необходимо уметь их усиливать при регистрации. Поэтому во всей электрофизиологической аппаратуре есть специальные усилители. При усилении сигнала возникает серьёзная проблема: вокруг нас очень много всяческих электрических и радиотехнических приборов (радиотелефоны, телевизоры, пылесосы, трамваи и прочие достижения цивилизации), создающих массу помех; «шумят» и живые клетки. Усиливая интересующий нас сигнал, мы автоматически усиливаем и сопровождающие его шумы. И здесь есть опасность вообще потерять сигнал в этом море помех.
Поэтому в современных электрофизиологических приборах обязательно присутствуют специальные фильтры, позволяющие вырезать сигнал из шума. И, наконец, зарегистрированный, усиленный и очищенный от помех сигнал надо как-то увидеть и зафиксировать, то есть сохранить. Так как сегодня аппаратура для измерений компьютерная, с этим проблем нет. Надо только преобразовать те электрические изменения, которые мы поймали нашими электродами (так называемый аналоговый сигнал), в цифровую форму, понятную компьютеру. Это умеют проделывать АЦП — аналогово-цифровые преобразователи (есть, кстати, и обратные преобразователи — ЦАП). Теперь уже ничто не помешает увидеть зарегистрированные биопотенциалы на экране монитора компьютера, записать их в память, обработать любым способом и т. д.
Однако вернёмся к нашему эксперименту. Представьте себе, что мы получили возможность поработать с отдельным нейроном. Не слишком важно, что это за нейрон, и каким конкретным методом мы будем к нему подбираться. Это может быть нервная клетка одного из отделов мозга (рис. 19), до которой мы добрались, предварительно занаркотизировав (подобно операционному наркозу в хирургических клиниках) животное, закрепив его голову в специальном станке (стереотаксисе), сняв участок скальпа, проведя трепанацию черепа (проще говоря, просверлив череп в строго определённом месте) и с по мощью микроманипулятора введя микроэлектрод в чётко известную структуру мозга (вводить мы его будем по координатной сетке трёхмерного атласа — такие атласы есть практически для всех лабораторных животных).
Это может быть один из нейронов тончайшего переживающего среза одной из мозговых структур (переживающими такие срезы — слайсы = slices — называют не за особую эмоциональность, а за то, что в искусственно созданной среде эти мозговые срезы надолго переживают своего хозяина — крыску, хомячка, морскую свинку и т. д.).
Это может быть одна из клеток культуры нервной ткани: для тех, кто наслышан про пресловутое клонирование, возможность выращивания в чашке Петри целой популяции одинаковых клеток из одной первоначально взятой не кажется фантастикой.
Наконец, это может быть периферический отросток (лучше —аксон) нервной клетки какого-нибудь животного; первые эксперименты, подобные обсуждаемому нами, так и делались: в 40—50-е годы ХХ века великолепная группа физиологов под руководством Алана Ходжкина смогла понять механизмы возникновения биопотенциалов благодаря работе на гигантском аксоне кальмара (сами-то кальмары не были гигантскими, просто для эффективной работы реактивного двигателя этого животного — колокола, из-под которого «выстреливает» вода, — нужна очень высокая скорость распространения нервных импульсов вдоль колокола, а чем больше диаметр волокна, тем быстрее по нему бегут импульсы, поэтому у знакомых всем по салатам кальмаров аксоны мотонейронов можно увидеть невооружённым глазом).
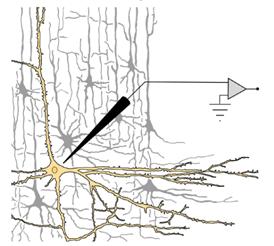
Рис. 19. Вполне правдоподобный рисунок, воспроизводящий принцип микроэлектродного отведения потенциалов от одиночного нейрона.
Итак, наша первая насущная задача — выяснить, есть ли на мембране аксона, находящегося в состоянии покоя (во время межимпульсного интервала), какой-либо электрический потенциал, и если есть, то какой. Используем уже упоминавшийся микроэлектрод. Подводим его кончик непосредственно к мембране аксона. Второй электрод — здесь вполне подойдёт и макроэлектрод — помещаем где-то поблизости, не очень заботясь о точности его расположения: так как нам нужно мерить разность потенциалов, обязательно нужны два электрода — активный (микроэлектрод) и индифферентный (можно макро-). Подсоединяем оба электрода к измерительной аппаратуре, включаем и… на нашем мониторе мы видим тоскливую прямую: разность потенциалов (давайте говорить проще — потенциал) равна нулю, то есть её просто нет при расположении обоих электродов снаружи от мембраны (рис. 20).
Теперь начинаем осторожно, с помощью микроманипулятора, опускать микроэлектрод. В какой-то момент его кончик проткнёт мембрану и войдёт внутрь нервной клетки (не надо пугаться: ведь мембрана — это жидкий бислой липидов, так что с нейроном ничего не случится; вспомните: «нож сквозь масло»). И именно в этот момент мы увидим на экране резкий скачок уровня потенциала — до 60—70 мВ, причём, судя по показателям, внутренняя поверхность мембраны окажется заряженной отрицательно по отношению к наружной поверхности.
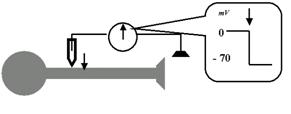
Рис. 20. Измерения мембранного потенциала нейрона в состоянии покоя, то есть во время межимпульсного интервала. Пока микроэлектрод находится на поверхности мембраны, регистрируется отсутствие значимой разности потенциалов между ним и макроэлектородом, который может находиться достаточно далеко от данного нейрона. Как только с помощью микроманипулятора мы опускаем кончик микроэлектрода и «входим» под мембрану (этот момент обозначен стрелкой), наша измерительная аппаратура улавливает резкий скачок потенциала: внутренняя поверхность мембраны оказывается значительно (на десятки милливольт) более электроотрицательной, чем наружная. Это и есть потенциал покоя мембраны (ПП).
Итак, установлен первый вполне конкретный научный факт: во время межимпульсной паузы, в состоянии релаксации, покоя, внутренняя поверхность мембраны нейрона заряжена отрицательно относительно наружной, и уровень этого потенциала колеблется (в зависимости от условий конкретного опыта) около 60—70 мВ. Поздравляю: мы зарегистрировали ПП — потенциал покоя мембраны!
На конкретные значения ПП не стоит обращать особого внимания: в зависимости от того, какую возбудимую клетку мы обследуем, у какого животного, в каких условиях, значения могут несколько меняться. Здесь важно другое: устойчивый, всегда воспроизводимый факт наличия отрицательного электрического заряда на внутренней поверхности мембраны. Откуда же он взялся? Для ответа на этот вопрос вспомним недавний разговор про мембрану и её свойства. И снова речь пойдёт об особенностях химического градиента ионов по разные стороны мембраны и об ионных каналах.
В своих, ставших сегодня уже классическими экспериментах сотрудники группы Ходжкина обнаружили, что в состоянии покоя на нейрональной мембране открыты каналы одного-единственного вида:
K+-поры. Давайте ещё раз вспомним, что означает такое название: во-первых, это поры, стало быть, ворота у них отсутствуют, и они открыты всегда; во-вторых, это K+-каналы, то есть они пропускают почти исключительно ионы K+ по градиенту концентрации. А как направлен химический градиент K+? Изнутри наружу клетки. То есть ионы K+ будут выходить через эти каналы наружу (рис. 21). А теперь самый ключевой вопрос: до каких пор будет происходить этот выход K+?
Ответ, казалось бы, напрашивается сам собой: до тех пор, пока концентрация этих ионов по разные стороны мембраны не станет одинаковой. И этот ответ был бы верным (ведь он вполне в русле термодинамических законов), если бы не одно существенное обстоятельство: мы имеем дело не с простыми электрически нейтральными веществами, а с ионами. А в этом случае устранение одной «несправедливости» (неравенства концентраций) неизбежно приведёт к возникновению другой «несправедливости» — неравенству электрических зарядов по разные стороны мембраны. Ведь с каждым выходящим из клетки по градиенту концентрации ионом K+ клетка одновременно теряет и положительные заряды, которые перетекают на наружную поверхность мембраны
(рис. 22).
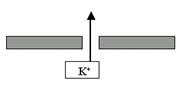
Рис. 21. В состоянии покоя ионы K+ через поры выходят из клетки по градиенту концентрации.
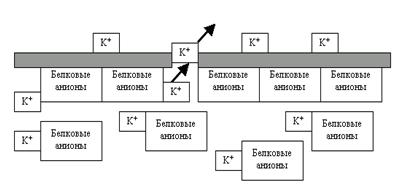
Рис. 22. Выход ионов K+ из клетки по градиенту концентрации приводит к созданию электрического градиента на мембране: внутри клетки накапливаются «осиротевшие» белковые анионы (следовательно, отрицательные заряды), а снаружи катионы K+, то есть положительные заряды.
То есть в клетке формируется дефицит плюсов (зато избыток минусов — не забывайте, например, про белковые анионы, которым через каналы не пройти при всём желании), а вокруг неё — избыток тех же самых плюсов. Стало быть, возникает электрическое неравновесие, электрический градиент на мембране
Вернёмся к ключевому вопросу: до каких же пор возможен выход ионов K+ из клетки? Если до сих пор не догадались, попробуем вспомнить младшешкольную физику. Мы с Вами стараемся понять механизмы, формирующие ПП мембраны. При каких условиях некое вполне материальное тело находится в состоянии покоя (или равномерного прямолинейного движения — что, по существу, одно и то же)?
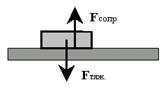
Представьте себе, что на Вашем письменном столе лежит книжка. Почему она не падает на пол и не взлетает к потолку? Надеюсь, Вы вспомнили: потому что силы, действующие на эту книжку, равны и направлены в противоположные стороны (рис. 23). Сила тяжести тянет эту книжку вниз, а сила сопротивления (противодействия) опоры (стола) столь же решительно препятствует этому.
| Рис. 23. Книжка будет спокойно лежать на столе при условии равновесия двух диаметрально противоположно направленных сил: силы тяжести (Fтяж) и силы сопротивления опоры (Fсопр).
| |
Какое это отношение имеет к ионным процессам на мембране нейрона? Самое прямое! Мы с Вами стараемся понять механизмы, формирующие потенциал покоя (ПП) мембраны. Мы (вслед за группой Ходжкина) выяснили, что в покое на мембране формируются две силы: химический градиент ионов K+ (провоцирующий выход этих ионов из клетки через поры) и встречный электрический градиент (то есть потенциал), связанный с потерей клеткой положительных зарядов. Тогда становится понятным, что условием равновесного («спокойного») состояния мембраны является равновесие этих двух диаметрально противоположно направленных сил (рис. 24).
Необходимо подчеркнуть два момента: во-первых, когда мы говорим о выходе ионов калия из клетки и «выстраивании» их по наружной поверхности мембраны, речь идёт исключительно о тончайшем примембранном слое, чуть дальше в межклеточном пространстве концентрация K+ по-прежнему будет значительно ниже, чем внутри клетки. Во-вторых, описанное нами на качественном уровне объяснение механизма формирования ПП может быть представлено гораздо строже, если мы воспользуемся так называемым уравнением Нернста.
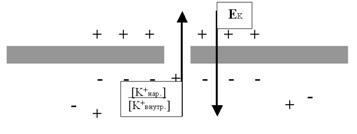
Рис. 24. Потенциал покоя (ПП) или равновесный калиевый потенциал (EK), существующий на мембране возбудимой клетки в период межимпульсного интервала, уравновешивает химический градиент по калию ([K+нар] / [K+внутр]).
Вопреки прозрачным намёкам некоторых учебников немецкий учёный Нернст не был физиологом (тем более — нейрофизиологом, ведь в XIX веке эта наука только зарождалась); он был выдающимся физхимиком. И своё уравнение диффузии ионов через полупроницаемые мембраны он вывел как общую закономерность, а вовсе не для описания транспорта K+ через нейрональную мембрану. Но знаменитым стало именно нейробиологическое приложение его закона. Итак, что же это за формула?
EK = (R × T / F × Z) × ln ([K+нар] / [K+внутр]),
где EK — электрический потенциал мембраны по K+,
R — газовая постоянная,
T — абсолютная температура,
F — число Фарадея,
Z — валентность иона K+,
[K+нар] / [K+внутр] — градиент концентрации ионов K+ снаружи и внутри клетки.
Учитывая, что эта книга написана в том числе и для убеждённых гуманитариев, постараемся помочь им преодолеть священный ужас перед любыми формулами. Вглядитесь повнимательней: первые четыре переменные в данном уравнении — это вполне конкретные численные значения, которые легко можно найти в любом физическом или химическом справочнике. Логарифмирование — не более чем математический приём.
Что же тогда остаётся? То, что равновесный калиевый электрический потенциал на мембране нейрона при стандартных условиях зависит от соотношения концентрации ионов K+ снаружи мембраны к их концентрации внутри:
EK» – ([K+нар] / [K+внутр]).
Значком» мы рискнули обозначить некое принципиальное соответствие правой и левой частей выражения, потому что знак равенства ставить теперь мы уже не имеем права; а минус перед правой частью выражения неизбежно должен был появиться при уходе от логарифмирования (вспомните: при логарифмировании дроби, в которой числитель меньше знаменателя, получается отрицательное число). Таким образом, при анализе уравнения Нернста смысловое содержание нашего качественного рассуждения вполне подтвердилось. Хочется ещё раз подчеркнуть, что формализация электрохимического сопряжения приложима ко всем вариантам ионных токов через мембраны. Не случайно на базе полного уравнения Нернста (в него входят ионные градиенты не только для калия, но и для натрия и хлора) Гольдманом, а чуть позднее Ходжкиным, Хаксли и Катцем были прописаны уравнения «постоянного поля» нейрона, ставшие сегодня одной из основ математического моделирования электрических процессов на мембране нейронов (заметим в скобках, что к передаче информации подобного рода модели имеют самое прямое, но — увы! — пока ещё весьма далёкое отношение).
Если у Вас сложилось впечатление, что с причинами возникновения ПП теперь всё ясно, вынужден Вас огорчить. Оказывается, если действительно подставить в уравнение Нернста все необходимые численные значения, то вычисленный уровень ПП окажется не совсем таким, как экспериментально измеренный.
Несложные вычисления приведут к значениям EK» –85 мВ, а реальные измерения дают, как Вы помните, цифры около –60—70 мВ. Почему такое расхождение, нет ли ошибки в самой гипотезе?
И да, и нет. Нет, потому что бесчисленные измерения абсолютно однозначно показывают, что именно калиевый ток через мембрану является главным, доминирующим фактором формирования ПП. Да, потому что мы имеем дело с живой системой, в которой не может быть ничего абсолютного. Сегодня хорошо известно, что в покое мембрана нейрона пропускает по градиентам концентраций не только ионы калия, но и натрий, хлор и т. д. Другое дело, что их суммарный вклад в конечный уровень ПП невелик, хотя и, как Вы видите, заметен.
Потенциал действия (ПД), или нервный импульс (спайк)
Теперь, когда мы выяснили, что в покое мембрана нейрона уже заряжена (поляризована), пришла пора обратиться непосредственно к потенциалу действия (ПД). Представьте, что у регистрируемого нами нейрона закончился межимпульсный интервал и мы дождались импульса. Или, чтобы не ждать милостей от нейрона, мы через так называемые стимулирующие электроды (к замечательному прибору электростимулятору мы ещё вернёмся попозже) нанесли на поверхность этого нейрона слабенький (всего-то несколько милливольт) стимул. И вспомните
рис. 17. На нём отдельные импульсы выглядят как вертикальные чёрточки, что неудивительно: длительность ПД составляет одну-две миллисекунды (мс) — интервал времени, уловить который без аппаратуры человеку не дано. Да и на слух, если нашу регистрирующую аппаратуру дополнить динамиками, импульсная активность нейрона звучит как беспорядочная автоматная стрельба на бейрутских улицах.
Что же делать, если изучаемый нами объект так миниатюрен и по амплитуде (десятки милливольт), и по длительности (миллисекунды)? Ответ, вообще говоря, хорошо известен: чтобы увидеть инфузорию-туфельку, надо взять микроскоп. Нам даже и микроскопа не надо, чтобы увеличить наш ПД. Надо просто растянуть на экране компьютера ось времени (X) и ось амплитуды ПД (Y), и мы увидим нервный импульс во всех деталях (рис. 25).
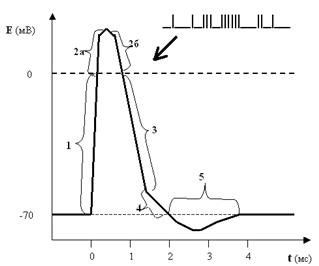
Рис. 25. Потенциал действия (ПД) мембраны нейрона или нервный импульс. Цифрами обозначены фазы ПД: 1 — деполяризация; 2а и 2б — реверсия или овершут; 3 — реполяризация; 4 — следовая деполяризация; 5 — следовая гиперполяризация.
Оказывается, ПД имеет достаточно сложную форму, и, двигаясь по оси времени, мы можем разложить его на 5 фаз:
фаза деполяризации — от исходного уровня ПП до 0 (то есть мембрана в это мгновение электронейтральна);
реверсия ПД или овершут — уровень ПД выше 0 (то есть в этот момент мембрана внутри становится заряженной положительно, а не отрицательно, как было в покое);
фаза реполяризации — уровень мембранного потенциала демонстрирует явственное стремление вернуться к исходному уровню ПП;
следовая деполяризация — спад графика ПД становится менее крутым, то есть к исходному уровню ПП потенциал мембраны возвращается несколько медленнее, чем во время реполяризации;
следовая гиперполяризация — в этот короткий период времени мембрана поляризована даже больше, чем в состоянии покоя.
Не стоит сразу пугаться этих новых терминов: они вполне доступны пониманию и весьма информативны. Мы теперь знаем, что в покое мембрана заряжена, или поляризована. Это и есть коренное слово. А дальше — работа с приставками: де- — приставка негативная, отрицательная; действительно, и в 1-й, и в 4-й фазах мембрана менее поляризована, чем в покое; ре- — возвратная приставка (ретро-), соответственно, в 3-й фазе мы видим возвращение ПД (вектор) к исходному уровню. Гипер- — слишком, чересчур; действительно, в 5-й фазе мембрана поляризована слишком сильно, больше, чем в покое. Наконец, обозначения 2-й фазы выходят за рамки этого правила, просто и реверсия, и овершут — это переворачивание чего-то, в нашем случае — мембранного потенциала.
Но назвать ещё не значит объяснить. Давайте разбираться, почему мембрана нейрона в ответ на электрический стимул так прихотливо меняет свой заряд. И снова пойдём по стопам группы Ходжкина.
Начнём с фазы деполяризации. Почему в ответ на внешний стимул поляризация мембраны начинает очень быстро уменьшаться? Оказывается, в это мгновение на мембране начинают активироваться потенциалзависимые натриевые каналы (рис. 26).
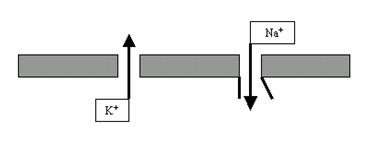
Рис. 26. В ответ на электрический стимул на мембране нейрона наряду с постоянно открытыми K+-порами открываются потенциалзависимые Na+-каналы, обеспечивающие входящий натриевый ток.
В названии этих каналов — 2 ключевых слова: во-первых, они селективны по Na+; а во-вторых, они активируются только при вполне определённых изменениях электрического потенциала мембраны.
И вот этот второй момент заставляет нас вернуться к понятиям «стимул» и «электростимулятор». Конечно, можно во время исследования спокойно ждать, когда на нейроне возникнет очередной нервный импульс, тем более что всегда молчащих нейронов по определению не бывает. Но гораздо удобнее, если мы будем точно знать, когда возникнет ПД, а для этого проще всего самим спровоцировать его возникновение.
это можно сделать, нанеся на нейрон адекватный (соответствующий его свойствам) стимул. Раз речь идёт о потенциалзависимых каналах мембраны, то стимул должен быть электрическим. И сформировать этот стимул мы можем с помощью лабораторного электростимулятора
(рис. 27).
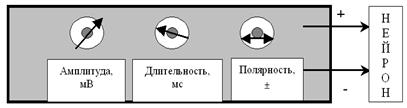
Рис. 27. Примитивный лабораторный электростимулятор позволяет регулировать амплитуду стимула (от 0 до нескольких десятков тысяч милливольт), его длительность (от долей миллисекунды до десятков секунд) и полярность (+ или –). Стимул представляет собой прямоугольный (П-образный) импульс постоянного тока.
Хорошо известно, что электрические процессы в наших нейронах нужно имитировать не привычным для нас переменным током, а импульсами постоянного тока. Уже совсем скоро (при рассмотрении синапса) мы с Вами поймём, с чем это связано. Именно для имитации реально происходящих в нейронах процессов и были сконструированы первые электростимуляторы данного типа.
Итак, мы возвращаемся к ПД. Что же происходит в нейроне сразу в ответ на стимул?
Если мы подадим на мембрану слабый (всего несколько милливольт) прямоугольный катодический (то есть идущий от отрицательного полюса нашего стимулятора) стимул, возникнет начальная деполяризация мембраны. Этого незначительного сдвига мембранного потенциала в сторону 0 достаточно, чтобы активировалась первая порция потенциалзависимых Na+-каналов.
Естественно, через них с существенно большей вероятностью, чем в покое, возникнет входящий Na+-ток. Катионы Na+, входя в клетку по градиенту концентрации, уменьшают электроотрицательность внутренней поверхности мембраны, то есть деполяризуют её ещё больше (рис. 28).
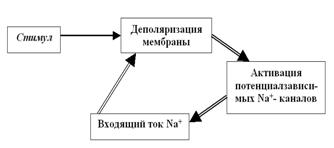
Рис. 28. Цикл Ходжкина, обеспечивающий восходящую фазу (фазу деполяризации) ПД. Обратите внимание: стимул нужен только на начальном этапе — для запуска цикла Ходжкина, а дальше процесс развивается самопроизвольно, по механизму положительной обратной связи. В результате возникает лавинообразно нарастающий входящий ток катионов Na+.
Круг замкнулся, и теперь все будет повторяться и повторяться.
Впервые этот механизм был описан всё той же группой Ходжкина и в мировой литературе получил наименование «цикл Ходжкина». По существу, это классический пример системы с положительной обратной связью. Здесь каждый предыдущий шаг подстёгивает следующий за ним, усиливая эффект. В биологических системах такого рода механизмы встречаются не слишком часто (в тех случаях, когда или требуется усилить эффект, или нужно синхронизировать изначально независимые процессы — например, при брачном поведении у животных).
В технике системы с положительной обратной связью мы видим сплошь и рядом: это один из самых распространённых видов усилителей.
Цикл Ходжкина поучителен, по крайней мере, по двум причинам.
Во-первых, мы видим, как остроумно природа решила проблему быстрого усиления входящего тока Na+ и, соответственно, деполяризации мембраны. Не случайно во многих книжках процесс нарастания входящего натриевого тока называют лавинообразным.
Во-вторых, становится более понятной роль начального стимула в запуске ПД. Это, по существу, аналог стартёра в современном автомобиле: маленький слабый электромоторчик, работающий от аккумулятора, может раскрутить тяжёлый на подъём двигатель внутреннего сгорания («завести» его), а дальше он будет работать вполне самостоятельно («самопроизвольно», как сказали бы мы).
На стартёре, в принципе, тоже можно проехать несколько метров, но лучше этого не делать из гуманистических соображений. И на мембране нейрона стимул тоже нужен только «на старте» ПД, а дальше процесс поддерживает себя сам. Очень важный вопрос «а всякий ли стимул запустит ПД?» мы проанализируем немножко попозже.
И ещё один вопрос, связанный с восходящей фазой ПД. Если цикл Ходжкина — самоусиливающийся процесс, то почему он не развивается бесконечно, что служит ограничителем входящего тока Na+? Ответов несколько. Прежде всего это уже обсуждавшееся нами уравнение Нернста, описывающее взаимосвязь электрического потенциала полупроницаемой мембраны и концентрационных градиентов. Естественно, что изменение градиента (одной из действующих сил) неизбежно ведёт и к изменениям потенциала (второй силы), и далее по циклу.
Число потенциалзависимых каналов на данном участке мембраны хоть и велико, но не бесконечно. А если учесть, что только что активировавшийся канал не может сразу же открыться вторично (о причинах этого мы поговорим чуть позже), становится понятным наличие ограничений на циклические процессы на мембране. Есть и ещё несколько менее значимых факторов, обсуждение которых мы вынесем за скобки.
Итак, вопрос о механизме деполяризации более или менее прояснился. Но ПД развивается дальше, и после пика реверсии, когда внутренняя поверхность мембраны становится положительно заряженной, наступает фаза реполяризации. Какие мембранные механизмы обеспечивают её развитие? Мы должны назвать, как минимум, три фактора:
в результате инактивационных процессов закрываются Na+-каналы и прекращается (точнее, минимизируется) входящий натриевый ток;
продолжается выходящий ток K+ через поры;
развивается дополнительный выходящий ток K+ через потенциалзависимые калиевые каналы (рис. 29).
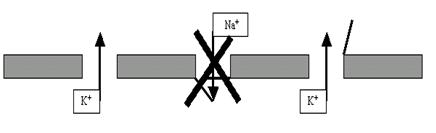
Рис. 29. Фаза реполяризации ПД обусловлена, как минимум, тремя факторами: а) прекращением входящего тока Na+; б) продолжением выхода K+ через поры;в) дополнительным выходящим током K+ через потенциалзависимые калиевые каналы.
Думается, Вы почувствовали, что если два первых фактора вполне очевидны, то третий требует дополнительных разъяснений. В самом деле, что же это за «дополнительные» потенциалзависимые K+-каналы, которые активируются так своевременно? И этому открытию уже полвека. Действительно, мы же нигде не оговаривали, что эксклюзивным правом открываться в ответ на изменения потенциала мембраны обладают только Na+-каналы. Белковые субъединицы, образующие K+-каналы, тоже могут быть чувствительными к этим изменениям. Тогда, может быть, для их активации требуются какие-то другие, отличающиеся от необходимых для Na+-каналов параметры изменений потенциала мембраны? Да нет, диапазон примерно тот же. А раз так, значит, эти K+-каналы активируются в ответ на тот же начальный стимул, что и Na+? Ответ пугающе прост: да!
Вдумайтесь в этот ответ! Если каналы для двух катионов (натрия и калия) открываются в ответ на сходные изменения потенциала мембраны, то есть на один и тот же стимул, а градиенты концентраций этих катионов направлены навстречу друг другу, то должен возникнуть встречный ток двух этих ионов, и об изменениях потенциала на мембране можно вообще забыть. Но эти изменения есть, иначе информация Вашим мозгом не могла бы обрабатываться, и Вы не могли бы читать эти строки. Где же нестыковка? Какие факторы не были учтены?
Чтобы разобраться, нам придётся ввести одно из ключевых понятий мембранологии: проницаемость мембраны для ионов (g). Этот термин означает, сколько данных ионов (Na+, K+, Cl– и т.д.) пропустит единица площади данной мембраны (например, 1 квадратный нанометр) в единицу времени (например, в 1 миллисекунду). Когда мы упоминали уравнения Ходжкина — Хаксли, Катца и др., вскользь было сказано, что они являются развитием идеи Нернста; так вот, одним из элементов этого развития как раз и было введение в уравнения показателя проницаемости мембраны для данных конкретных ионов.
Нам этот показатель сейчас нужен для того, чтобы разобраться в загадке «встречных перевозок» катионов через мембрану. Оказывается, хотя процесс активации ионных каналов Na+ и K+ и начинается одновременно (в ответ на стимул), скорость нарастания этой активации, и соответственно проницаемости, существенно различна для ионов Na+ и K+ (рис. 30).
Скорость нарастания (а затем и спада) натриевой проницаемости намного выше, чем калиевой. Поэтому массированный вброс Na+ в первые мгновения ПД существенно опережает медленно нарастающий выход K+, даже несмотря на то, что калиевая проницаемость мембраны изначально больше (за счёт постоянно открытых калиевых пор). Соответственно, входящий и выходящий катионные токи разведены по времени, и вслед за деполяризацией развивается реполяризация мембраны.
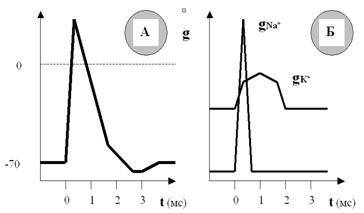
Рис. 30. В одном временном масштабе показаны ПД (А) и изменения проницаемости мембраны (Б) для ионов Na+ и K+. Хорошо видно, что проницаемость для Na+ резко возрастает в ответ на стимул и так же быстро падает почти до нуля. Проницаемость для K+ начинает возрастать одновременно с натриевой, но увеличивается и спадает гораздо медленнее. Кроме того, проницаемость мембраны для K+ уже изначально гораздо выше, чем для Na+, так как калиевые поры остаются открытыми всё время.
По существу, с завершением фазы реполяризации завершаются и главные информационно значимые процессы на мембране. Далее, как Вы помните, развиваются следовые процессы, характер которых может различаться в разных возбудимых клетках (вплоть до перемены местами следовой деполяризации и гиперполяризации), и которые, видимо, «не считываются» нашим белковым компьютером напрямую. Но это не значит, что они не влияют на мозговые коды и соответственно на обработку информации. Сегодня существуют вполне биологоправдоподобные модели нейронных сетей, в которых главным изменяемым параметром является период следовой гиперполяризации. Эти виртуальные «мозги» вполне успешно справляются с весьма сложными задачами, что подтверждает небезразличность для информационных процессов следовых («остаточных», как может казаться) изменений поляризации.
Однако эти тонкости выходят за пределы нашей книжки. Нам хотелось бы показать на примере следовых процессов значимость ещё одного транспортного механизма мембраны. Речь пойдёт об ионных насосах. Мы с Вами уже рассматривали общие принципы их работы, так что теперь можем обсудить только самое главное.
Посмотрите ещё раз на рисунок ПД (рис. 31). Совершенно ясно, что к моменту завершения процесса реполяризации соотношения ионных градиентов по обе стороны мембраны явно не соответствуют «нормативным параметрам», характерным для ПП.
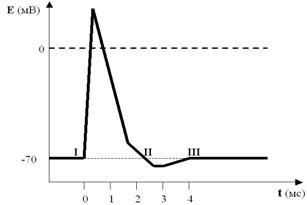
Рис. 31. И снова ПД со всеми его фазами. Обратите внимание на точки I, II и III. Как видите, они лежат на одной прямой, то есть уровень мембранного потенциала в них один и тот же (как мы договорились, около –70 мВ). А что Вы скажете об ионных градиентах по обе стороны мембраны? Ведь совершенно очевидно, что в I и III точках они совпадают или почти совпадают. А во II точке?
Тем не менее после окончания следовых процессов мембрана
вполне готова к генерации нового импульса (строго говоря, она готова к этому и несколько раньше, но об этом мы ещё поговорим), потому что к этому моменту уровни катионных градиентов успевают вернуться к исходным значениям.
Единственным механизмом, способным так быстро восстанавливать ионные градиенты, является ионный насос. В разбираемом нами случае это Na+-K+-ионообменник, или Na+-K+-помпа. Вы, конечно, помните, что такой насос качает ионы против градиента концентрации, затрачивая на это энергию АТФ.
Вопреки декларациям многих современных учебников я утверждаю (основываясь на экспериментальных данных, естественно), что эти насосы работают непрерывно, постоянно поддерживая неравновесие концентраций ионов по разные стороны мембраны. Как Вы уже поняли, во время ПД такое неравновесие нарушается особенно сильно. Замечательно, что натрий-калиевый насос в это время резко увеличивает свою активность, чему способствует его особое свойство — электрогенность (это значит, что он активируется при изменении мембранного потенциала, то есть именно во время ПД). А дальше — своеобразный эффект маскировки: пока потенциалзависимые каналы открыты и пропускают ионы по их концентрационным градиентам, интенсивная работа насосов относительно незаметна и обнаруживается только при достаточно тонкой постановке экспериментов, когда же процессы деполяризации и реполяризации остались позади — активный ионный транспорт с помощью насосов проявляется во всей красе. Таким образом, именно во время следовых процессов мы наиболее явно обнаруживаем присутствие на мембране энергозависимых ионообменников — насосов (рис. 32).
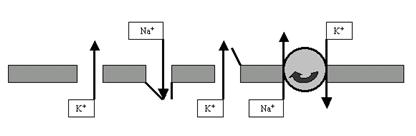
Рис. 32. Относительно полная схема мембраны нейрона, описывающая базовые процессы, которые обеспечивают формирование ПП и ПД: K+-поры (открыты всегда и участвуют как в ПП, так и в ПД), Na+-потенциалзависимые каналы (главный фактор фазы деполяризации ПД), K+-потенциалзависимые каналы (наряду с порами обеспечивают фазу реполяризации ПД), Na+-K+-помпа (восстанавливает и поддерживает катионные градиенты на мембране).
Свойства потенциала действия (ПД)
Хочется надеяться, что мы с Вами разобрались в основных процессах, формирующих элементы «языка мозга» — нервные импульсы.
Но нужно шагать дальше, ведь импульсы способны распространяться только по мембране одного нейрона. Для того чтобы закодированная их последовательностью информация могла быть передана следующему нейрону, требуется преодолеть щелевой контакт между возбудимыми клетками — синапс. А в синапсе принципы передачи и переработки информации будут не совсем такими, как на обычной электрогенной мембране (например, мембране аксона).
Парадокс заключается в том, что мы не сможем понять принципы работы синапса, если не разберём ещё один важный момент в принципах работы аксональной мембраны — так называемые свойст




















