Открытие коровьего ольфакторного белка, впоследствии получившего название ОСБ (одоранто-связывающего белка), оказалось куда интереснее, чем мы сначала предполагали, и имело далеко идущие последствия. Оно стало поворотной точкой в исследованиях обоняния: многие ученые наконец сочли биохимическое изучение обоняния вполне выполнимой задачей, достойной и внимания, и ресурсов.
Шаг первый: изоляция
Первым делом искомый белок надо было изолировать, чтобы подробно выяснить, как он устроен и каким образом связывает лиганд. А возможно, даже и сформулировать гипотезу о его физиологических функциях. На этом этапе Кришна Персо, разделивший со мной анростеноновое фиаско (в дальнейшем мы стали не только постоянными коллегами, но и хорошими друзьями), получил докторскую степень в лаборатории Джорджа Додда в Уорике и перебрался ко мне, в Пизу, чтобы заняться нашим новым загадочным белком.
Примерно в то же время другая итальянская исследовательская группа, возглавляемая Андреа Каваджони (из Пармского университета), заинтересовалась проектом, и мы решили объединить силы, чтобы получить образец белка, достаточно чистый, чтобы можно было завершить характеризацию.
В отсутствие любой информации по структуре нам нужно было провести белок через несколько последовательных стадий очистки, отслеживая связанный радиоактивный пиразин (тот одорант с запахом сладких перцев). К счастью, взаимодействие между маркированным пиразином и ОСБ было достаточно прочным, чтобы пережить несколько элюирований в лабораторной колонке. Измеряя радиоактивность в элюированных фракциях, мы могли легко обнаружить те, в которых содержался белок. В итоге изолировать его оказалось проще, чем мы ожидали, – благодаря изобилию биоматериала и его удачным химическим свойствам.
Тем не менее на эту задачу ушло три года. Мы работали со скоростью улитки, тратили время на эксперименты второго порядка, которые не добавляли никакой важной информации, потому что не оценили толком, какой интерес наше открытие способно вызвать. После первого успеха мы поняли, что все еще далеки от обнаружения ольфакторных рецепторов, – это несколько пригасило наш энтузиазм. На какое-то время мы погрузились в рутину, которая временами начинала казаться скучной и бессмысленной. К счастью, на нас не давила конкуренция со стороны других исследовательских групп: указанным подходом до сих пор пользовались мы одни.
Впрочем, вскоре события начали развиваться очень быстро.
Соревновательность стимулирует науку
К тому времени как наши данные были уже практически готовы для публикации, до нас дошли слухи еще об одной американской группе, у которой есть очищенный образец того же самого белка. Соломон Снайдер из Университета Джона Хопкинса (Балтимор) не так давно уже засветился с открытием опиоидных рецепторов, за которое получил престижную премию Ласкера. Обнаружив, что с нами конкурирует такая опытная и сильная исследовательская группа, мы первым делом чуть не бросили проект – нам вдруг остро захотелось заняться чем-то очень обычным и приятным.
Однако куда мудрее было бы поскорее закончить эксперименты и пришпорить публикацию результатов. В итоге две статьи были опубликованы практически одновременно: наша – в European Journal of Biochemistry [1] и снайдеровская – в Proceedings of the National Academy of Sciences [2].
Обе вызвали огромный интерес; вся наука об обонянии разом стряхнула летаргию предшествовавшего периода. Казалось, весь мир ждет нового, более прямого подхода к работе с ольфакторным кодом и молекулярными механизмами, ответственными за восприятие запахов. И вот он наконец, вожделенный новый инструмент – белки, способные распознавать молекулы одорантов. Но как же они работают? Примерно как рецепторы, только ольфакторные? Понятное дело, что, будучи растворимыми белками, они должны либо содержаться в клеточной жидкости, либо плавать в межклеточном пространстве. Но вместо этого они делают нечто совершенно другое: передают сообщения из внешнего мира внутрь ольфакторного нейрона, а для этого нам нужны белки, прочно сидящие на клеточной мембране, так чтобы частично молекула была открыта в окружающую среду и могла получать из нее химические сигналы, а частично – внутрь нейрона, чтобы активировать его ферментные механизмы.
С другой стороны, растворимая природа этих связывающих белков и их расположение в непосредственной близости к мембране ольфакторного нейрона, где, как предполагалось, локализуются истинные ольфакторные рецепторы, сильно напоминали растворимые белки бактерий, «обитающие» в периплазматическом пространстве между их внутренней мембраной и внешней стенкой и способные связывать сахара и аминокислоты. Эти бактериальные белки классифицируются как рецепторы – своеобразный тип растворимых рецепторов. Возможно, наши ольфакторные белки могут выполнять примерно такие же функции?
Как бы они на самом деле ни назывались, это были единственные белки, способные взаимодействовать с пахучими веществами. Кое-кто из ученых пришел к выводу, что на изучение этих новых действующих лиц обонятельной сцены вполне стоит потратить время и ресурсы.
Надежность опубликованных результатов объяснялась еще и тем, что две разные группы, наша и снайдеровская, независимо и безо всякого обмена информацией пришли к одним и тем же заключениям. Лучший аргумент в пользу нового открытия – это повтор результатов другими учеными. Биохимия обоняния впервые получила такие надежные и воспроизводимые данные. И вдобавок примерно в то же время появилось сообщение об открытии еще одного ольфакторного белка – на сей раз у насекомых, – что дополнительно укрепило репутацию наших экспериментов и подогрело интерес к ним.
Ричард Вот и Лин Риддифорд обнаружили в антеннах гигантского мотылька Antheraea polyphemus растворимый белок, способный связывать половой феромон представителей этого вида и получивший в итоге название ФСБ (феромоно-связывающего белка) [3]. Этот белок, будучи иным по структуре, обладал всеми характеристиками насекомого эквивалента нашего млекопитающего ОСБ и, весьма вероятно, мог выполнять похожие функции… каковы бы они ни были.
Чтобы расширить знания об этих белках, мы начали изолировать ОСБ других видов животных и оценивать их сродство с рядом сильнопахнущих веществ. У всей этой истории с самого начала было одно слабое место: тот факт, что все ольфакторные данные собирались, очевидно, у людей, а биохимия при этом изучалась на других млекопитающих. Хотя мы могли с известной уверенностью предположить, что у всего этого класса обонятельные системы устроены похожим образом, было бы очень недурно все-таки изучить свойства ОСБ у человека.
Несколько групп параллельно заинтересовались поисками человеческого ОСБ, но все их попытки потерпели крах. После расшифровки последовательности генома человеческий ОСБ был наконец обнаружен – сначала как ген, а затем и как белок, производимый организмом лишь в крайне малых количествах. Этим человек отличается от коров и свиней, из чьих назальных тканей его можно без труда выделить в огромных объемах – вплоть до нескольких миллиграммов с одного животного.
Второй шаг: последовательность аминокислот
Как только коровий ОСБ был изолирован, мы тут же вплотную занялись его структурой. Прежде всего нужно было определить последовательность его аминокислот. Это маленький белок, с какими-нибудь 150 аминокислотами, но в те времена, когда молекулярно-биологический инструментарий еще не имел широкого лабораторного применения, задача эта была отнюдь не проста. У нас ушел почти полный год на секвенцирование коровьего ОСБ с применением традиционного биохимического метода. Этот белок и с ним свиной ОСБ были одними из последних, секвенцированных таким способом. Очень скоро методы молекулярной биологии, куда более быстрые и дешевые в применении, полностью вытеснили традиционную систему.
Думаю, мне все равно стоит описать здесь биохимический способ секвенцирования белка, совершенно громоздкий и устарелый по сравнению с современными процедурами. С практической точки зрения мы подвергали образец белка серии химических реакций, задача которых состояла в том, чтобы отщипывать от него по одной аминокислоте зараз. Реакция начиналась с аминотерминала (условно рассматриваемого как начало белковой цепочки); далее ее можно было успешно повторять с 20–30 аминокислотами – максимум с 40. Эта последовательность была изобретена Пером Эдманом в 1956 году и с тех пор оставалась неизменной. Представляете, какое блестящее это было открытие? В самом начале процедуру производили мануально – для этого требовались огромные количества изолированного белка; далее ее передали специализированным машинам, состоящим из комбинации насосов и клапанов, – они называются аминокислотными секвенаторами и вполне могут закончить дело за одну ночь.
Однако даже маленький белок в длину все равно превышает 20–30 аминокислот, которые можно секвенцировать напрямую. Получается, чтобы обработать всю цепочку, ее нужно поделить на отрезки специальными ферментами, которые перережут связи в точно определенных местах. Далее, чтобы правильно собрать все фрагменты, нам все равно нужно обработать еще один образец белка – уже другим ферментом, который порежет его в других точках. Эти фрагменты тоже нужно будет изолировать и секвенцировать. Зачем это нужно? Чтобы получить взаимоперекрывающиеся области и суметь потом восстановить всю цепочку белка – примерно как собрать пазл. Как вы уже поняли, процедура получается длинная и требует больших количеств сырья.
Сегодня с применением методов молекулярной биологии весь процесс занимает обычно пару дней. Для самого последнего способа достаточно секвенцировать короткий фрагмент длиной в шесть-десять аминокислот – лучше, если он будет первым в цепочке. Полученная информация позволит воссоздать и синтезировать олигонуклеотид – коротенький сегмент ДНК, содержащий базовую кодировку для данной конкретной последовательности аминокислот. Каждая аминокислота кодируется тройкой нуклеотидов; получается, что ген, кодирующий восемь аминокислот, будет длиной всего в 24 нуклеотида. Такое было нетрудно синтезировать даже на ранних стадиях данной технологии (сейчас мы запросто синтезируем целый ген для небольшого белка длиной в несколько сотен нуклеотидов). Дальше на этот олигонуклеотид ловится изучаемый белок, который затем усиливается. Для этого применяется техника, стремительно ставшая одним из самых популярных лабораторных приемов в области молекулярной биологии. Она называется ПЦР (полимеразной цепной реакцией) и была изобретена Кэри Бэнксом Маллисом в 1983 году – за это выдающееся достижение он десять лет спустя получил Нобелевскую премию по химии.
Идея репликации ДНК (то есть умножения ее объема), безусловно, не нова. Самое интересное свойство ДНК – как раз ее способность создавать собственные копии. Именно благодаря этой реакции существует биологическая жизнь на Земле; именно благодаря ей наследственные характеристики передаются следующим поколениям вида, как предположили еще Уотсон и Крик в своей основополагающей статье в журнале Nature, где описывалась структура ДНК. Это ее свойство основано на комплиментарности четырех нуклеотидов: аденина (A), гуанина (G), цитозина (C) и тимина (T), вместе составляющих молекулу ДНК. Они могут устанавливать относительно прочные и специфичные взаимодействия с использованием водородных связей, где атом водорода, соединенный с кислородом или азотом, может работать мостиком между двумя этими элементами. Интересно, что водородные связи достаточно устойчивы для специфических взаимодействий, но при этом достаточно слабы, чтобы легко рваться, сохраняя структуру молекулы, которая удерживается куда более прочными ковалентными связями – они остаются неуязвимыми.
В процессе репликации отдельные нуклеотиды связываются с молекулой ДНК (которая работает шаблоном) при помощи специфических водородных связей (аденин – с тимином, а гуанин – с цитозином), а ферменты соединяют эти новые строительные элементы друг с другом, словно какая-нибудь швейная машина.
Когда образуется вторая цепочка ДНК, комплиментарная первой, два сегмента можно разделить простым нагреванием смеси. Дальше процесс можно начинать сначала. В процессе ПЦР это достигается сначала повышением температуры до 95 °C (чтобы разделить две цепочки ДНК), затем понижением ее примерно до 50 °C для соединения со специфическими праймерами, затем новым повышением до 72 °C – это так называемая стадия удлинения, когда к растущей цепочке по одному прибавляются нуклеотиды согласно модели, комплиментарной шаблону. Обычно протокол ПЦР включает 30–35 таких циклов. На каждом цикле количество молекул ДНК удваивается. Нетрудно подсчитать, что к концу реакции одна молекула может дать (по крайней мере, в теории) до миллиарда идентичных цепочек ДНК.
У реакции есть слабое место – высокая температура, необходимая для разделения двух цепочек. Такие жесткие условия, да еще повторенные несколько раз, влияют на работоспособность ферментов, которые, будучи белками, легко денатурируются при нагревании. На самом деле ключевым элементом, превратившим полимеразную цепную реакцию в ценный практический инструмент, стала именно доступность ферментов (в данном случае полимераз), выдерживающих высокие температуры.
Возможность изолировать такие ферменты стала следствием еще одного, более масштабного биологического открытия – организмов, способных выживать в очень суровых условиях. Чаще всего это микроорганизмы, очень уместно именуемые экстремофилами, – они действительно живут в условиях, несовместимых с существованием других живых существ: например, в горячих источниках, где температуры бывают очень высоки. В тех из них, что расположены в глубинах океанов, были зафиксированы температуры вплоть до 120 °C. Другие микроорганизмы, напротив, предпочитают сильный холод или, скажем, высокие концентрации хлорида натрия (обычной поваренной соли) – их в свое время обнаружили в бассейнах для выпаривания соли. Как ни удивительно, некоторые формы жизни действительно хотят жить в таких экстремальных условиях и гибнут, если перенести их в нормальную среду.
Открытие ПЦР стало краеугольным камнем науки и могущественным исследовательским инструментом, позволившим производить анализ микроскопических образцов ДНК, которые до тех пор никак не давались ученым и понижали порог детекции в миллионы или даже миллиарды раз.
Влияние ПЦР на общий научный прогресс можно сравнить с микроскопом или телескопом, которые колоссально расширили наше поле экспериментального наблюдения. Эта техника позволила наконец сделать предметом анализа ничтожно малые образцы тканей и благодаря такой беспрецедентной чувствительности нашла себе применение, например, в судебно-медицинской экспертизе, где отпечатка пальца или одного волоска теперь достаточно, чтобы выяснить личность человека.
После амплификации гена его можно секвенцировать гораздо быстрее и легче, чем белок: для этого достаточно нескольких часов в противовес нескольким месяцам. Последовательность гена теперь запросто показывает расположение аминокислот по всей длине белка. Методы молекулярной биологии сделали возможным секвенцирование большого числа ОСБ, даже когда количество изолированного из натурального источника белка слишком мало для традиционных биохимических методов, как это бывает, например, с насекомыми.
Третий шаг: трехмерная структура
Еще один превосходный инструмент, за который мы благодарны молекулярной биологии, – возможность синтезировать большие количества искомого белка, заражая бактерию или другой организм геном с его кодом и предоставляя ей производить его самостоятельно. Доступность ОСБ в масштабе миллиграммов дала ученым шанс изготовить кристаллы, чья трехмерная структура нашла применение в рентгеновской дифракционной спектрометрии.
Из-за стремительного развития этих техник в нашем распоряжении теперь есть масса информации о структуре ОСБ, об устройстве лигандо-связывающей полости и способе ее взаимодействия с пахучими веществами и феромонами. Сейчас нам известны без преувеличения тысячи секвенций ОСБ, принадлежащих и насекомым, и позвоночным, а для некоторых из них уже открыты и трехмерные структуры. Более того, вся эта информация и сильно шагнувшие вперед биоинформатические средства привели к возможности моделировать новый белок просто по его последовательности аминокислот – при условии, конечно, что он достаточно похож на других членов того же семейства с уже известной структурой. Структура белка действительно имеет фундаментальное значение, так как напрямую связана с его физиологической функцией. Часто первое представление о роли белка в организме мы получаем именно по его трехмерной укладке.
На этом этапе нам, видимо, придется на время забыть об истории запахов и ольфакторных белков и углубиться на некоторое время в их структурные элементы и то, как они связаны с биологическими функциями.
Форма белков
Новорожденный белок, только что синтезированный клеточной машинерией, выглядит как длинная цепочка аминокислот, соединенных между собой ковалентными связями между карбоксильной группой каждого юнита и аминогруппой следующего за ним, – примерно как люди, которые стоят длинной шеренгой и держатся за руки. У каждой аминокислоты, помимо аминогруппы и кислотной группы, есть боковая цепочка. Она может быть очень простой – один атом водорода или короткая углеводородная цепочка, – а может содержать другие функциональные группы, в том числе вторую аминовую или вторую карбоксильную. В природе существует 20 аминокислот, из которых строится все разнообразие белков, и большинство их есть в каждом белке. Белки отличаются друг от друга в том числе и относительным объемом аминокислот, но прежде всего – расположением звеньев в цепи, и последовательность эта совершенно уникальна для каждого белка. Она закодирована в ДНК и определяет трехмерную структуру белка, которая в свою очередь отвечает за его физиологические функции.
После синтеза цепочка сворачивается или складывается неким неповторимым образом, хотя на первый взгляд белок может показаться просто случайным образом запутанной веревочкой. Взаимодействия между функциональными группами складывают белок сначала по маленьким доменам, а затем все это организуется в окончательную трехмерную структуру. Самые распространенные домены – спирали и складчатые листы. Эти структурные элементы соединяются между собой более короткими и гибкими сегментами, а потом собираются в финальную форму белка. Домены сами по себе сравнительно малы и состоят обычно из 10–20 аминокислот.
Водородные связи играют важнейшую роль в стабилизации и спиралей, и складчатых листов, а также участвуют в соединении доменов друг с другом. Имеют значение также и другие связи – более сильные, между противоположными зарядами, и более слабые, гидрофобные. Поскольку белки обычно находятся в водной среде, самые лучшие структуры аминокислотных цепочек – те, в которых гидрофобные остатки спрятаны внутри молекулы, а заряженные или гидрофильные находятся на поверхности.
Разрешение структуры белка
Определение трехмерной структуры белка – непростая задача даже сегодня, а для некоторых классов белков прямо-таки откровенно сложная. Ни в какой, даже самый мощный, микроскоп невозможно разглядеть форму молекулы белка. Первое, и самое главное ограничение, с которым приходится иметь дело, – длина волны света, с которым мы работаем. Видимый свет охватывает длину волн приблизительно от 400 до 800 нм (где нм – нанометр, одна миллионная миллиметра). Любой объект размером меньше 200 нанометров будет выглядеть размыто, и идентифицировать его никак не получится.
Типичный белок от маленького до среднего размера можно себе представить как шарик диаметром примерно 3 нм – это в сто раз меньше лимита, устанавливаемого светом. При помощи направленного пучка электронов можно продвинуться значительно дальше; электронные микроскопы уже подарили нам изображения крупных сегментов ДНК и даже отдельных белков, которые, правда, все равно выглядят как размытые точки. Разглядеть расположение атомов в них нет никакой возможности – для этого нужно еще более высокое разрешение. Один атом, условно упрощенный до шарика, имел бы диаметр 0,1–0,2 нм: именно такое разрешение понадобилось бы, чтобы разглядеть внутреннюю структуру белка. Но, вместо того чтобы наблюдать атомы напрямую, мы можем вычислить их позиции по дифракционной картине, которую дают рентгеновские лучи, взаимодействуя с кристаллом белка. Объяснить этот метод не так-то легко, да и на практике он не слишком прямолинеен.
Прежде всего нужно вырастить кристалл белка – эта задача подразумевает много попыток, ни одна из которых не гарантирует успеха. Далее: от кристалла нужно получить хорошую дифракционную картину, а затем еще и интерпретировать полученные данные в свете пространственной системы координат.
Разумеется, при этом приходится надеяться, что структура кристаллического белка повторяет его естественную укладку, когда он свободно плавает в растворе.
Это допущение кажется натянутым и не слишком реалистичным, но на самом деле оно совершенно разумно и может быть принято достаточно уверенно. Дело в том, что кристаллы белков сильно отличаются от тех, с которыми мы сталкиваемся в повседневной жизни – кварца, сахара или поваренной соли. Когда молекулы белка организуются в упорядоченную матрицу из строчек и столбиков, они берут с собой много воды и сохраняют таким образом прежнее окружение, которое было в растворе. Кристалл белка, в отличие от твердого кристалла сахара или кварца, очень хрупок и разбивается нередко даже при очень осторожном обращении.
Все утонченные технологии, помогающие завершить структуру белка, нас сейчас не интересуют, поэтому давайте сосредоточимся на результате процесса и на том, как он отражается на функциях белков.
Поскольку получить трехмерную структуру белка очень сложно, имеет смысл спросить, нельзя ли что-то извлечь из последовательности аминокислот. Окончательная форма белка, как мы уже говорили, во многом закодирована в его последовательности; в большинстве случаев белок складывается в растворе так, как сложился бы в самой стабильной ситуации, спонтанно и в подходящей среде (pH, соли, лиганды и т. д.). Поэтому хотя бы в теории должна быть возможность рассчитать складывание белка, опираясь на его секвенцию. Но это и правда очень трудная задача. Впрочем, учитывая, сколько всего мы сейчас знаем о структуре многих белков, принадлежащих к самым разным семействам, можно сделать проще – а именно предположить, что белки с похожими секвенциями могут быть похожи и структурно.
Поэтому, если в наличии есть данные о последовательности, их попросту скармливают компьютеру, который ищет похожие белки в огромной базе. Обнаружив что-то похожее, чьей структурой или физиологическими функциями наука уже когда-то интересовалась, мы можем пролить свет и на наш новый белок.
Структура первого ОСБ
Именно это мы и проделали с коровьим ОСБ, как только получили хотя бы частичную информацию о его аминокислотной последовательности. Нам сразу же стало ясно, что этот ОСБ относится к куда более обширному семейству белков, у которых общие не только последовательность и трехмерная структура, но даже и некоторые функции. Кое-какие из этих белков уже изучались, а у парочки ученые даже разрешили трехмерную структуру – например, у ретиноло-связывающего белка (переносчика ретинола в крови) и у β-лактоглобулина, одного из основных компонентов молока. Впоследствии их стали звать липокалинами – из-за способности связывать гидрофобные соединения (липиды и другие молекулы) и чашеобразной формы (calyx). На дне такой чашечки располагается зона, где локализуется лиганд (в случае ОСБ – одорант), – это водоотталкивающая область, где гидрофобному лиганду будет достаточно уютно, в отличие от внешней водной среды.
На следующем этапе нужно было добыть кристалл и разрешить подробную структуру коровьего ОСБ – первого члена семейства, который нам удалось изолировать. На это ушло несколько лет. Проблема заключалась не в кристаллизации белка, который как раз поддавался очень хорошо, производя довольно крупные кристаллы сравнительно малыми усилиями, а в интерпретации дифракционных данных. Белок относился к липокалинам и, по идее, должен был показать структуру, похожую на других его родственников, – но полученные данные этому решительно противоречили.
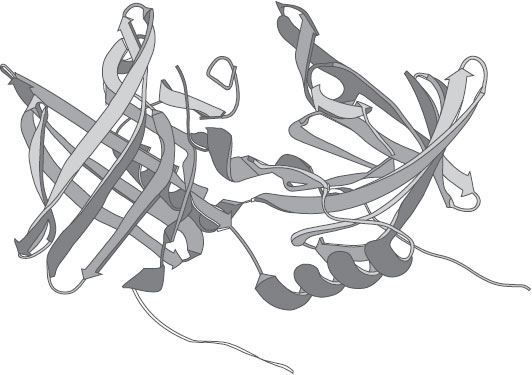
Рисунок 22. Трехмерная структура коровьего одоранто-связывающего белка. В отличие от большинства липокалинов, этот ОСБ демонстрирует довольно необычный феномен замены домена – когда спираль одного фрагмента взаимодействует с сердцевиной другого. Такие взаимные отношения двух суб-фрагментов обеспечивают димеру большую стабильность.
Вскоре нам стало ясно, что, хотя сердцевина коровьего ОСБ имеет пресловутую классическую форму чашечки (или, если угодно, корзинки), сам белок отличается от остальных представителей семейства. Это был димер с двумя плотно сцепленными фрагментами, демонстрирующими так называемый феномен замены домена. Это означает, что один домен (сегмент, в особенности спираль) одного суб-фрагмента взаимодействует с сердцевиной другого и наоборот. Похоже на руку, которая высовывается наружу и хочет взять другой белок (см. рис. 22). Это стабилизирует структуру белка и превращает димер в очень своеобразную компактную молекулу.
Разрешение структуры первого ОСБ, изолированного из коровьей назальной ткани, стало плодом усилий сразу двух групп: итальянской, под руководством Уго Монако (к которой принадлежал и я), и американской, которую возглавлял Марио Амцель, сотрудничавший с Соломоном Снайдером. Как видите, те же ученые, что в свое время соревновались, кто первым очистит ОСБ, сошлись вместе в одной статье, где структура в итоге и была опубликована. Иногда соревновательность стимулирует – особенно в самом начале исследовательского проекта; она помогает генерировать новые идеи и заставляет стремиться к завершению. Но на более поздних стадиях она может привести к напрасной трате фондов и сил и идет на пользу уже не науке, а только персональным амбициям. В подобных случаях всегда лучше превратить соревнование в сотрудничество – это сразу и эффективнее, и продуктивнее.
Новые соревнования
Но, пока мы сотрудничали с группами Снайдера и Амцеля, еще одна кристаллографическая лаборатория занялась идентичной структурой, любопытным образом повторяя все стадии нашего пути к изоляции коровьего ОСБ. В 1996 году один и тот же журнал (Nature Structural Biology) опубликовал две очень похожие статьи по структуре одного белка [4]. Марсельская группа под руководством Кристиана Камбилло и Мариэллы Тегони работала над тем же самым проектом, не имея никакого понятия о чужих результатах. В итоге наши данные по счастливой случайности получили еще одно независимое подтверждение. Вскоре после этого мы начали сотрудничать с Кристианом и Мариэллой и сотрудничаем до сих пор. Вдобавок мы стали очень хорошими друзьями.
Первым продуктом этого сотрудничества стала структура свиного ОСБ (см. рис. 23) – белка с мономерным устройством, больше похожего на другие липокалины. И снова мы видим типичную корзинку, окруженную связывающими карманами; в ней изображена молекула лиганда.
Почему эти два похожих белка имеют настолько разную пространственную форму? Дело в том, что у коровьего ОСБ нет цистеина, серосодержащей аминокислоты, способной образовывать ковалентную связь между этими двумя остатками. Такие дисульфидные связи играют важнейшую роль в стабилизации структуры белка, так как они соединяют две аминокислоты, часто отстоящие очень далеко друг от друга, и тем самым сжимают цепочку в более компактную конформацию. Свиной ОСБ стабилизируется дисульфидной связью, а коровий – собирая два фрагмента в единую структуру.
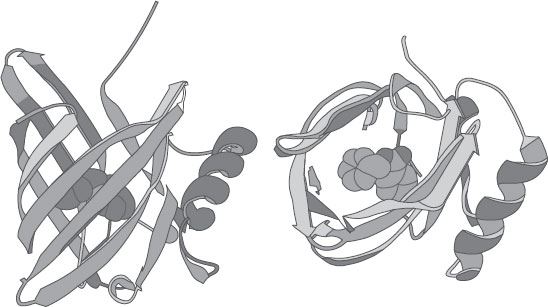
Рисунок 23. Два вида трехмерной структуры свиного ОСБ с молекулой бензил бензоата.
Здесь, видимо, самое время пояснить кое-что относительно наших диаграмм. Чтобы более понятно отобразить складывание белка, я взял рисунки, где показана только основная цепочка – в виде ленты.
Само собой, это грубейшее упрощение – на самом деле оно даже обманчиво. В действительности к этому скелету еще прилагаются боковые цепочки отдельных аминокислот с плотно упакованными атомами. Если вернуть их в изображение (для чего достаточно одного клика по компьютерной модели), мы получим невероятно компактную структуру, в которой между атомами вообще не останется места – за исключением внутренней связывающей полости.
Именно этой компактной структурой ОСБ и большинства других белков, принадлежащих к семейству липокалинов, и объясняется их высокая стабильность против любого разлагающего агента. Эти белки можно в буквальном смысле кипятить несколько минут – что безвозвратно денатурирует много других белков, – после чего, возвращенные в комнатную температуру, они полностью восстановят активность. Грубые органические растворители тоже не производят на них особого впечатления, и даже протеазы почти не в состоянии пробиться через такую компактную укладку.
Такая феноменальная устойчивость к деградации совершенно неудивительна у белков, находящихся в постоянном контакте с окружающей средой и со всеми потенциально вредными веществами, приносимыми в нос током воздуха. У этой компактной формы и стабильности есть два важных следствия. Во-первых, они очень полезны для биотехнологий, например для производства биосенсоров, чувствительных к запахам. А во-вторых, все ОСБ и многие липокалины являются потенциально сильными аллергенами. Будучи малы по размеру и устойчивы к деградации, они легко проникают в кровоток, вызывая иммунную реакцию организма.








