

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...
Топ:
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
1. Стереохимия реакции
В реакциях с участием оптически активных субстратов происходит 100% обращение конфигурации (инверсия), которая является следствием атаки «с тыла». Так называемое Вальденовское обращение:
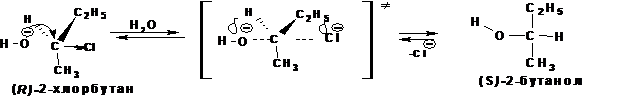
2. Влияние природы растворителя на реакции SN2.
Влияние растворителя на скорость реакции SN2 зависит от природы нуклеофильного реагента (ион или нейтральная молекула), чсто связано со степенью разделения зарядов в переходном состоянии.
3. Влияние природы нуклеофильного реагента.
Нуклеофильный реагент – нейтральная молекула.
Переходное состояние в этой реакции более полярно, чем исходные соединения. Поэтому увеличение полярности растворителя приведет к лучшей сольватации ПС. Эти реакции ускоряются полярными растворителями как протонными: уксусная кислота, спирты, так и апротонными – ацетон, ДМСО.
Нуклеофильный агент –анион.
ПС в этой реакции менее полярно, чем исходный нуклеофил. Применение протонных растворителей приводит к сольватации нуклеофила и снижению его реакционной способности. Поэтому более эффективны полярные апротонные растворители.
4. Влияние строения субстрата на реакции SN2.
Атаке с тыла будут препятствовать заместители у реакционного центра. Поэтому при переходе от метилгалогенидов к третичным алкилгалогенидам скорость реакции понижается.
Аллилгалогениды и бензилгалогениды в реакции SN2. более активны, чем первичные галогениды.
5. Влияние природы уходящей группы.
Скорость реакции SN2. тем выше, чем выше поляризуемость уходящей группы. Мерой поляризуемости является рефракция.
|
|
6. Влияние нуклеофила.
Активность нуклеофила определяется двумя факторами: - нуклеофильностью – способностью отдавать электроны и основностью – способностью присоединять протон. Как правило сильные нуклеофилы являются слабыми основаниями, а слабые нуклеофилы являются сильными основаниями. Благоприятствует протеканию реакции оптимальное сочетание основности и нуклеофильности, что в частности связано с природой растворителя.
Элиминирование
Третичные галогеналканы не способны к реакциям бимолекулярного нуклеофильного замещения. Однако если нуклеофильный реагент является сильным основанием, то под его воздействием протекает реакция отщепления (реакция элиминирования Е). Например при обработке трет -бутилбромида спиртовым раствором щелочи наблюдается реакция дегидробромирования:

Реакции отщепления, в которых уходящие группы – анион галогена и протон – отщепляются от соседних атомов углерода с образованием π-связи между ними, называются β-элиминированием:

Реакции β-элиминирования, приводящие к алкенам, являются наиболее важными реакциями отщепления. Аналогично реакциям нуклеофильного замещения реакции β-элиминирования протекают по двум механизмам; Е1 и Е2.
Механизм реакции Е1 включает две стадии.
На первой стадии, как и в реакциях SN1 происходит ионизация галогенопроизводного с образованием карбкатиона и бромид-иона. Эта стадия является скоростьлимитирующей и характеризуется наиболее высокой энергией активации:

На второй стадии происходит быстрое отщепление протона под действием основного реагента и образование π-связи:

Этой схеме механизма соответствует следующая энергетическая диаграмма:
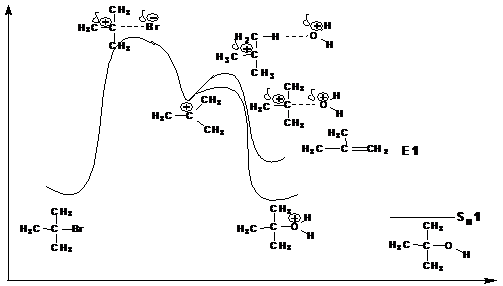
Особенности мономолекулярного нуклеофильногозамещения
1. Правило Зайцева.
Реакции Е1 соединений, имеющих несколько доступных элиминированию β-атомов водорода, обычно протекают по правилу Зайцева, т.е. с преимущественным образованием более устойчивого алкена.
|
|
2 Стереохимия реакции
Термодинамически более устойчивый транс - изомер образуется легче, чем цис-изомер.
3. Протонные растворители, обладающие высокой ионизирующей способностью ускоряют реакции Е1
4. Влияние температуры.
С повышением температуры доля продукта Е1 возрастает.
Бимолекулярное элиминирование также как и мономолекулярное конкурирует с замещением. Кинетика описывается уравнением второго порядка. Это значит, что в скоростьлимитирующей стадии участвуют молекула субстрата и основания. Реакция представляет собой одностадийный согласованный процесс β-элиминирования, протекающий через переходное состояние, в котором разрыв связей Сα-Х и Сβ-Р и образование π-связи происходят одновременно:
 Особенности мономолекулярного нуклеофильногозамещения
Особенности мономолекулярного нуклеофильногозамещения
1. Региоселективность реакции Е2
Реакции β-элиминирования галогеналканов, имеющих в молекуле две неэквивалентные С-Н связи, способные к разрыву, приводят к образованию смеси двух алкенов в соответствии с правилом Зайцева.
2. реакционная способность галогеналканов в реакциях Е2.
В реакциях Е2 скорость и выхода продуктов возрастают в ряду галогеналканов первичный вторичный третичный.
3. Влияние природы галогена
Реакционная способность возрастает в ряду от фтора к йоду.
4. Свойства нуклеофила.
Рост основности способствует протеканию по механизму Е2. Также протеканию реакции элиминирования способствует рост объема основания.
5. Влияние среды
В переходном состоянии Е2 заряд распределен между пятью атомами. В реакции замещения только по трем атомам. Следовательно, в реакции элиминирования большая степень локализации и соответственно меньшие величины зарядов на атомах. Поэтому при элиминировании целесообразно использовать растворители менее полярные, чем при замещении. Практически элиминировпние проводят в спиртовой среде, а замещение в водной.
6. Влияние температуры.
Рост температуры ведет к увеличению выхода продукта элиминирования.
Восстановление
При каталитическом гидрировании галогеналкилов или действия на них водородом в момент выделения происходит замещение атома галоида на водород:
|
|
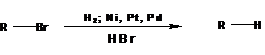
Под действием йодистоводородной кислоты восстанавливаются до алканов йодалкилы:

2. Галогенопроизводные со связью С(sp2)-Наl
Химические свойства
Галогенбензолы подвергаются нуклеофильному замещению только под действием очень сильных оснований, или в очень жестких условиях (температура, давление).
Реакции нуклеофильного замещения в галогенаренах протекают по двум механизмам:
По механизму «присоединение-отщепление» SNAr. Так протекает нуклеофильное замещение в активированных галогенаренах;
По механизму «отщепление-присоединение». (Ариновый механизм). Так протекает нуклеофильное замещение в неактивированных галогенаренах.
|
|
|

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!