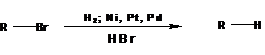ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Схема лекции.
1. Галогенопроизводные со связью С(sp3)-Наl
1.1. Классификация, номенклатура, изомерия.
1.2. Способы получения
1.3. Физические свойства
1.4. Химические свойства
1.4.1. Нуклеофильное замещение
1.4.2. Механизм SN1. Мономолекулярное замещение
1.4.3 Механизм SN2. Бимолекулярное замещение
1.4.4. Элиминирование
1.4.5. Восстановление
2. Галогенопроизводные со связью С(sp2)-Наl
2.1. Классификация, номенклатура, изомерия.
2.2. Способы получения
2.3. Физические свойства
2.4. Химические свойства
2.4.1. Реакции винилгалогенидов
2.4.2. Нуклеофильное замещение по типу «присоединение-отщепление»
2.4.3. Нуклеофильное замещение по типу «отщепление-присоединение»
3. Металлорганические соединения
Определение: Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены атомами галогенов – фтора, хлора, брома или йода называются галогенопроизводными.
1.1 Галогенопроизводные со связью С(sp3)-Наl
Моногалогенопроизводные предельных углеводородов носят название галогеналкилов. Их общая формула СnН2n+1-Наl.
В зависимости от типа атома углерода, связанного с галогеном, галогеналканы классифицируются как первичные RCH2- Наl, вторичные R2CH- Наl и третичные R3C- Наl.
В зависимости от числа атомов галогена в молекуле различают моно-, ди- и полигалогенопроизводные.
Номенклатура:
Тривиальные названия используются для следующих галогенопроизводных:
CH2Cl2 – хлористый метилен или метиленхлорид; CHCl3 – хлороформ; ССl4 – четыреххлористый углерод; CH2Cl- CH2Cl - дихлорэтан. Вещества широко используются в качестве растворителей. Хлорофом применяют для анестезии для усыпления пациентов.
Рациональные названия для простейших строятся по названию радикала: СH3Cl – хлористый метил; CH3- CH2Cl - хлористый этил. Хлористый метил и хлористый этил используют в промышленности в качестве алкилирующих агентов. Хлористый этил применяют для местной анестезии (замораживают спортсменам ушибы)
По систематической номенклатуре названия галогенопроизводных образуются из названий соответствующих им предельных углеводородов, добавляя название галогена и указывая положение в цепи. Старшинство растет с ростом атомной массы галогена. Галоген старше, чем углеводородный радикал:

Способы получения
1.2.1. Галогенирование алканов:
Галогенирование алканов – наиболее распространенный способ получения бром- и хлоралканов. При хлорировании получается смесь продуктов. При бромировании преимущественно образуется продукт, соответствующий наиболее стабильному радикалу:

1.2.2. Галогенирование и гидрогалогенирование алкенов и алкинов:
Гидрогалогенирование алкенов и алкинов подчиняются правилу Марковникова. При галогенировании образуются продукты анти-присоединения, имеющие вицинальное строение:

1.2.3. Замещение гидроксигруппы на галоген в спиртах:
Основной способ получения галогеналканов в лобораториях:
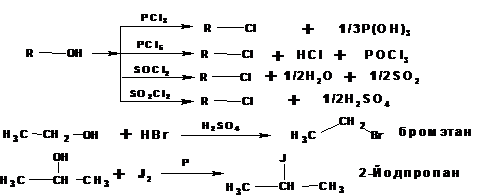
1.2.4. Получение гемдигалогенидов:
Геминальные дигалогеналканы получаются из карбонильных соединений действием пентагалогенидов фосфора:
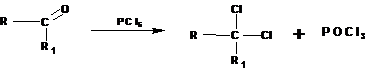
Физические свойства
Галогенметаны, за исключением йодметана, являются газами. Их низшие гомологи представляют собой бесцветные высоколетучие жидкости со сладковатым запахом.
Рост атомного номера галогена ведет к росту температуры кипения галогеналкана.
Рост температуры кипения наблюдается при увеличении числа атомов галогена в молекуле галогеналкана. Следует отметить, что фторпроизводные не подчиняются этим закономерностям. Так температура кипения дихлорметана (хлористый метилен, метиленхлорид) СН2Cl2 - 400С, а температура кипения дифтордихлорметана СF2Cl2 - -280С. Сойство фторметанов имет аномальные температуры кипения – явилось причиной применения фторметанов в качестве фреонов – холодильных жидкостей.
| Элемент
| Фтор
| Хлор
| Бром
| Йод
| Углерод (sp3)
|
| Электроотрицательность
| 4.0
| 3.0
| 2.8
| 2.5
| 2.5
|
Как видно из таблицы атомы галогенов, кроме йода имеют электроотрицательность более высокую, чем у атома углерода в состоянии sp3-гибридизации.
| Элемент
| Энергия, кДж/моль
| Длина, нм
| Дипольный момент, D
| Рефракция, см3
| Потенциал ионизации, эВ.
|
| Фтор
| 447.7
| 0.141
| 1.81
| 1.44
| -
|
| Хлор
| 278.2
| 0.176
| 1.83
| 6.51
| 11.29
|
| Бром
| 225.9
| 0.191
| 1.79
| 9.38
| 10.53
|
| Йод
| 194.5
| 0.210
| 1.60
| 14.61
| 9.5
|
Соответственно ковалентные связи Сsp3-Наl полярны (С sp3 – J в наименьшей степени.). Характеристики связей приведены в таблице.
Дипольный момент(μ) = величина электрического заряда (q) × расстояние между зарядами(r). В системе СИ размерность дипольного момента – дебай (D)
Данные таблицы показывают, что галогены обладают отрицательным индуктивным эффектом, а в молекулах галогеналканов электронная пара связи Сsp3-Наl смещена в сторону атома галоида:
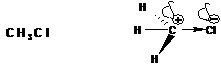
Кроме того, данные таблицы показывают, что снижение полярности связи сопряжено со снижением энергии связи и ростом ее поляризуемости.
Все эти особенности связи Сsp3-Наl свидетельствуют в пользу предположения о том, что связь Сsp3-Наl должна подвергаться гетеролитическому разрыву. Причем в ряду от фтора к йоду разрыв должен происходить с убывающими затратами энергии т.е. все легче. В результате разрыва отрицательным зарядом будет обладать атом галоида, а на атоме углерода возникнет положительный заряд, т.е. образуется карбкатион:

Образующийся карбкатион, частица, несущая положительный заряд, будет взаимодействовать с частицами, несущими отрицательный заряд. Таковыми являются нуклеофилы. Соответственно для галогенопроизводных со связью С(sp3)-Наl характерны реакции нуклеофильного замещения (SN) и элиминирования (Е).
Химические свойства
Нуклеофильное замещение
При нуклеофильном замещении нуклеофил атакует молекулу субстрата, предоставляя ей для образования новой связи свои электроны. Электроны разрывающейся связи уходят вместе с освобождающимся ионом. Такие ионные реакции идут преимущественно в жидкой фазе, поскольку растворитель стабилизирует образующиеся ионы за счет сольватации, что невозможно в газовой фазе.
Нуклеофильное замещение позволяет вводить в молекулу органического соединения большое количество функциональных групп, способных выступать в роли нуклеофилов. Например:
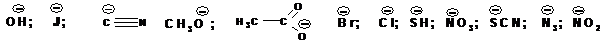
В роли нуклеофилов могут выступать и нейтральные молекулы, например:
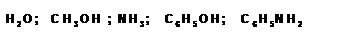
Примеры реакций с участием бромистого этила, в качестве субстрата, приведены ниже:

Особенностью реакций нуклеофильного замещения является то, что они одни из самых распространенных в органической химии, а соответственно одни из самых изученных. В частности изучение кинетики реакции нуклеофильного замещения. Химическая кинетика - это изучение изменения концентрации реагентов или продуктов во времени. Изменение характеризуется производной концентрации по времени dc/dt. Устанавливают взаимосвязь производной с концентрациями реагентов или, при необходимости, с концентрациями продуктов.
Изучение изменения концентрации реагентов во времени в условиях реакции нуклеофильного замещения показало, что возможны два случая:
В первом случае изменение концентрации пропорционально только концентрации субстрата dc/dt = К[ галоидный алкил]
Во втором случае изменение концентрации пропорционально концентрации субстрата и концентрации нуклеофильной частицы –
dc/dt = К[ галоидный алкил]×[ нуклеофил]
Механизм, соответствующий первому случаю назван мономолекулярным нуклеофильным замещением и обозначается SN1.
Механизм, соответствующий второму случаю назван бимолекулярным нуклеофильным замещением и обозначается SN2
1.4.2. Механизм SN1. Мономолекулярное замещение
По механизму SN1, например протекает гидролиз трет -бутилбромида:
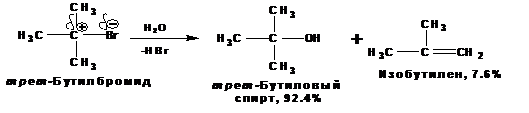
В механизме SN1 различают следующие стадии:
На первой стадии происходит ионизация галогенопроизводного с образованием карбкатиона и бромид-иона. Эта стадия является скоростьлимитирующей и характеризуется наиболее высокой энергией активации:

Бромид-ион образует с молекулами воды водородные связи и тем самым стабилизируется. Образующийся карбкатион также стабилизируется сольватацией растворителем. Но большее значение имеет стабильность самого карбкатиона. Он должен быть стабилизирован внутримолекулярными электронными эффектами, т.н. быть третичным или находиться в сопряжении с π-электронной системой (быть резонансно-стабилизированным).
На второй стадии происходит быстрое взаимодействие карбкатиона с нуклеофилом, в частности с водой:
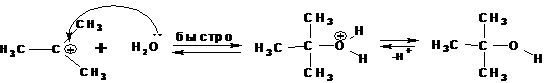
Быстрое присоединение молекулы воды к карбкатиону приводит к катиону трет- бутилгидроксония, кторый затем отщепляет протон с образованием трет- бутилового спирта. Этой схеме механизма соответствует следующая энергетическая диаграмма:
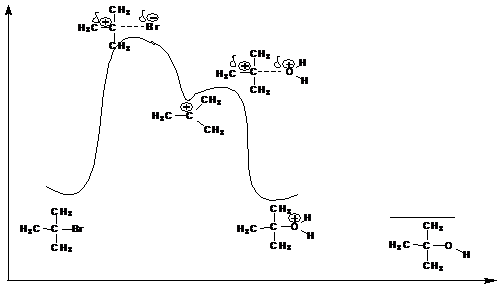
Особенности мономолекулярного нуклеофильногозамещения
1. Стереохимия реакции
Реакции SN1 с участием оптически активных галогенпроизводных как правило сопровождаются исчезновением оптической активности. Причиной служит равновероятная возможность атаки нуклеофилом с обоих сторон плоскости карбокатиона, (имеет плоское строение):

В результате возможности атаки карбкатиона с обоих сторон образуется смесь двух оптически активных изомеров, которая называется рацемической смесью. Сами компоненты рацемической смеси называются энантиомерами, а явление носит название рацемизацция.
2. Влияние строения субстрата в реакциях SN1.
В реакциях SN1 скоростьлимитирующей стадией является образование карбкатиона. Поэтому активность галогенопроизводных возрастает в том же порядке, что и устойчивость образующихся карбкатионов. Метилгалогениды и первичные галогеналканы по механизму SN1 практически не реагируют из-за неустойчивости первичных карбкатионов. Вторичные галогеналканы реагируют очень медленно. Только третичные галогеналканы вступают в реакции SN1 с достаточно высокой скоростью, что позволяет использовать реакцию практически.
Замена атомов водорода в метилгалогенидах на винильные и фенильные группы еще более резко повышает скорость реакции SN1, поскольку на медленной стадии образуются карбкатионы, стабилизированные резонансом.
3. Влияние природы растворителя на реакции SN1.
Реакции SN1 протекают, преимущественно в полярных протонных растворителях с высокой ионизирующей способностью. Вода обладает наибольшей ионизирующей способностью и обеспечивает максимальную скорость гидролиза и сольволиза. Однако многие галогенопроизводные не растворяются в воде. Поэтому в реакциях SN1 чаще всего в какчестве растворителя применяют муравьиную и уксусную кислоты, метиловый и этиловый спирт или их водные растворы.
1.4.3 Механизм SN2. Бимолекулярное замещение
Реакции нуклеофильного замещения протекают по бимолекулярному механизму придействии на субстраты сильных нуклеофильных реагентов. Например щелочной гидролиз метилбромида:

В этой реакции гидроксид-ион (вступающая группа, нуклеофил) замещает анион брома (уходящая группа или нуклеофуг) в молекуле метилбромида (субстрат).
Скорость реакции бимолекулярного замещения пропорциональна концентрациям субстрата и нуклеофила. Следовательно, в скоростьлимитирующей стадии гидролиза метилбромида участвуют две частицы: метилбромид и гидроксид-ион:

Гидроксид-ион атакует атом углерода, имеющий частичный положительный заряд, со стороны, противоположной атому брома, т.е. «с тыла». Образование связи С-О и разрыв связи С-Br происходят одновременно. Это означает, что реакция протекает как синхронный процесс. Синхронному процессу соответствует следующая энергетическая диаграмма:

Элиминирование
Третичные галогеналканы не способны к реакциям бимолекулярного нуклеофильного замещения. Однако если нуклеофильный реагент является сильным основанием, то под его воздействием протекает реакция отщепления (реакция элиминирования Е). Например при обработке трет -бутилбромида спиртовым раствором щелочи наблюдается реакция дегидробромирования:

Реакции отщепления, в которых уходящие группы – анион галогена и протон – отщепляются от соседних атомов углерода с образованием π-связи между ними, называются β-элиминированием:

Реакции β-элиминирования, приводящие к алкенам, являются наиболее важными реакциями отщепления. Аналогично реакциям нуклеофильного замещения реакции β-элиминирования протекают по двум механизмам; Е1 и Е2.
Механизм реакции Е1 включает две стадии.
На первой стадии, как и в реакциях SN1 происходит ионизация галогенопроизводного с образованием карбкатиона и бромид-иона. Эта стадия является скоростьлимитирующей и характеризуется наиболее высокой энергией активации:

На второй стадии происходит быстрое отщепление протона под действием основного реагента и образование π-связи:

Этой схеме механизма соответствует следующая энергетическая диаграмма:
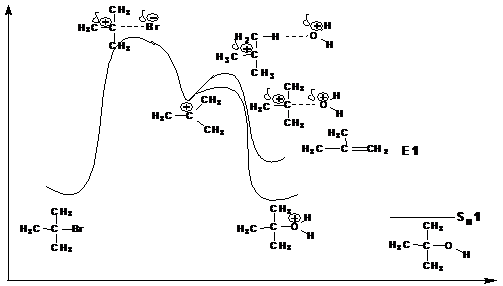
Особенности мономолекулярного нуклеофильногозамещения
1. Правило Зайцева.
Реакции Е1 соединений, имеющих несколько доступных элиминированию β-атомов водорода, обычно протекают по правилу Зайцева, т.е. с преимущественным образованием более устойчивого алкена.
2 Стереохимия реакции
Термодинамически более устойчивый транс - изомер образуется легче, чем цис-изомер.
3. Протонные растворители, обладающие высокой ионизирующей способностью ускоряют реакции Е1
4. Влияние температуры.
С повышением температуры доля продукта Е1 возрастает.
Бимолекулярное элиминирование также как и мономолекулярное конкурирует с замещением. Кинетика описывается уравнением второго порядка. Это значит, что в скоростьлимитирующей стадии участвуют молекула субстрата и основания. Реакция представляет собой одностадийный согласованный процесс β-элиминирования, протекающий через переходное состояние, в котором разрыв связей Сα-Х и Сβ-Р и образование π-связи происходят одновременно:
 Особенности мономолекулярного нуклеофильногозамещения
Особенности мономолекулярного нуклеофильногозамещения
1. Региоселективность реакции Е2
Реакции β-элиминирования галогеналканов, имеющих в молекуле две неэквивалентные С-Н связи, способные к разрыву, приводят к образованию смеси двух алкенов в соответствии с правилом Зайцева.
2. реакционная способность галогеналканов в реакциях Е2.
В реакциях Е2 скорость и выхода продуктов возрастают в ряду галогеналканов первичный вторичный третичный.
3. Влияние природы галогена
Реакционная способность возрастает в ряду от фтора к йоду.
4. Свойства нуклеофила.
Рост основности способствует протеканию по механизму Е2. Также протеканию реакции элиминирования способствует рост объема основания.
5. Влияние среды
В переходном состоянии Е2 заряд распределен между пятью атомами. В реакции замещения только по трем атомам. Следовательно, в реакции элиминирования большая степень локализации и соответственно меньшие величины зарядов на атомах. Поэтому при элиминировании целесообразно использовать растворители менее полярные, чем при замещении. Практически элиминировпние проводят в спиртовой среде, а замещение в водной.
6. Влияние температуры.
Рост температуры ведет к увеличению выхода продукта элиминирования.
Восстановление
При каталитическом гидрировании галогеналкилов или действия на них водородом в момент выделения происходит замещение атома галоида на водород:
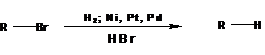
Под действием йодистоводородной кислоты восстанавливаются до алканов йодалкилы:

2. Галогенопроизводные со связью С(sp2)-Наl
Химические свойства
Галогенбензолы подвергаются нуклеофильному замещению только под действием очень сильных оснований, или в очень жестких условиях (температура, давление).
Реакции нуклеофильного замещения в галогенаренах протекают по двум механизмам:
По механизму «присоединение-отщепление» SNAr. Так протекает нуклеофильное замещение в активированных галогенаренах;
По механизму «отщепление-присоединение». (Ариновый механизм). Так протекает нуклеофильное замещение в неактивированных галогенаренах.
ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Схема лекции.
1. Галогенопроизводные со связью С(sp3)-Наl
1.1. Классификация, номенклатура, изомерия.
1.2. Способы получения
1.3. Физические свойства
1.4. Химические свойства
1.4.1. Нуклеофильное замещение
1.4.2. Механизм SN1. Мономолекулярное замещение
1.4.3 Механизм SN2. Бимолекулярное замещение
1.4.4. Элиминирование
1.4.5. Восстановление
2. Галогенопроизводные со связью С(sp2)-Наl
2.1. Классификация, номенклатура, изомерия.
2.2. Способы получения
2.3. Физические свойства
2.4. Химические свойства
2.4.1. Реакции винилгалогенидов
2.4.2. Нуклеофильное замещение по типу «присоединение-отщепление»
2.4.3. Нуклеофильное замещение по типу «отщепление-присоединение»
3. Металлорганические соединения
Определение: Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены атомами галогенов – фтора, хлора, брома или йода называются галогенопроизводными.
1.1 Галогенопроизводные со связью С(sp3)-Наl
Моногалогенопроизводные предельных углеводородов носят название галогеналкилов. Их общая формула СnН2n+1-Наl.
В зависимости от типа атома углерода, связанного с галогеном, галогеналканы классифицируются как первичные RCH2- Наl, вторичные R2CH- Наl и третичные R3C- Наl.
В зависимости от числа атомов галогена в молекуле различают моно-, ди- и полигалогенопроизводные.
Номенклатура:
Тривиальные названия используются для следующих галогенопроизводных:
CH2Cl2 – хлористый метилен или метиленхлорид; CHCl3 – хлороформ; ССl4 – четыреххлористый углерод; CH2Cl- CH2Cl - дихлорэтан. Вещества широко используются в качестве растворителей. Хлорофом применяют для анестезии для усыпления пациентов.
Рациональные названия для простейших строятся по названию радикала: СH3Cl – хлористый метил; CH3- CH2Cl - хлористый этил. Хлористый метил и хлористый этил используют в промышленности в качестве алкилирующих агентов. Хлористый этил применяют для местной анестезии (замораживают спортсменам ушибы)
По систематической номенклатуре названия галогенопроизводных образуются из названий соответствующих им предельных углеводородов, добавляя название галогена и указывая положение в цепи. Старшинство растет с ростом атомной массы галогена. Галоген старше, чем углеводородный радикал:

Способы получения
1.2.1. Галогенирование алканов:
Галогенирование алканов – наиболее распространенный способ получения бром- и хлоралканов. При хлорировании получается смесь продуктов. При бромировании преимущественно образуется продукт, соответствующий наиболее стабильному радикалу:

1.2.2. Галогенирование и гидрогалогенирование алкенов и алкинов:
Гидрогалогенирование алкенов и алкинов подчиняются правилу Марковникова. При галогенировании образуются продукты анти-присоединения, имеющие вицинальное строение:

1.2.3. Замещение гидроксигруппы на галоген в спиртах:
Основной способ получения галогеналканов в лобораториях:
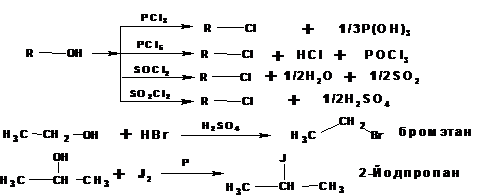
1.2.4. Получение гемдигалогенидов:
Геминальные дигалогеналканы получаются из карбонильных соединений действием пентагалогенидов фосфора:
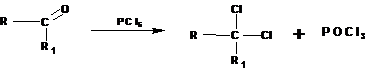
Физические свойства
Галогенметаны, за исключением йодметана, являются газами. Их низшие гомологи представляют собой бесцветные высоколетучие жидкости со сладковатым запахом.
Рост атомного номера галогена ведет к росту температуры кипения галогеналкана.
Рост температуры кипения наблюдается при увеличении числа атомов галогена в молекуле галогеналкана. Следует отметить, что фторпроизводные не подчиняются этим закономерностям. Так температура кипения дихлорметана (хлористый метилен, метиленхлорид) СН2Cl2 - 400С, а температура кипения дифтордихлорметана СF2Cl2 - -280С. Сойство фторметанов имет аномальные температуры кипения – явилось причиной применения фторметанов в качестве фреонов – холодильных жидкостей.
| Элемент
| Фтор
| Хлор
| Бром
| Йод
| Углерод (sp3)
|
| Электроотрицательность
| 4.0
| 3.0
| 2.8
| 2.5
| 2.5
|
Как видно из таблицы атомы галогенов, кроме йода имеют электроотрицательность более высокую, чем у атома углерода в состоянии sp3-гибридизации.
| Элемент
| Энергия, кДж/моль
| Длина, нм
| Дипольный момент, D
| Рефракция, см3
| Потенциал ионизации, эВ.
|
| Фтор
| 447.7
| 0.141
| 1.81
| 1.44
| -
|
| Хлор
| 278.2
| 0.176
| 1.83
| 6.51
| 11.29
|
| Бром
| 225.9
| 0.191
| 1.79
| 9.38
| 10.53
|
| Йод
| 194.5
| 0.210
| 1.60
| 14.61
| 9.5
|
Соответственно ковалентные связи Сsp3-Наl полярны (С sp3 – J в наименьшей степени.). Характеристики связей приведены в таблице.
Дипольный момент(μ) = величина электрического заряда (q) × расстояние между зарядами(r). В системе СИ размерность дипольного момента – дебай (D)
Данные таблицы показывают, что галогены обладают отрицательным индуктивным эффектом, а в молекулах галогеналканов электронная пара связи Сsp3-Наl смещена в сторону атома галоида:
Кроме того, данные таблицы показывают, что снижение полярности связи сопряжено со снижением энергии связи и ростом ее поляризуемости.
Все эти особенности связи Сsp3-Наl свидетельствуют в пользу предположения о том, что связь Сsp3-Наl должна подвергаться гетеролитическому разрыву. Причем в ряду от фтора к йоду разрыв должен происходить с убывающими затратами энергии т.е. все легче. В результате разрыва отрицательным зарядом будет обладать атом галоида, а на атоме углерода возникнет положительный заряд, т.е. образуется карбкатион:

Образующийся карбкатион, частица, несущая положительный заряд, будет взаимодействовать с частицами, несущими отрицательный заряд. Таковыми являются нуклеофилы. Соответственно для галогенопроизводных со связью С(sp3)-Наl характерны реакции нуклеофильного замещения (SN) и элиминирования (Е).
Химические свойства
Нуклеофильное замещение
При нуклеофильном замещении нуклеофил атакует молекулу субстрата, предоставляя ей для образования новой связи свои электроны. Электроны разрывающейся связи уходят вместе с освобождающимся ионом. Такие ионные реакции идут преимущественно в жидкой фазе, поскольку растворитель стабилизирует образующиеся ионы за счет сольватации, что невозможно в газовой фазе.
Нуклеофильное замещение позволяет вводить в молекулу органического соединения большое количество функциональных групп, способных выступать в роли нуклеофилов. Например:
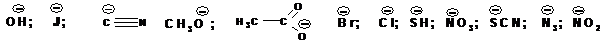
В роли нуклеофилов могут выступать и нейтральные молекулы, например:
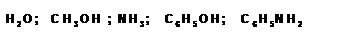
Примеры реакций с участием бромистого этила, в качестве субстрата, приведены ниже:

Особенностью реакций нуклеофильного замещения является то, что они одни из самых распространенных в органической химии, а соответственно одни из самых изученных. В частности изучение кинетики реакции нуклеофильного замещения. Химическая кинетика - это изучение изменения концентрации реагентов или продуктов во времени. Изменение характеризуется производной концентрации по времени dc/dt. Устанавливают взаимосвязь производной с концентрациями реагентов или, при необходимости, с концентрациями продуктов.
Изучение изменения концентрации реагентов во времени в условиях реакции нуклеофильного замещения показало, что возможны два случая:
В первом случае изменение концентрации пропорционально только концентрации субстрата dc/dt = К[ галоидный алкил]
Во втором случае изменение концентрации пропорционально концентрации субстрата и концентрации нуклеофильной частицы –
dc/dt = К[ галоидный алкил]×[ нуклеофил]
Механизм, соответствующий первому случаю назван мономолекулярным нуклеофильным замещением и обозначается SN1.
Механизм, соответствующий второму случаю назван бимолекулярным нуклеофильным замещением и обозначается SN2
1.4.2. Механизм SN1. Мономолекулярное замещение
По механизму SN1, например протекает гидролиз трет -бутилбромида:

В механизме SN1 различают следующие стадии:
На первой стадии происходит ионизация галогенопроизводного с образованием карбкатиона и бромид-иона. Эта стадия является скоростьлимитирующей и характеризуется наиболее высокой энергией активации:

Бромид-ион образует с молекулами воды водородные связи и тем самым стабилизируется. Образующийся карбкатион также стабилизируется сольватацией растворителем. Но большее значение имеет стабильность самого карбкатиона. Он должен быть стабилизирован внутримолекулярными электронными эффектами, т.н. быть третичным или находиться в сопряжении с π-электронной системой (быть резонансно-стабилизированным).
На второй стадии происходит быстрое взаимодействие карбкатиона с нуклеофилом, в частности с водой:
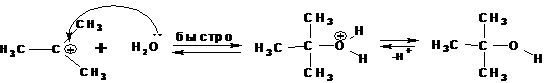
Быстрое присоединение молекулы воды к карбкатиону приводит к катиону трет- бутилгидроксония, кторый затем отщепляет протон с образованием трет- бутилового спирта. Этой схеме механизма соответствует следующая энергетическая диаграмма:

Особенности мономолекулярного нуклеофильногозамещения
1. Стереохимия реакции
Реакции SN1 с участием оптически активных галогенпроизводных как правило сопровождаются исчезновением оптической активности. Причиной служит равновероятная возможность атаки нуклеофилом с обоих сторон плоскости карбокатиона, (имеет плоское строение):

В результате возможности атаки карбкатиона с обоих сторон образуется смесь двух оптически активных изомеров, которая называется рацемической смесью. Сами компоненты рацемической смеси называются энантиомерами, а явление носит название рацемизацция.
2. Влияние строения субстрата в реакциях SN1.
В реакциях SN1 скоростьлимитирующей стадией является образование карбкатиона. Поэтому активность галогенопроизводных возрастает в том же порядке, что и устойчивость образующихся карбкатионов. Метилгалогениды и первичные галогеналканы по механизму SN1 практически не реагируют из-за неустойчивости первичных карбкатионов. Вторичные галогеналканы реагируют очень медленно. Только третичные галогеналканы вступают в реакции SN1 с достаточно высокой скоростью, что позволяет использовать реакцию практически.
Замена атомов водорода в метилгалогенидах на винильные и фенильные группы еще более резко повышает скорость реакции SN1, поскольку на медленной стадии образуются карбкатионы, стабилизированные резонансом.
3. Влияние природы растворителя на реакции SN1.
Реакции SN1 протекают, преимущественно в полярных протонных растворителях с высокой ионизирующей способностью. Вода обладает наибольшей ионизирующей способностью и обеспечивает максимальную скорость гидролиза и сольволиза. Однако многие галогенопроизводные не растворяются в воде. Поэтому в реакциях SN1 чаще всего в какчестве растворителя применяют муравьиную и уксусную кислоты, метиловый и этиловый спирт или их водные растворы.
1.4.3 Механизм SN2. Бимолекулярное замещение
Реакции нуклеофильного замещения протекают по бимолекулярному механизму придействии на субстраты сильных нуклеофильных реагентов. Например щелочной гидролиз метилбромида:

В этой реакции гидроксид-ион (вступающая группа, нуклеофил) замещает анион брома (уходящая группа или нуклеофуг) в молекуле метилбромида (субстрат).
Скорость реакции бимолекулярного замещения пропорциональна концентрациям субстрата и нуклеофила. Следовательно, в скоростьлимитирующей стадии гидролиза метилбромида участвуют две частицы: метилбромид и гидроксид-ион:

Гидроксид-ион атакует атом углерода, имеющий частичный положительный заряд, со стороны, противоположной атому брома, т.е. «с тыла». Образование связи С-О и разрыв связи С-Br происходят одновременно. Это означает, что реакция протекает как синхронный процесс. Синхронному процессу соответствует следующая энергетическая диаграмма:







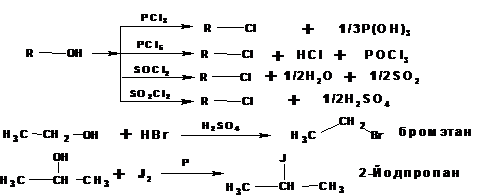
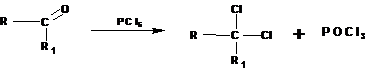
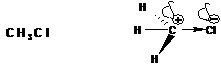

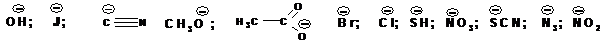
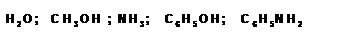



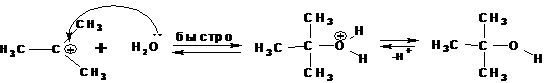









 Особенности мономолекулярного нуклеофильногозамещения
Особенности мономолекулярного нуклеофильногозамещения