Электропроводность – величина, обратная сопротивлению. Она характеризует способность вещества проводить электрический ток. Единица измерения Ом-1 или См (сименс).
Удельная электропроводность(χ) – это электропроводность слоя раствора длиной 1 см и сечением 1 см2. Размерность См·см-1.
Эквивалентная электропроводность(λ) – это электропроводность такого объема раствора, в котором содержится 1 моль-экв. раствореннного вещества; если расстояние между электродами 1 см, то размерность будет См·см2·моль-экв-1.
Разбавление(V) – величина, обратная концентрации;это объем раствора в л (или мл), который содержит 1 моль-экв. растворенного вещества:
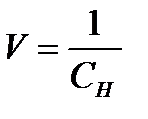 .
.
Между χ и λ существует зависимость:
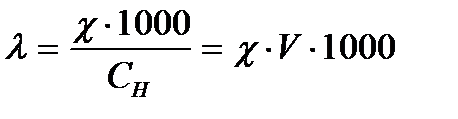 ,
,
где СН – нормальность раствора, моль-экв./л.
По мере разбавления значение λ стремится к определенному предельному значению 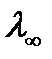 , которая зависит только от эквивалентных электропроводностей катиона
, которая зависит только от эквивалентных электропроводностей катиона  и аниона
и аниона 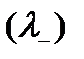 :
:
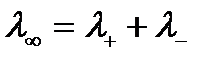 .
.
По отношению λ к 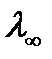 для слабых электролитов можно определить степень диссоциации a:
для слабых электролитов можно определить степень диссоциации a:
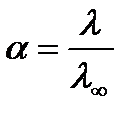 .
.
Зная степень диссоциации, по закону разбавления Оствальда можно вычислить константу диссоциации (Кд) слабого электролита:
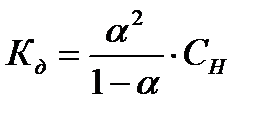 .
.
Если раствор данного вещества подчиняется закону разбавления Оствальда, то вычисленная по последнему уравнению константа диссоциации должна совпадать со значениями Кд, приведенными в литературе.
Подвижность иона водорода  350 См·см2·моль-экв-1. Поэтому подвижность анионов кислот (таблица 4.1), вычисляют по формуле
350 См·см2·моль-экв-1. Поэтому подвижность анионов кислот (таблица 4.1), вычисляют по формуле
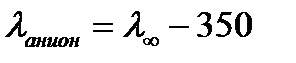 .
.
Подвижность гидроксид иона 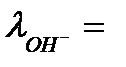 198 См·см2·моль-экв-1. Поэтому подвижность катионов оснований (таблица 4.1), вычисляют по формуле
198 См·см2·моль-экв-1. Поэтому подвижность катионов оснований (таблица 4.1), вычисляют по формуле
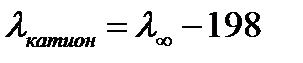 .
.
Абсолютные скорости ионов определяют исходя из их подвижности:
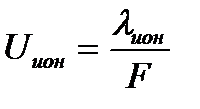 ,
,
где F= 96500 Кл·моль-экв.-1 – число Фарадея; Uион – абсолютная скорость движения иона, см2·В-1·с-1.
Поскольку у аниона и катиона абсолютные скорости разные, то и доля участия их в общем процессе переноса заряда будет разная. Это можно оценить по значению числа переноса катиона и аниона:
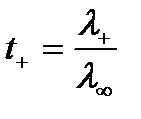 и
и  ,
,
где 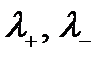 - подвижности катиона и аниона;
- подвижности катиона и аниона; 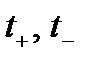 - числа переноса катиона и аниона.
- числа переноса катиона и аниона.
Гальванические элементы
Гальванический элемент – это устройство, которое преобразует энергию окислительно-восстановительной химической реакции в электрическую энергию. В гальваническом элементе один из электродов является катодом, а другой – анодом.
Катод – электрод, на котором происходит реакция восстановления, а анод – на котором происходит реакция окисления.
Электродные потенциалы вычисляют по уравнению Нернста:
- для электродов 1-го рода
 ,
,
где Е0 – стандартный электродный потенциал (таблица 4.1); п – число электронов, участвующих в элементарной электродной реакции; Скатион - молярная концентрация ионов металла в растворе.
Для водородного электрода (H+ + e = 1/2H2) уравнение Нернста имеет вид:
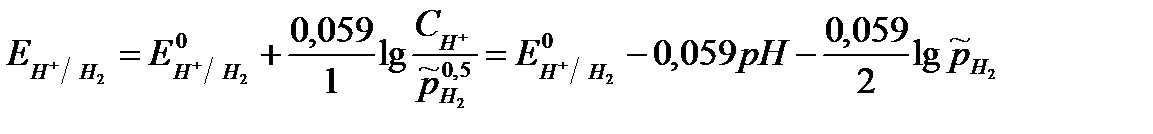 ,
,
где 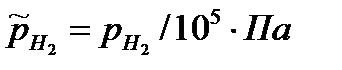 - относительное парциальное давление водорода (величина безразмерная),
- относительное парциальное давление водорода (величина безразмерная),  - парциальное давление водорода, Па
- парциальное давление водорода, Па
Для кислородного электрода (1/2O2 +H2O + 2 e = 2OH-) уравнение Нернста имеет вид:
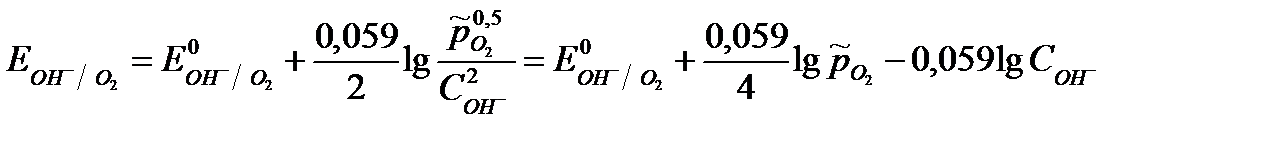 ,
,
где 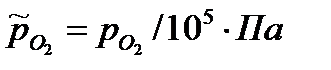 - относительное парциальное давление кислорода (величина безразмерная),
- относительное парциальное давление кислорода (величина безразмерная), 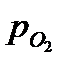 - парциальное давление кислорода, Па
- парциальное давление кислорода, Па
- для электродов 2-го рода
 ,
,
где Санион – молярная концентрация анионов труднорастворимой соли электрода 2-го рода в растворе.
Электродвижущую силу гальванического элемента (э.д.с.) определяют как разницу электродных потенциалов
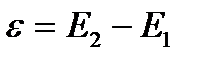 ,
,
где Е2 – электродный потенциал катода, Е1 – электродный потенциал анода.
Уравнение токообразующей реакции гальванического элемента записывают как сумму электродных реакций. Например для гальванического элемента Якоби-Даниеля
Zn|ZnSO4||CuSO4|Cu
токообразующей является реакция
Zn + CuSO4 = ZnSO4 + Cu,
которая получается после суммирования уравнений электродных процессов:
катод: Cu2+ + 2 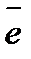 = Cu0
= Cu0
анод: Zn0 - 2 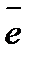 = Zn2+
= Zn2+
-------------------------------------
Zn + Cu2+ = Zn2+ + Cu
Последнее уравнение является сокращенным ионным уравнением токообразующей реакции.
Изменение свободной энергии Гиббса в токообразующей реакции связано с э.д.с. гальванического элемента уравнением
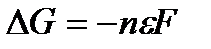 ,
,
где 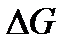 - изменение свободной энергии Гиббса, Дж/моль-экв; п – число электронов, участвующих в токообразующей реакции;
- изменение свободной энергии Гиббса, Дж/моль-экв; п – число электронов, участвующих в токообразующей реакции; 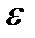 - э.д.с., В; F – число Фарадея.
- э.д.с., В; F – число Фарадея.
Литература: [1], c. 234 – 259; [2], c. 112 – 118, 125 – 129.
Таблица 1.4.1 Стандартные электродные потенциалы при 250С
| Электрод
| Электродная реакция
| Е0, В
|
| Li+|Li
Mg2+|Mg
Al3+|Al
Mn2+|Mn
Zn2+|Zn
Fe2+|Fe
Ni2+|Ni
H+|H2,Pt
Br-|AgBr,Ag
Cl-|AgCl,Ag
Cu2+|Cu
OH-|O2,Pt
Ag+|Ag
Br-|Br2,Pt
Cl-|Cl2,Pt
| Li+ + e =Li
Mg2+ +2 e = Mg
Al3+ + 3 e = Al
Mn2+ + 2 e = Mn
Zn2+ + 2 e = Zn
Fe2+ + 2 e = Fe
Ni2+ + 2 e = Ni
H+ + e = 1/2H2
AgBr + e = Ag + Br-
AgCl + e = Ag + Cl-
Cu2+ + 2 e = Cu
1/2O2 +H2O + 2 e = 2OH-
Ag+ + e = Ag
Br2 + 2 e = 2 Br-
Cl2 + 2 e = 2Cl-
| - 3,045
- 2,363
- 1,662
- 1,180
-0,763
- 0,440
- 0,250
0,000
+ 0,073
+ 0,222
+ 0,337
+ 0,401
+ 0,799
+ 1,065
+ 1,360
|
Задание 1.4.1. Электропроводность растворов
Используя данные таблицы 4.2 о свойствах раствора вещества в воде, решите следующие задачи:
1) постройте графики зависимости удельной и эквивалентной электропроводности раствора вещества от разбавления V;
2) проверьте, подчиняется ли раствор вещества А в воде закону разбавления Оствальда.
3) вычислите абсолютные скорости и числа переноса аниона и катиона при бесконечном разбавлении.
Задание 1.4.2. Гальванический элемент
Для данного гальванического элемента (таблица 4.3):
1) определите анод и катод;
2) напишите уравнения процессов, протекающих на аноде и катоде в работающем гальваническом элементе. Запишите уравнение токообразующей реакции;
3) принимая концентрацию ионов у катода 10-2 моль/л и анода
10-3 моль/л, парциальные давления газов р = 1 атм, рассчитайте электродвижущую силу гальванического элемента и энергию Гиббса токообразующего процесса в данном гальваническом элементе.
Таблица 1.4.3 Варианты к заданию 1.4.2
| Номер варианта
| Гальваническая пара
| Номер варианта
| Гальваническая пара
|
| 1
| H2,Pt|H+ || Zn2+|Zn
| 10
| Ni|Ni2+ || Fe2+|Fe
|
| 2
| Ni|Ni2+ || Zn2+|Zn
| 11
| Ag|Ag+ || Zn2+|Zn
|
| 3
| H2,Pt|H+ || Cl-|AgCl,Ag
| 12
| H2,Pt|H+ || Cu2+|Cu
|
| 4
| Ni|Ni2+ || Mg2+|Mg
| 13
| Ag|Ag+ || H+|H2,Pt
|
| 5
| O2,Pt|OH-|| Mg2+|Mg
| 14
| Li|Li+ || Cl-|Cl2,Pt
|
| 6
| Al|Al3+ || OH-|O2,Pt
| 15
| Mg2+|Mg || OH-|O2,Pt
|
| 7
| Br2,Pt|Br- || Zn2+|Zn
| 16
| Li|Li+ || H+|H2,Pt
|
| 8
| H2,Pt|H+ || Cl-|Cl2,Pt
| 17
| Mn|Mn2+ || Zn2+|Zn
|
| 9
| Ag,AgBr|Br- || Cl-|Cl2,Pt
| 18
| Cu|Cu2+|| Mg2+|Mg
|
Таблица 1.4.2 Зависимость удельного сопротивления раствора вещества (Ом·см) от концентрации при Т= 298 К (Варианты к заданию 1.4.1)
| Вариан-ты
| 1, 10
| 2, 11
| 3, 12
| 4, 13
| 5, 14
| 6, 15
| 7, 16
| 8, 17
| 9, 18
|
| С,
моль/л
| HCN
| HNO2
| HOCl
| HCOOH
| CH3COOH
| (CH3)2AsOOH
| C6H5OH
| C6H5COOH
| NH4OH
|
| 0,1
| 3,1·105
| 432
| 9,27·104
| 606
| 1960
| 1,31·104
| 7,45·105
| 975
| 255
|
| 0,05
| 4,37·105
| 570
| 1,39·105
| 891
| 2760
| 1,80·104
| 1,08·106
| 1410
| 1030
|
| 0,03
| 5,84·105
| 750
| 1,81·105
| 1030
| 3480
| 2,35·104
| 1,45·106
| 1850
| 1450
|
| 0,01
| 10,1·105
| 1340
| 3,12·105
| 1820
| 6100
| 4,02·104
| 2,35·106
| 3140
| 2580
|
| 0,005
| 14,3·105
| 2040
| 4,56·105
| 2590
| 8700
| 5,82·104
| 3,27·106
| 4880
| 10000
|
| 0,003
| 18,3·105
| 2680
| 5,56·105
| 3580
| 10300
| 7,96·104
| 4,15·106
| 5790
| 14300
|
| 0,001
| 31,9·105
| 5270
| 1,0·106
| 6850
| 18500
| 1,31·105
| 7,46·106
| 10040
| 25100
|
| Кд
| 6,6·10-10
| 4,6·10-4
| 5·10-8
| 1,8·10-4
| 1,63·10-5
| 6,4·10-7
| 1,01·10-10
| 6,14·10-5
| 1,8·10-5
|
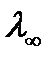 , См·см2·моль-экв-1 , См·см2·моль-экв-1
| 428
| 412
| 400
| 404
| 391
| 382
| 383
| 382
| 273
|
Модуль 2 КОЛЛОИДНАЯ ХИМИЯ
Коллоидная химия – это наука о дисперсных системах и поверхностных явлениях. Она изучает физико-химические свойства высокодисперсных систем и растворов высокомолекулярных соединений.
Дисперсная система (ДС) – это система, в которой хотя бы одно вещество находится в диспергированном (раздробленном) состоянии. Она состоит из двух фаз – дисперсной фазы (ДФ) и дисперсионной среды. Дисперсная фаза – это то, что находится в диспергированном состоянии, а дисперсионная среда – это сплошная однородная среда, в объеме которой распределена дисперсная фаза. Обе составляющие дисперсной системы могут находиться в любом из трех агрегатных состояний: газообразном, жидком или твердом.
Выделение дисперсных систем как особых объектов исследования объясняется тем, что:
1) в данных системах высокоразвитая поверхность частиц ДФ, что является причиной появления в ДС избыточной свободной поверхностной энергии (ΔGs) и связанной с ним различных поверхностных явлений;
2) в ДС возникают размерные (масштабные) эффекты, которые проявляются в виде значительного отличия реакционной способности, прочности, электрических и магнитных свойств, теплоемкости, температуры плавления и других свойств частиц ДФ от подобных свойств макроскопических тел.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ



 .
.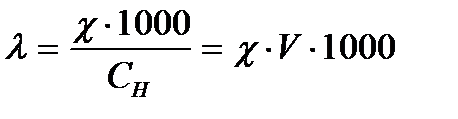 ,
,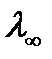 , которая зависит только от эквивалентных электропроводностей катиона
, которая зависит только от эквивалентных электропроводностей катиона  и аниона
и аниона 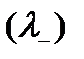 :
: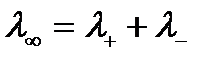 .
.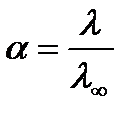 .
.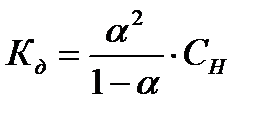 .
. 350 См·см2·моль-экв-1. Поэтому подвижность анионов кислот (таблица 4.1), вычисляют по формуле
350 См·см2·моль-экв-1. Поэтому подвижность анионов кислот (таблица 4.1), вычисляют по формуле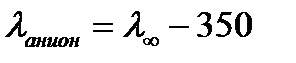 .
.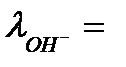 198 См·см2·моль-экв-1. Поэтому подвижность катионов оснований (таблица 4.1), вычисляют по формуле
198 См·см2·моль-экв-1. Поэтому подвижность катионов оснований (таблица 4.1), вычисляют по формуле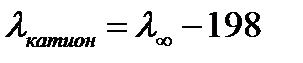 .
.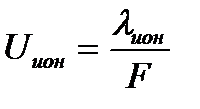 ,
,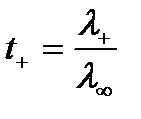 и
и  ,
,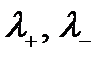 - подвижности катиона и аниона;
- подвижности катиона и аниона; 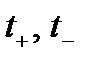 - числа переноса катиона и аниона.
- числа переноса катиона и аниона. ,
,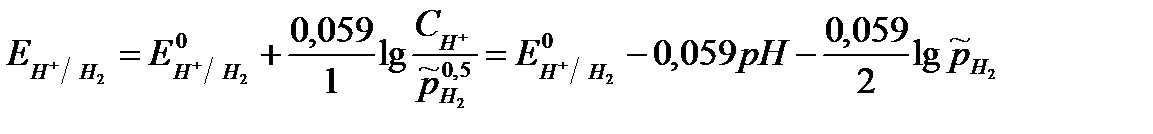 ,
,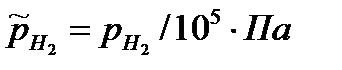 - относительное парциальное давление водорода (величина безразмерная),
- относительное парциальное давление водорода (величина безразмерная),  - парциальное давление водорода, Па
- парциальное давление водорода, Па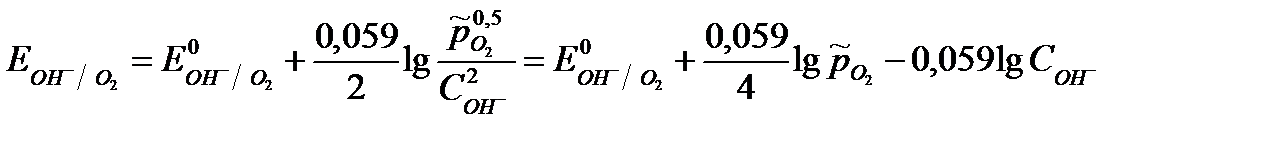 ,
,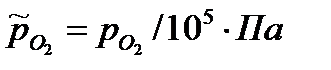 - относительное парциальное давление кислорода (величина безразмерная),
- относительное парциальное давление кислорода (величина безразмерная), 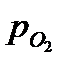 - парциальное давление кислорода, Па
- парциальное давление кислорода, Па ,
,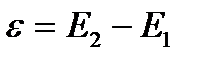 ,
, = Cu0
= Cu0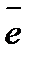 = Zn2+
= Zn2+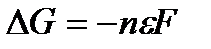 ,
,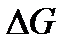 - изменение свободной энергии Гиббса, Дж/моль-экв; п – число электронов, участвующих в токообразующей реакции;
- изменение свободной энергии Гиббса, Дж/моль-экв; п – число электронов, участвующих в токообразующей реакции; 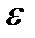 - э.д.с., В; F – число Фарадея.
- э.д.с., В; F – число Фарадея.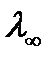 , См·см2·моль-экв-1
, См·см2·моль-экв-1



