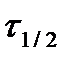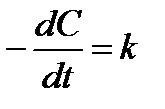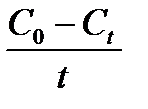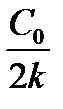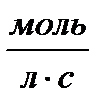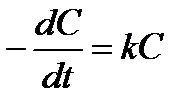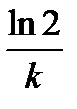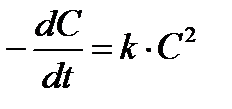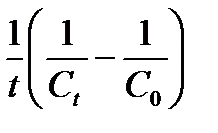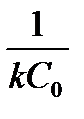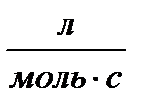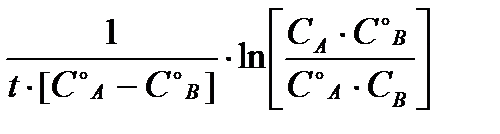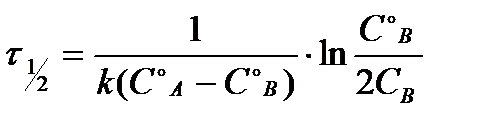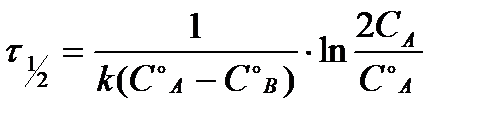МЕТОДИЧЕСКИЕ УКАЗАНИЯ
для выполнения домашнего задания (эссе)
по дисциплине
Б2.Б.9 ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
направление подготовки бакалавра
Технология продукции и организации общественного питания
Уфа - 2014
УДК
Рекомендовано к изданию методической комиссией
факультета пищевых технологий
(протокол № 5 от 24 февраля 2014г.)
\
Составитель: доценты Нигматуллин Н.Г, Ганиева Е.С.
Рецензент:
доцент кафедры кормления животных и физиолигии Н.Л.Нурмухаметова
Ответственный за выпуск:
заведующий кафедрой химии Ярмухамедова Э.И.
Введение
Физическая и коллоидная химия имеют большое практическое значение. Они открывают широкие возможности активного управления химико-технологическими процессами, рационального использования сырья, повышения качества продукции, экономии энергетических ресурсов, защиты окружающей среды и т.д. Данное методическое пособие является практическим руководством для самостоятельной работы студентов II курса факультета пищевых технологий по дисциплине «Физическая и коллоидная химия», в котором представлены задания по основным разделам физической химии: химическая термодинамика, фазовые равновесия, химическая кинетика и электрохимия, и коллоидной химии: поверхностные явления, лиофобные дисперсные системы, лиофильные дисперсные системы, микрогетерогенные системы.
Данные задания предназначены для контроля самостоятельной работы студентов при изучении теоретических основ физической и коллоидной химии и приобретения навыков физико-химического расчета.
Каждый студент выполняет задания согласно варианту, определяемому преподавателем. Следует обратить внимание на то, что некоторые задачи имеют общие условия, а данные представлены в обобщенных таблицах. Для каждой из этих задач исходные данные для расчета нужно брать в таблице напротив номера задачи, соответствующего вашему варианту.
С целью привития навыков работы со справочной литературой в некоторых задачах отсутствуют некоторые данные, необходимые для их решения. Студент должен самостоятельно отыскать их в справочных изданиях.
Литература
1. Нигматуллин Н.Г. Физическая и коллоидная химия: Учебное пособие. – Уфа.: Изд-во БГАУ, 2014.-с.280.
2. Физическая химия: Учебник для хим. спец. вузов / Под ред. А.Г.Стромберга. – М.: Высшая школа, 2003. –С. 528.
3. Задачи по физической химии: Учебное пособие / В.В. Еремин, С.И. Каргов, И.А. Успенская, Н.Е. Кузьменко, В.В. Лунин – М.: Издательство «Экзамен», 2003. – 320 с.
4. Краткий справочник физико-химических величин / Под ред. К.П. Мищенко, А.А. Равделя – Издательство «Химия», Ленинградское отделение, 1967. – 184 с.
5. Гельфман М.И., Ковалевич О.В., Юстратов В.П. Коллоидная химия.- Спб.: Издательство «Лань», 2008. – 336с.
6. Зимон А.Д., Лещенко Н.Ф. Коллоидная химия – М.: ВЛАДМО, 1999. – 320с.
МОДУЛЬ 1 ФИЗИЧЕСКАЯ ХИМИЯ
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Химическая термодинамика является наукой об энергетических эффектах химических реакций, их направлении и равновесии. Изучает применение законов термодинамики к химическим и физико-химическим процессам.
Термодинамический метод полезен тем, что позволяет:
- установить взаимосвязь между параметрами системы, что дает возможность вычислить неизвестный параметр системы по другим известным параметрам;
- оценить величину изменения параметров системы при осуществлении какого-либо процесса в ней;
- определить параметры системы после перехода ее их одного состояния в другое термодинамическое состояние или из одного технологического режима в другой режим проведения процесса;
- определить принципиальную возможность протекания процесса в нужном направлении;
- оценить глубину протекания процесса в зависимости от условий.
До выполнения задания по химической термодинамике следует проработать лекционный материал соответствующего раздела. По учебнику [1] изучить теоретический материал и разобрать решения типовых задач по задачнику [2].
При определении параметров простейших термодинамических процессов идеальных газов (задание 1) советуем воспользоваться формулами, приведенными в таблицах 1.1 и 1.2. Необходимо обратить особое внимание на правильное применение соответствующих размерностей параметров. Используйте следующие значения универсальной газовой постоянной: R = 8,31 Дж/(моль·К) = 1,98 кал/(моль·К) = 0,082(л·атм)/(моль·К). Формулы в таблицах 1.1 и 1.2 приведены для 1 моля вещества. Если формула содержит параметры 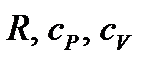 , то полученное значение термодинамической функции необходимо умножить на число молей вещества.
, то полученное значение термодинамической функции необходимо умножить на число молей вещества.
Выполнение задания 2 дает возможность усвоить методику определения параметров D H, D S, Dс и D G химических реакций в стандартных условиях и при любой другой температуре, а также наглядно увидеть по графикам характер изменения параметров 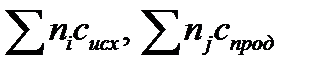 и DНТ в зависимости от температуры. Для этого воспользуйтесь данными таблицы 1.3 и 1.4.
и DНТ в зависимости от температуры. Для этого воспользуйтесь данными таблицы 1.3 и 1.4.
Тепловой эффект реакций при стандартных условиях определяется по формуле

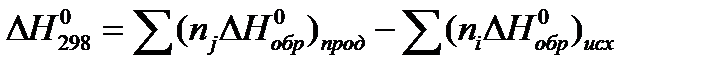
Соответствующие значения 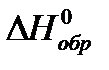 компонентов приведены в таблице 1.4.
компонентов приведены в таблице 1.4.
При расчете тепловых эффектов при других температурах необходимо опираться на закон Кирхгофа и на вытекающее из него уравнение
 ,
,
в котором 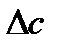 - разность суммы теплоемкостей продуктов и исходных реагентов
- разность суммы теплоемкостей продуктов и исходных реагентов
 ,
,
где индекс i – стехиометрические коэффициенты соответствующих исходных реагентов; j – стехиометрические коэффициенты соответствующих продуктов реакции.
При этом можно сделать следующие допущения:
1. 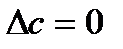 . Тогда
. Тогда 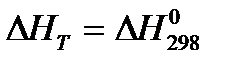 .
.
2. 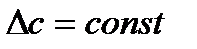 . Тогда
. Тогда 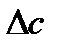 определяется по значениям теплоемкости компонентов реакционной системы при стандартных условиях (таблица 1.4) и значение
определяется по значениям теплоемкости компонентов реакционной системы при стандартных условиях (таблица 1.4) и значение  вычисляют по формуле
вычисляют по формуле
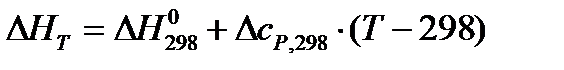 .
.
3. 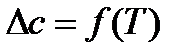 . При этом допущении необходимо учитывать температурную зависимость теплоемкости компонентов реакционной системы
. При этом допущении необходимо учитывать температурную зависимость теплоемкости компонентов реакционной системы
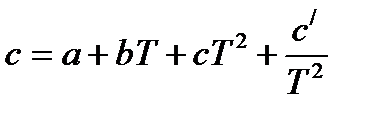 ,
,
из которой следует
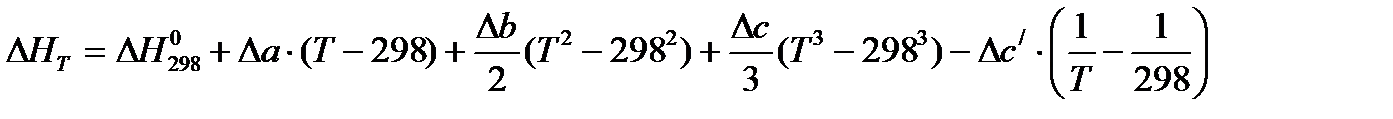 ,
,
где 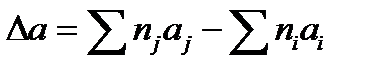 . Параметры
. Параметры 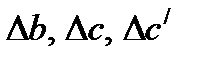 рассчитываются аналогичным образом. Значения а, b, c, c/ компонентов реакции приведены в таблице 1.4.
рассчитываются аналогичным образом. Значения а, b, c, c/ компонентов реакции приведены в таблице 1.4.
Графики зависимостей  ,
,  и
и 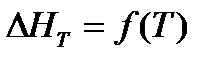 строятся по четырем значениям температуры, при этом необходимо произвольно выбрать два промежуточных значения температуры и вычислить соответствующие им параметры
строятся по четырем значениям температуры, при этом необходимо произвольно выбрать два промежуточных значения температуры и вычислить соответствующие им параметры 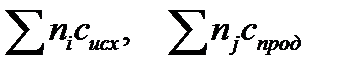 и
и  .
.
Изменение энтропии реакции при стандартных условиях определяются исходя из значений S0 (таблица 1.4) по формуле:
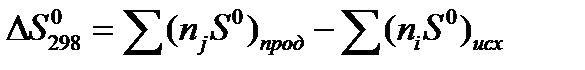 .
.
При определении 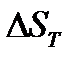 необходимо учитывать температурную зависимость теплоемкости компонентов от температуры:
необходимо учитывать температурную зависимость теплоемкости компонентов от температуры:
 .
.
Вычисление  проводят по формуле
проводят по формуле
 .
.
Значение 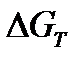 определяют по аналогичной формуле
определяют по аналогичной формуле
 .
.
По знаку величин  и
и 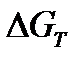 определяют возможное направление протекания реакции при стандартных условиях и при температуре Т.
определяют возможное направление протекания реакции при стандартных условиях и при температуре Т.
Литература: [1], с.59 – 105; [2], с.23 – 25, 32 – 34, 43 – 46, 57 – 59.
Таблица 1.1 Связь между основными параметрами состояния в простейших процессах и определение их функции перехода
| Название
процесса
| Уравнение
процесса
| Связь между
параметрами
состояния
| Работа в процессе
| Количество теплоты, сообщенное в процессе
|
| Изобарный
| 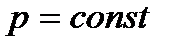
| 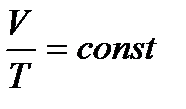
| 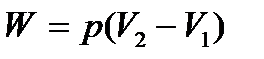
| 
|
| Изотер-мический
| 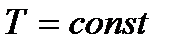
| 
| 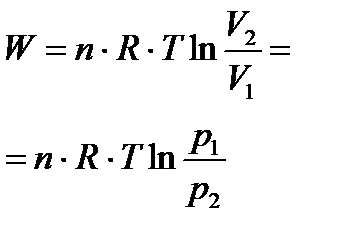
| 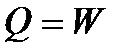
|
| Изохорный
| 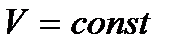
| 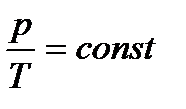
| 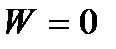
| 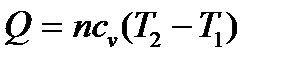
|
| Адиабатный
| 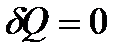
| 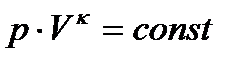
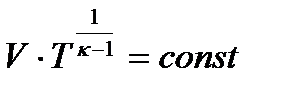

| 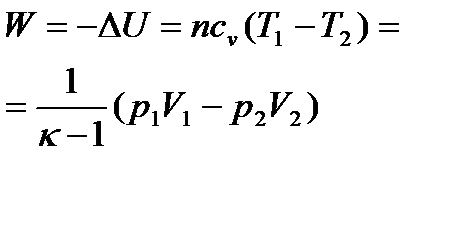 
| 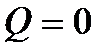
|
Таблица 1.2 Изменение функций состояния системы в простейших процессах для п молей вещества
| Название процесса
| Δ H
| Δ U
| Δ S
| Теплоемкость
|
| Изобар-ный
| Δ Н= Δ U+W=
=Q
| Δ U=п cv(T2 – T1)
| 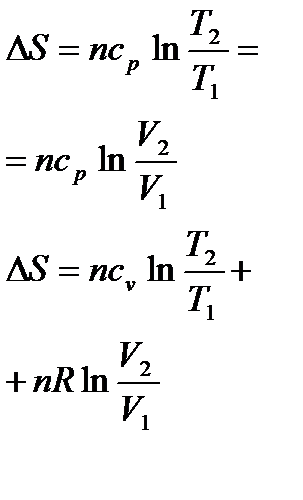
| 
|
| Изотер-
мический
| Δ Н = 0
| Δ U = 0
| 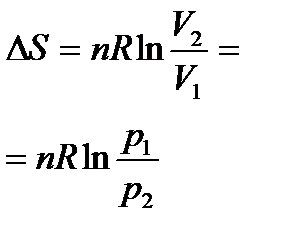
| 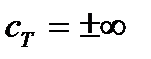
|
| Изохор-ный
| Δ Н=пс p (T2 –T1)
| Δ U=п cv(T2 – T1)
| 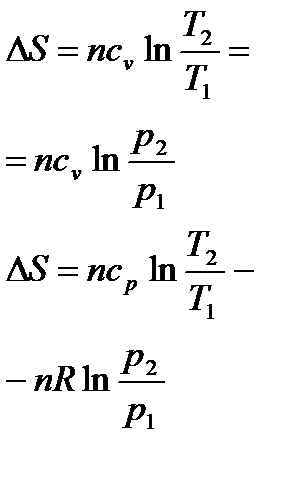
| 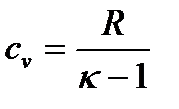
|
| Адиабат-ный
| 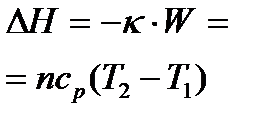
| 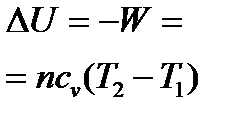
| 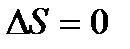
| сад = 0
|
Задание 1.1.1 Применение законов термодинамики к изопроцессам
Решите задачу, соответствующую вашему варианту.
1. Какое количество теплоты необходимо для повышения температуры 16 г кислорода от 300 до 500 К при давлении 1 атм? Как при этом изменится внутренняя энергия? Найти начальный и конечный объемы системы.
2. 5 л криптона, взятого при нормальных условиях, нагревается до 873 К при постоянном объеме. Каково конечное давление газа и количество тепла, затраченного на нагревание? Определить параметры D U и W.
3. 10 г кислорода, взятого при 298 К сжимают адиабатически от 8 л до 5 л. Определить конечную температуру, затраченную работу, изменение внутренней энергии и изменение энтальпии, если 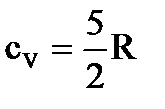 .
.
4. 2 моля паров Br2 обратимо и изотермически сконденсировали в жидкость при 590С. Рассчитать W, Q, D U и D Н в этом процессе. Удельная теплота испарения брома при 590С равна 184,1 Дж/г.
5. Кислород обратимо и изотермически расширяется от 1 до 5 м3. Начальная температура 300С, начальное давление 100 кПа. Определить D U, Q, W и конечное давление системы.
6. 5 молей двухатомного идеального газа, взятого при 200С и давлении 50 атм, расширяется обратимо и изотермически до 5 атм. Определите W, Q, D U и D Н.
7. Один моль фторуглерода расширяется обратимо и адиабатически вдвое по объему. Начальная температура 298,15 К, давление 15 атм. Конечная температура 248,44 К. Определить V 1, V 2, р2, с v и с p.
8. 20 г кислорода, взятого при 298 К расширяется адиабатически от 5 л до 10 л. Начальное давление газа 30 атм. Определить Т2, р1, р2, W, D U и D Н.
9. 8 молей одноатомного идеального газа, взятого при 200С и 10 атм сжимается обратимо и изотермически до 20 атм. Определить W, Q, D U, D Н, V 1 и V 2.
10. Одноатомный идеальный газ изобарно расширяется от 5 л до 10 л под давлением 200 кПа. Начальная температура газа 298 К. Определить D U, W, Т2 и D Н.
11. 5 молей N2 нагревается в автоклаве от 300 К до 500 К. Объем автоклава 10 л. Определить р1, р2, D U, W, D Н и Q.
12. 3 моля двухатомного идеального газа, находящегося при 200 К и 2 атм, обратимо и адиабатически сжали до 250 К. Определить р2, V 2, V 1, W, D U, D Н и Q.
13. Одноатомный идеальный газ изобарно сжимается от 30 л до 3 л под давлением 300 кПа. Начальная температура газа 200 К. Определить Т2, W, D U и D Н.
14. Четыре моля одноатомного идеального газа, имеющего температуру 500С и 20 атм расширяется обратимо и изотермически до 5 атм. Определить W, Q, D U, D Н, V 1 и V 2.
15. Три моля кислорода нагревается изохорно от 298К до 450 К. Первоначальное давление газа 101,3 кПа. Определить V, р2, D U, W, D Н и Q.
16. 50 г неона, находящегося при от 298 К и 101,3 кПа, обратимо и адиабатически сжали до 2 МПа. Определить Т2, V 1, V 2, W, D U, D Н и Q.
17. 30 г хлора, взятого при 293 К и 5 атм сжимают обратимо и изотермически до 30 атм. Определить W, Q, D U, D Н, V 1 и
18. Одноатомный идеальный газ изобарно сжимают от 50 л до 30 л под давлением 101,3 кПа. Начальная температура газа 293 К. Определить D U, W, Т2, D Н и Q.
Задание 1.1.2 Термодинамические расчеты
Для реакции, приведенной в таблице 1.3, соответствующей вашему варианту:
1) рассчитайте стандартный тепловой эффект реакции по известным величинам стандартных теплот образования исходных веществ и продуктов реакции;
2) определите DНт из предположения:
а) D с = 0;
б) D с = const;
в) D с = f (Т).
3) постройте на одном графике зависимости S спрод = f (Т) для продуктов и
S сисх = f (Т) для исходных реагентов;
4) постройте график зависимости D НТ = f (Т) в интервале (298К… Т);
5) определите 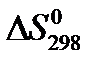 и D S Т для реакции;
и D S Т для реакции;
6) вычислите значение 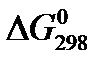 и D G Т и сделайте вывод о направлении реакции в стандартных условиях и при температуре Т.
и D G Т и сделайте вывод о направлении реакции в стандартных условиях и при температуре Т.
Таблица1.3 Варианты к заданию 1.1.2.
| № варианта
| Уравнение реакции
| Т, К
|
| 1
| 2H2 (г) + CO (г) = CH3OH (г)
| 800
|
| 2
| 4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г)
| 750
|
| 3
| NH4Cl (к) = NH3 (г) + HCl (г)
| 455
|
| 4
| 2N2 (г) + 6H2O (г) = 4NH3 (г) + 3O2 (г)
| 1300
|
| 5
| 4NO (г) + 6H2O (г) = 4NH3 (г) + 5O2 (г)
| 1000
|
| 6
| 2NO2 (г) = 2NO (г) + O2 (г)
| 700
|
| 7
| N2O4 (г) = 2NO2 (г)
| 400
|
| 8
| Mg(OH)2 (к) = MgO (к) + H2O (г)
| 500
|
| 9
| CaCO3 (к) = CaO (к) + CO2 (г)
| 1000
|
| 10
| Ca(OH)2 (к) = CaO (к) + H2O (г)
| 500
|
| 11
| 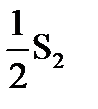 (г) + 2Н2О (г) = SO2 (г) + 2H2 (г) (г) + 2Н2О (г) = SO2 (г) + 2H2 (г)
| 1000
|
| 12
|  (г) + 2СО2 (г) = SO2 (г) + 2CO(г) (г) + 2СО2 (г) = SO2 (г) + 2CO(г)
| 900
|
| 13
| 2SO2 (г) + O2 (г) = 2SO3 (г)
| 700
|
| 14
| SO2 (г) + Cl2 (г) = SO2Cl2 (г)
| 400
|
| 15
| CO (г) + 3H2 (г) = CH4 (г) + H2O (г)
| 1000
|
|
|
|
|
| 16
| 2CO (г) + SO2 (г) =  (г) + 2СО2(г) (г) + 2СО2(г)
| 900
|
| 17
| CO (г) + Cl2 (г) = COCl2 (г)
| 400
|
| 18
| CO2 (г) + H2 (г) = CO (г) + H2O (г)
| 1200
|
Таблица 1.4 Термодинамические характеристики веществ
| Вещество
| D Н0обр

| S 0 ,
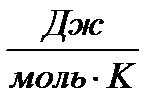
| Ср = а + bT + 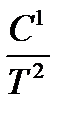 + C Т2, + C Т2, 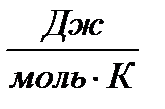
| 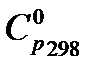 , ,
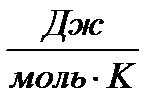
|
| а
| b ∙ 103
| c ∙ 106
| c ' ∙ 10-5
|
| H2 (г)
| 0
| 130,7
| 27,3
| 3,27
| -
| 0,5
| 28,85
|
| CO (г)
| -110,6
| 197,7
| 28,43
| 4,1
| -
| -0,46
| 29,13
|
| CH3OH (г)
| -202,1
| 239,9
| 15,29
| 105,27
| -31,07
| -
| 44,00
|
| HCl (г)
| -92,4
| 186,9
| 26,54
| 4,61
| -
| 1,09
| 29,15
|
| O2 (г)
| 0
| 205,2
| 31,46
| 3,39
| -
| -3,77
| 29,37
|
| H2O (г)
| -242,0
| 188,9
| 30,02
| 10,72
| -
| 0,33
| 33,6
|
| Cl2 (г)
| 0
| 223,1
| 36,9
| 1,05
| -
| -2,52
| 33,96
|
| NH4Cl (к)
| -315,4
| 94,56
| 49,37
| 133,89
| -
| -
| 84,20
|
| NH3 (г)
| -46,19
| 192,5
| 29,80
| 25,48
| -
| -1,67
| 35,65
|
| N2 (г)
| 0
| 191,5
| 27,87
| 4,27
| -
| -
| 29,14
|
| NO (г)
| 90,3
| 210,7
| 29,58
| 3,85
| -
| -0,58
| 29,89
|
| NO2 (г)
| 33,89
| 240,3
| 42,16
| 8,54
| -
| -6,74
| 37,11
|
| N2O4 (г)
| 9,37
| 304,0
| 83,89
| 39,75
| -
| -14,90
| 78,99
|
| Mg(OH)2 (к)
| -924,66
| 63,2
| 54,56
| 66,15
| -
| -
| 76,99
|
| MgO (к)
| -601,24
| 26,94
| 42,59
| 7,28
| -
| -6,20
| 37,41
|
| CaCO3 (к)
| -1207,9
| 92,9
| 104,5
| 21,92
| -
| -25,94
| 81,85
|
| CaO (к)
| -635,5
| 39,8
| 49,65
| 4,52
| -
| -6,95
| 42,83
|
| Ca(OH)2 (к)
| -986,8
| 83,4
| 105,27
| 11,953
| -
| -18,979
| 87,55
|
| S2 (г)
| 129,1
| 228,2
| 36,11
| 1,09
| -
| -3,52
| 32,49
|
| SO2 (г)
| -296,9
| 248,2
| 42,55
| 12,55
| -
| -5,65
| 39,90
|
| CO2 (г)
| -393,51
| 213,8
| 44,17
| 9,04
| -
| -8,54
| 37,14
|
| SO3 (г)
| -395,2
| 256,23
| 57,36
| 26,88
| -
| -13,06
| 50,70
|
| SO2Cl2 (г)
| -358,7
| 311,3
| 53,72
| 79,50
| -
| -
| 77,4
|
| CH4 (г)
| -74,9
| 186,4
| 17,46
| 60,5
| 1,118
| -
| 35,63
|
| COCl2 (г)
| -223,0
| 289,2
| 67,16
| 12,11
| -
| -9,03
| 60,67
|
| C2H6 (г)
| -84,67
| 229,7
| 4,494
| 182,26
| -74,86
| -
| 52,71
|
| C2H5OH (г)
| -235,3
| 282,0
| 19,09
| 212,86
| -108,69
| -
| 73,6
|
| С2H4 (г)
| 52,28
| 219,4
| 4,19
| 154,59
| -81,09
| -
| 43,63
|
| CH3CHO (г)
| -166,0
| 264,2
| 13,02
| 153,51
| -53,72
| -
| 54,64
|
| C6H12 (г)
| -123,2
| 298,4
| -51,75
| 598,87
| -230,0
| -
| 106,34
|
ФАЗОВЫЕ РАВНОВЕСИЯ
Термодинамическая теория фазовых равновесий и растворов позволяет на основе опытных данных по диаграммам состояния теоретически предвидеть и рассчитать условия для получения нужных продуктов путем испарения, кристаллизации, экстракции и других фазовых переходов.
Прежде чем приступить к решению задач по разделу фазовые равновесия, следует проработать соответствующий лекционный материал. По учебнику [1] изучить теоретический материал и разобрать решения типовых задач по задачнику [2].
При выполнении задания следует учесть, что общие закономерности, которым подчиняются равновесные системы, содержащие любое число фаз и компонентов, устанавливаются «правилом фаз» Гиббса, согласно которому
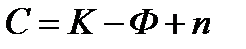 ,
,
где К – число компонентов системы, Ф – число фаз, n – число внешних факторов, определяющих существование системы (p, T, c), С – число степеней свободы, показывающая число переменных, которым можно придавать произвольные значения, не изменяя число фаз.
Количественно условие равновесия фаз в однокомпонентных системах выражается уравнением Клаузиуса:
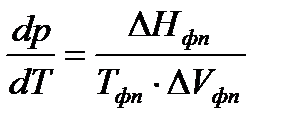 ,
,
где  - производная, описывающая изменение давления пара над жидкостью или твердым телом при испарении или возгонке;
- производная, описывающая изменение давления пара над жидкостью или твердым телом при испарении или возгонке;  - молярная теплота равновесного фазового перехода при температуре
- молярная теплота равновесного фазового перехода при температуре  и давлении
и давлении 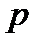 ;
; 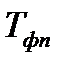 - температура фазового перехода;
- температура фазового перехода; 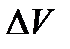 - изменение объема одного моля вещества при фазовом переходе.
- изменение объема одного моля вещества при фазовом переходе.
Интегрирование уравнения Клаузиуса из предположения  для равновесия газ-жидкость и газ-твердое тело приводит к уравнению Клаузиуса-Клапейрона:
для равновесия газ-жидкость и газ-твердое тело приводит к уравнению Клаузиуса-Клапейрона:
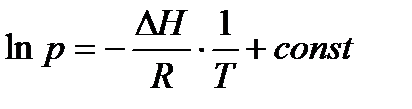 .
.
Поэтому для системы газ-жидкость тангенс угла наклона зависимости ln р =f(1/Т) дает значение 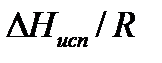 , а для системы газ-твердое тело – значение
, а для системы газ-твердое тело – значение 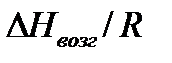 . Точка пересечения этих прямых дает координаты тройной точки.
. Точка пересечения этих прямых дает координаты тройной точки.
Температуру кипения Ткип вещества при нормальном давлении определяют по формуле, полученной из уравнения Клаузиуса-Клапейрона:
 .
.
Для проверки применимости правила Трутона к данной системе необходимо найти отношение 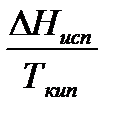 . Если оно отличается от значения
. Если оно отличается от значения
89 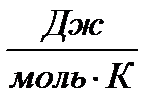 , то правило Трутона не применимо.
, то правило Трутона не применимо.
Взаимосвязь параметров в равновесной системе газ-твердое тело выражается уравнением:
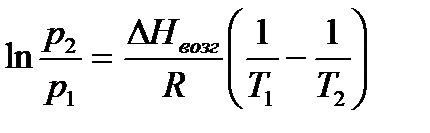 .
.
Теплоту плавления вещества  при температуре тройной точки определяют исходя из теплоты возгонки и теплоты испарения:
при температуре тройной точки определяют исходя из теплоты возгонки и теплоты испарения:
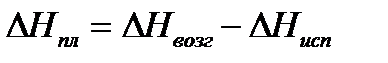 .
.
Подставив полученное значение  в уравнение Клаузиуса, можно вычислить значение dT/dр. Для определения изменения молярного объема
в уравнение Клаузиуса, можно вычислить значение dT/dр. Для определения изменения молярного объема 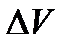 пл при плавлении необходимо сначала через обратные величины плотности
пл при плавлении необходимо сначала через обратные величины плотности 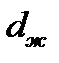 и
и 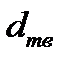 найти удельные объемы жидкой и твердой фаз, и затем определить их молярные объемы. Отношение dT/dр позволяет определить изменение температуры плавления при давлении р, которое дано в столбце «Условие» таблицы 2.1.
найти удельные объемы жидкой и твердой фаз, и затем определить их молярные объемы. Отношение dT/dр позволяет определить изменение температуры плавления при давлении р, которое дано в столбце «Условие» таблицы 2.1.
Параметры процесса возгонки определяют по следующим формулам:
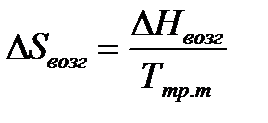 ,
, 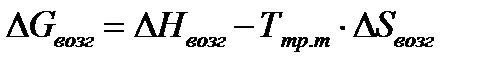 ,
,
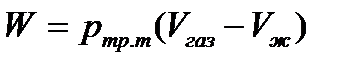 ,
, 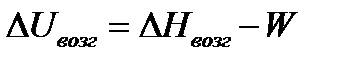 .
.
Определение числа термодинамических степеней свободы проводят, используя «правило фаз» Гиббса.
Литература: [1], с. 152 – 181; [2], с. 67 – 71.
Задание 1.2.1.Анализ фазовой диаграммы
По зависимости давления насыщенного пара от температуры и плотности данного вещества А в твердом и жидком состояниях (d тв и d ж в кг/м3, М в г/моль) в тройной точке (тр. т.):
1) постройте график зависимости ln р = f (1/Т);
2) определите по графику координаты тройной точки;
3) рассчитайте среднюю теплоту испарения и возгонки;
4) определите приближенно температуру кипения вещества при нормальном давлении и проверьте применимость правила Трутона;
5) определите теплоту плавления вещества при температуре тройной точки Ттр.т;
6) вычислите dT/dP для процесса плавления при температуре тройной точки;
7) вычислите температуру плавления вещества при давлении р, Па;
8) вычислите изменение энтропии, изобарно-изотермического потенциала, внутренней энергии и работы для процесса возгонки 1 моль вещества в тройной точке;
9) определите число термодинамических степеней свободы при следующих значениях температуры и давления: а) Ттр.т, ртр.т; б) Тн.т.к ., р =1 атм; в) Тн.т.к ., ртр.т ..
Необходимые для расчета данные приведены в таблице 1.2, согласно вашему варианту.
Таблица 1.3 Варианты к заданию 1.2
| № варианта
| Твердое состояние
| Жидкое состояние
| Условие
|
| Т, К
| P, Па
| Т, К
| P, Па
|
| 1
| 248
254,4
258
259
260
| 7998
13300
17995
19995
23327
| 260
265
270
278
280
282
| 23330
27190
31860
40290
40555
47990
| М=27
р=800·105
dтв=718
dж=709
|
| 2
| 55
58
60
62
63
64
| 1333
3999
7331,5
11997
14663
17329
| 60
64
66
67,8
69
71
| 12663
17329
22394
27993
31992
39990
| М=28
р=500·105
dтв=1026
dж=808
|
| 3
| 100
104
107
109
110,5
112
| 4132
8531
14663
19995
25367
29653
| 105
112
114
115
116
117
| 17329
29659
34738
38657
46435
53053
| М=30
р=900·105
dтв=1272
dж=1260
|
| 4
| 229,2
248,0
257,0
267,2
278,3
| 133,3
694,5
1333
2966
5332
| 278,2
285,7
298,2
302,2
304,2
306,2
| 5986
6665
12697
16396
18929
21328
| М=32
р=300·105
dтв=837
dж=825
|
| 5
| 173
178
183
186
| 7330
11600
16795
19995
| 186
190
196
198
201,6
206
208
| 27000
31192
38657
46655
55986
69476
77314
| М=34
р=450·105
dтв=1010
dж=980
|
| 6
| 196
203
213
220
| 101325
190491
402360
648480
| 212
220
223
239
241
242
| 591751
648480
674824
1005114
1065237
1131722
| М=44
р=750·105
dтв=1542
dж=1510
|
| 7
| 276,6
278,2
279,2
280,2
281,2
| 1413
1706
1879
2066
2319
| 277,2
279,2
281,4
283,2
285,2
288,7
| 1826
2052
2372
2626
2932
3279
| М=46
р=950·105
dтв=1240
dж=1230
|
| 8
| 230
233
237
240
243
245
| 26260
31458
39990
49987
58518
66650
| 236
246
248
249
251
252
| 63615
78647
83979
86645
96942
100508
| М=52
р=350·105
dтв=3010
dж=2955
|
| 9
| 1758,2
1788,2
1810,2
1835,2
1873,2
| 22,66
63,98
99,97
115,99
266,60
| 1832
1905
1938
1956
1991
2010
| 187
387
486
573
800
973
| М=52,5
р=500·105
dтв=6800
dж=6750
|
| 10
| 242,1
252,4
263,8
271,2
280,9
293,0
| 1333
2666
5332
7998
13330
26660
| 293
303
308
314
313
316
| 26660
37724
46188
51720
56186
63317
| М=58
р=700·105
dтв=822
dж=812
|
| 11
| 183,2
188,0
196,2
199,2
203,7
| 333,3
586,5
1850
3000
5305
| 201
204
214
219
230,2
| 4665,5
5305
7196
7998
13328
| М=64
р=1000·105
dтв=1600
dж=1560
|
| 12
| 131
136,5
137
139,2
141,5
144
| 1333
1999,5
2666
3999
5332
7998
| 137
141
144
146
149
151,4
| 6665
7331,5
8664,5
9997,5
12663
15996
| М=68
р=200·105
dтв=1450
dж=1434
|
| 13
| 177,3
180
182
184
185,5
| 15996
19995
23994
28659
31992
| 180
185,5
188
191
194
196,8
| 26660
32992
37057
43456
51987
59985
| М=81
р=300·105
dтв=1626
dж=1610
|
| 14
| 272,5
274,2
275,7
277,2
279,2
281,7
| 3332,5
3599,1
4065,6
4398,9
5065,4
5798,6
| 275,7
280,2
281,7
283,3
285,2
286,7
| 4878,8
5598,6
5798,6
6198,5
6931,6
7731,4
| М =84
р=120·105
dтв=796
dж=788
|
| 15
| 353,2
363,2
373,2
383,2
393,2
| 39,99
79,98
186,6
393,2
679,8
| 363,2
393,2
395,2
400,7
403,7
408,7
| 186,6
679,8
733,1
973,1
1133
1399,6
| М=122
р=850·105
dтв=1105
dж=1095
|
| 16
| 205,2
205,7
209,2
213,2
216,4
221,2
| 16796
19195
22662
29859
35991
45988
| 219,2
224,2
226,7
229,2
231,2
232,7
| 55319
59985
66650
75981
83979
87975
| М=127,5
р=500·105
dтв=2970
dж=2850
|
| 17
| 334,6
338,4
343,2
348,2
353,2
353,7
| 266,6
352,2
533,2
733,1
1039,7
1266,3
| 248,2
353,7
358,2
363,8
368,8
373,8
| 1046
1266
1399
1666
2066
2466
| М=128
р=180·105
dтв=1145
dж=982
|
| 18
| 423,5
433,2
437,7
441,2
444,2
448,2
| 23994
31325
35324
39323
43322
47454
| 446,4
448,2
451,2
457,2
462,2
468,2
| 47000
47555
49987
55986
63317
71345
| М=152
р=600·105
dтв=985
dж=977
|
ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика – это учение о химическом процессе, его механизме и закономерностях протекания во времени.
Законы химической кинетики позволяют:
- рассчитать значение константы скорости химической реакции;
- определить механизм реакции по кинетическим кривым;
- прогнозировать влияние на скорость реакции температуры, концентрации реагентов, катализаторов, рН среды;
- количественно охарактеризовать ферментативные реакции.
До выполнения задания по химической кинетике следует проработать лекционный материал соответствующего раздела. По учебнику [1] изучить теоретический материал и разобрать решения типовых задач по задачнику [2]. При выполнении задания 3.1 и 3.2 советуем воспользоваться формулами, приведенными в таблице 3.1 и уравнением Аррениуса:
 ,
,
где 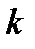 - константа скорости реакции при температуре
- константа скорости реакции при температуре  ;
; 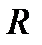 - универсальная газовая постоянная;
- универсальная газовая постоянная; 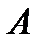 - предэкспоненциальный множитель;
- предэкспоненциальный множитель; 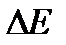 - энергия активации реакции.
- энергия активации реакции.
Если известны константы скорости 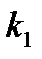 и
и 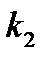 для данной реакции при
для данной реакции при
двух разных температурах 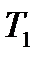 и
и 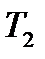 , то энергию активации реакции определяют по формуле:
, то энергию активации реакции определяют по формуле:
 .
.
Обратите внимание на то, что единицы измерения константы скорости зависят от порядка кинетического уравнения реакции. Для реакции первого порядка молярные концентрации могут быть заменены любым другим способом выражения состава системы (массовая доля, массовая концентрация и др.), но обязательно одинаковыми для С0 и С t.
Кинетика ферментативных реакций (задание 3.3.) описывается уравнением Михаэлиса-Ментен:
v 0 = 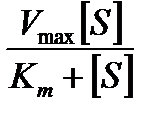 ,
,
где Km и Vmax – кинетические параметры, отражающие механизм действия фермента, [S] – концентрация субстрата.
Для определения параметров этого уравнения удобнее использовать уравнение Лайнуивера – Берка:
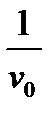 =
= 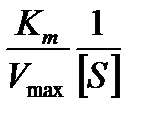 +
+  .
.
Таблица 1.4 Соотношения для определения констант и времени полупревращения в реакциях различного порядка
| Порядок
реакции
| Дифференциаль-ное
уравнение
| Константа скорости, k
| Время полупревращения, 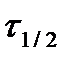
| Размер-ность константы скорости, k
|
| 0
| 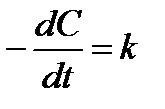
| 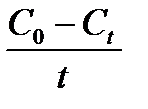
| 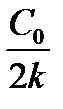
| 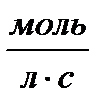
|
| 1
| 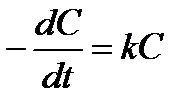
| 
| 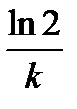
| 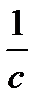
|
| 2
(Тип I)
| 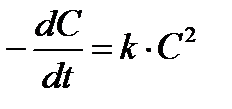
| 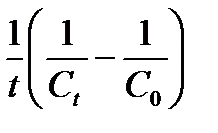
| 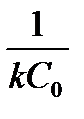
| 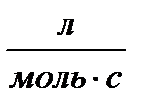
|
| 2
(Тип II)
| 
| 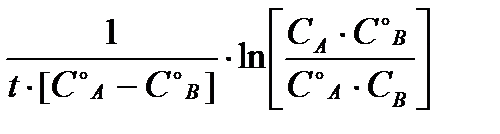
| 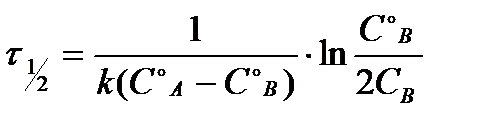
 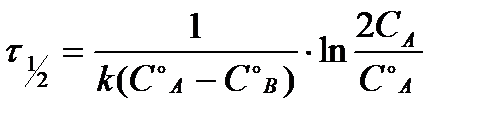
| 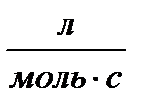
|
Литература: [1], с. 284 – 316, 447 – 454; [2], с. 169-173, 177-181, 185-186, 192-197, 222-232.
Задание 1.3.1 Методы определения порядка реакции
1. При окислении 2-пропанола диметилдиоксираном были получены сле дующие экспериментальные данные:
| t, c
| 0
| 100
| 200
| 300
| 400
| 500
|
| [ДМДО]×103, моль/л
| 14
| 11
| 8,5
| 6,7
| 5,4
| 4
|
Определите порядок реакции дифференциальным методом, константу скорости реакции и период полураспада.
2. При окислении 2-пропанола диметилдиоксираном были получены следующие экспериментальные данные:
| t, с
| 0
| 100
| 200
| 300
| 400
| 500
|
| [ДМДО]×103, моль/л
| 14
| 11
| 8,5
| 6,7
| 5,4
| 4
|
Определите порядок реакции интегральным методом (методом подстановки и графическим методом), константу скорости реакции и период полураспада.
3. При окислении 1-бутанола хлоридом 2,2,6,6 –тетраметилпиперидин-1-оксила получили следующие данные:
| t1/2, с
| 1200
| 800
| 620
| 470
| 380
|
| [ROH]0, моль/л
| 0,015
| 0,022
| 0,029
| 0,037
| 0,044
|
Определите порядок реакции аналитическим и графическим 3-им интегральным методом и рассчитайте константу скорости реакции.
4. При изучении кинетики гидролиза сахарозы были получены следующие данные.
| t, мин
| 0
| 30
| 90
| 130
| 180
|
| [C12H22O11], моль/л
| 0,5
| 0,451
| 0,363
| 0,315
| 0,267
|
Определите порядок реакции дифференциальным методом, константу скорости и период полураспада.
5. При изучении кинетики гидролиза сахарозы были получены следующие данные:
| t, мин
| 0
| 30
| 90
| 130
| 180
|
| [C12H22O11], моль/л
| 0,5
| 0,451
| 0,363
| 0,315
| 0,267
|
Определите порядок реакции интегральным методом (методом подстановки и графическим методом), константу скорости и период полураспада.
6. При исследовании кинетики каталитического разложения аммиака при Т=1373 К получены следующие результаты:
| t1/2, с
| 456
| 222
| 102
|
| Р, кПа
| 35,32
| 17,32
| 7,73
|
Определите порядок реакции аналитическим и графическим 3-им интегральным методом и рассчитайте константу скорости реакции.
7. При исследовании кинетики каталитического разложения аммиака при Т=1373 К получены следующая зависимость парциального давления аммиака от времени:



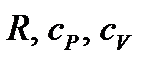 , то полученное значение термодинамической функции необходимо умножить на число молей вещества.
, то полученное значение термодинамической функции необходимо умножить на число молей вещества.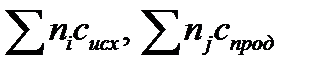 и DНТ в зависимости от температуры. Для этого воспользуйтесь данными таблицы 1.3 и 1.4.
и DНТ в зависимости от температуры. Для этого воспользуйтесь данными таблицы 1.3 и 1.4.
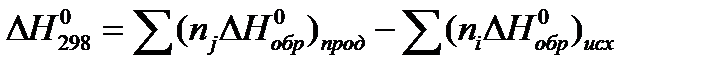
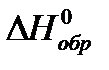 компонентов приведены в таблице 1.4.
компонентов приведены в таблице 1.4. ,
, - разность суммы теплоемкостей продуктов и исходных реагентов
- разность суммы теплоемкостей продуктов и исходных реагентов ,
, . Тогда
. Тогда 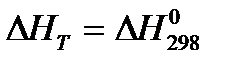 .
.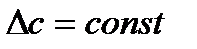 . Тогда
. Тогда  вычисляют по формуле
вычисляют по формуле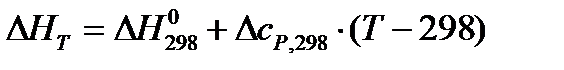 .
.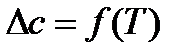 . При этом допущении необходимо учитывать температурную зависимость теплоемкости компонентов реакционной системы
. При этом допущении необходимо учитывать температурную зависимость теплоемкости компонентов реакционной системы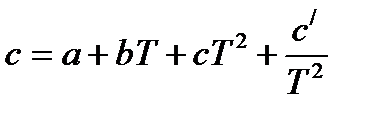 ,
,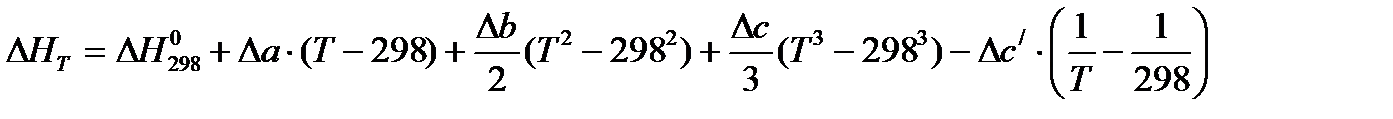 ,
,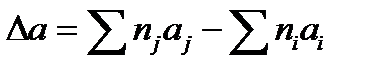 . Параметры
. Параметры  рассчитываются аналогичным образом. Значения а, b, c, c/ компонентов реакции приведены в таблице 1.4.
рассчитываются аналогичным образом. Значения а, b, c, c/ компонентов реакции приведены в таблице 1.4. ,
,  и
и 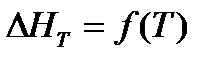 строятся по четырем значениям температуры, при этом необходимо произвольно выбрать два промежуточных значения температуры и вычислить соответствующие им параметры
строятся по четырем значениям температуры, при этом необходимо произвольно выбрать два промежуточных значения температуры и вычислить соответствующие им параметры 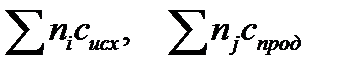 и
и  .
.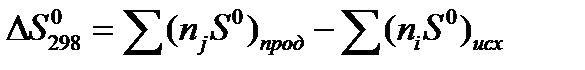 .
.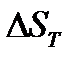 необходимо учитывать температурную зависимость теплоемкости компонентов от температуры:
необходимо учитывать температурную зависимость теплоемкости компонентов от температуры: .
. проводят по формуле
проводят по формуле .
.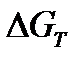 определяют по аналогичной формуле
определяют по аналогичной формуле .
.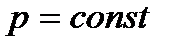
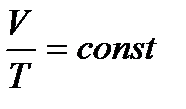
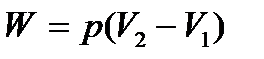

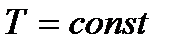

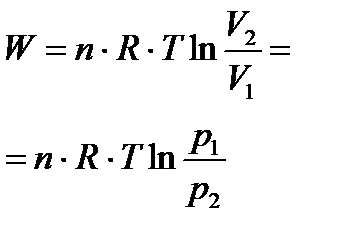
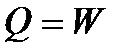
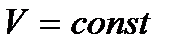
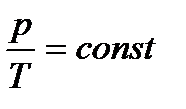
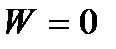
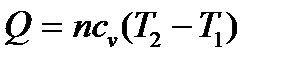
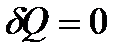
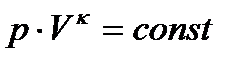
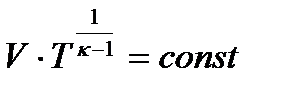

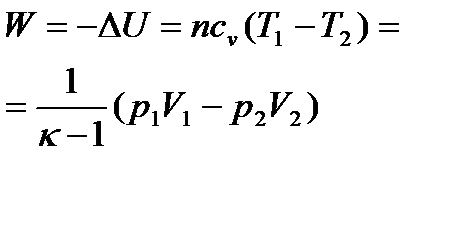

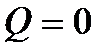
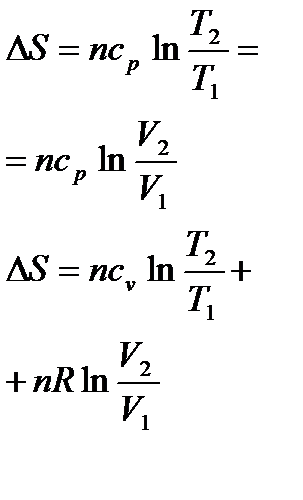

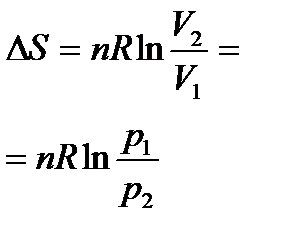
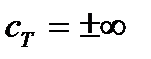
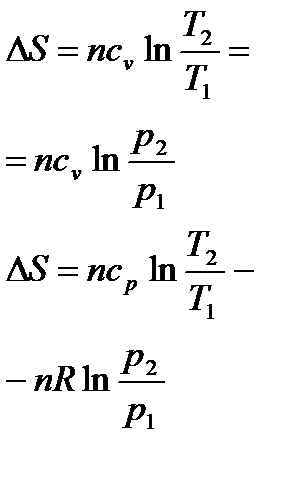
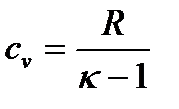
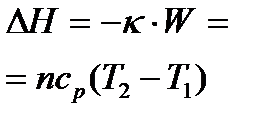
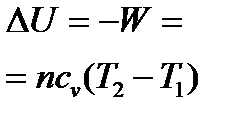
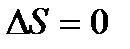
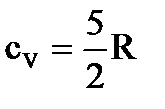 .
.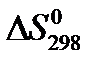 и D S Т для реакции;
и D S Т для реакции;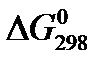 и D G Т и сделайте вывод о направлении реакции в стандартных условиях и при температуре Т.
и D G Т и сделайте вывод о направлении реакции в стандартных условиях и при температуре Т.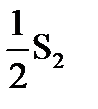 (г) + 2Н2О (г) = SO2 (г) + 2H2 (г)
(г) + 2Н2О (г) = SO2 (г) + 2H2 (г)
 (г) + 2СО2 (г) = SO2 (г) + 2CO(г)
(г) + 2СО2 (г) = SO2 (г) + 2CO(г)

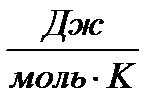
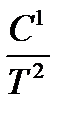 + C Т2,
+ C Т2, 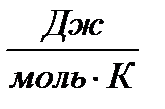
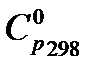 ,
,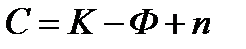 ,
,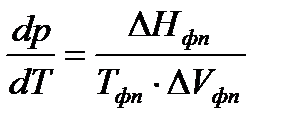 ,
, - производная, описывающая изменение давления пара над жидкостью или твердым телом при испарении или возгонке;
- производная, описывающая изменение давления пара над жидкостью или твердым телом при испарении или возгонке;  - молярная теплота равновесного фазового перехода при температуре
- молярная теплота равновесного фазового перехода при температуре  и давлении
и давлении  ;
;  - температура фазового перехода;
- температура фазового перехода; 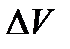 - изменение объема одного моля вещества при фазовом переходе.
- изменение объема одного моля вещества при фазовом переходе. для равновесия газ-жидкость и газ-твердое тело приводит к уравнению Клаузиуса-Клапейрона:
для равновесия газ-жидкость и газ-твердое тело приводит к уравнению Клаузиуса-Клапейрона: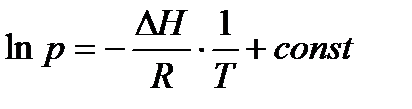 .
.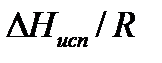 , а для системы газ-твердое тело – значение
, а для системы газ-твердое тело – значение 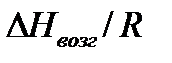 . Точка пересечения этих прямых дает координаты тройной точки.
. Точка пересечения этих прямых дает координаты тройной точки. .
.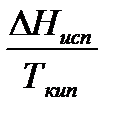 . Если оно отличается от значения
. Если оно отличается от значения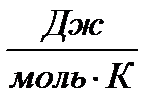 , то правило Трутона не применимо.
, то правило Трутона не применимо.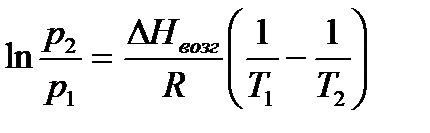 .
. при температуре тройной точки определяют исходя из теплоты возгонки и теплоты испарения:
при температуре тройной точки определяют исходя из теплоты возгонки и теплоты испарения: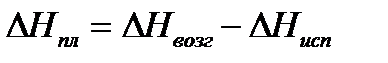 .
.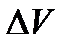 пл при плавлении необходимо сначала через обратные величины плотности
пл при плавлении необходимо сначала через обратные величины плотности 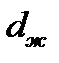 и
и 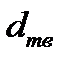 найти удельные объемы жидкой и твердой фаз, и затем определить их молярные объемы. Отношение dT/dр позволяет определить изменение температуры плавления при давлении р, которое дано в столбце «Условие» таблицы 2.1.
найти удельные объемы жидкой и твердой фаз, и затем определить их молярные объемы. Отношение dT/dр позволяет определить изменение температуры плавления при давлении р, которое дано в столбце «Условие» таблицы 2.1.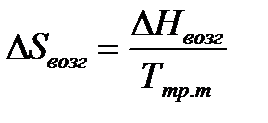 ,
, 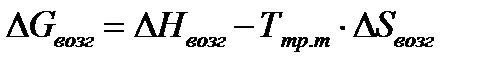 ,
, 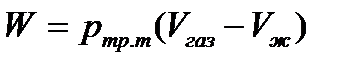 ,
, 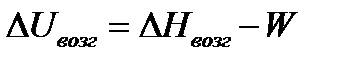 .
. ,
,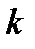 - константа скорости реакции при температуре
- константа скорости реакции при температуре 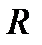 - универсальная газовая постоянная;
- универсальная газовая постоянная; 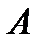 - предэкспоненциальный множитель;
- предэкспоненциальный множитель; 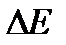 - энергия активации реакции.
- энергия активации реакции.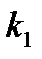 и
и 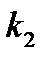 для данной реакции при
для данной реакции при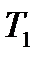 и
и 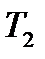 , то энергию активации реакции определяют по формуле:
, то энергию активации реакции определяют по формуле: .
.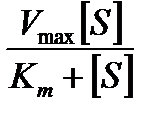 ,
,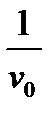 =
= 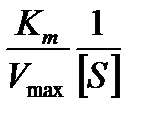 +
+  .
.